Слайд 3
Роль белковых малекул в функционировании живых организмов
Во всех

растениях и животных присутствует некое вещество, которое без сомнения
является наиболее важным из всех известных веществ живой природы и без которого жизнь была бы на нашей планете невозможна. Это вещество я наименовал - протеин". Так писал еще в 1838 году голландский биохимик Жерар Мюльдер, который впервые открыл существование в природе белковых тел и сформулировал свою теорию протеина. Слово "протеин" (белок) происходит от греческого слова "протейос", что означает "занимающий первое место". И в самом деле, все живое на земле содержит белки. Они составляют около 50% сухого веса тела всех организмов. У вирусов содержание белков колеблется в пределах от 45 до 95%.
Белки, или, как их иначе называют, протеины, имеют очень сложное строение и являются наиболее сложными из питательных веществ. Белки - обязательная составная часть всех живых клеток. В состав белков входят: углерод, водород, кислород, азот, сера и иногда фосфор. Наиболее характерно для белка наличие в его молекуле азота. Другие питательные вещества азота не содержат.
Слайд 4
Белки являются одними из четырех основных органических
веществ живой материи (белки, нуклеиновые кислоты, углеводы, жиры), но
по своему значению и биологическим функциям они занимают в ней особое место. Около 30% всех белков человеческого тела находится в мышцах, около 20% - в костях и сухожилиях и около 10% - в коже. Но наиболее важными белками всех организмов являются ферменты, которые, холя и присутствуют в их теле и в каждой клетке тела в малом количестве, тем не менее управляют рядом существенно важных для жизни химических реакций. Все процессы, происходящие в организме: переваривание пищи, окислительные реакции, активность желез внутренней секреции, мышечная деятельность и работа мозга регулируется ферментами. Разнообразие ферментов в теле организмов огромно. Даже в маленькой бактерии их насчитываются многие сотни.
Слайд 5
Белки играют важнейшую роль в
жизнедеятельности всех организмов. При пищеварении белковые молекулы перевариваются до
аминокислот, которые, будучи хорошо растворимы в водной среде, проникают в кровь и поступают во все ткани и клетки организма. Здесь наибольшая часть аминокислот расходуется на синтез белков различных органов и тканей, часть-на синтез гормонов, ферментов и других биологически важных веществ, а остальные служат как энергетический материал. Т.е. белки выполняют каталитические (ферменты), регуляторные (гормоны), транспортные (гемоглобин, церулоплазмин и др.), защитные (антитела, тромбин и др.) функции
Слайд 6
. Белки - это биополимеры сложного строения, макромолекулы
(протеины) которых, состоят из остатков аминокислот, соединенных между собой
амидной (пептидной) связью. Кроме длинных полимерных цепей, построенных из остатков аминокислот (полипептидных цепей), в макромолекулу белка могут входить также остатки или молекулы других органических соединений.
Белки, или, как их иначе называют, протеины, имеют очень сложное строение и являются наиболее сложными из питательных веществ. Белки - обязательная составная часть всех живых клеток. В состав белков входят: углерод, водород, кислород, азот, сера и иногда фосфор. Наиболее характерно для белка наличие в его молекуле азота. Другие питательные вещества азота не содержат.
Слайд 7
Первичная структура белка
Первичная структура определяется порядком чередования аминокислот
в полипептидной цепи.
Первичная структура белка состоит из аминокислот.
Слайд 8
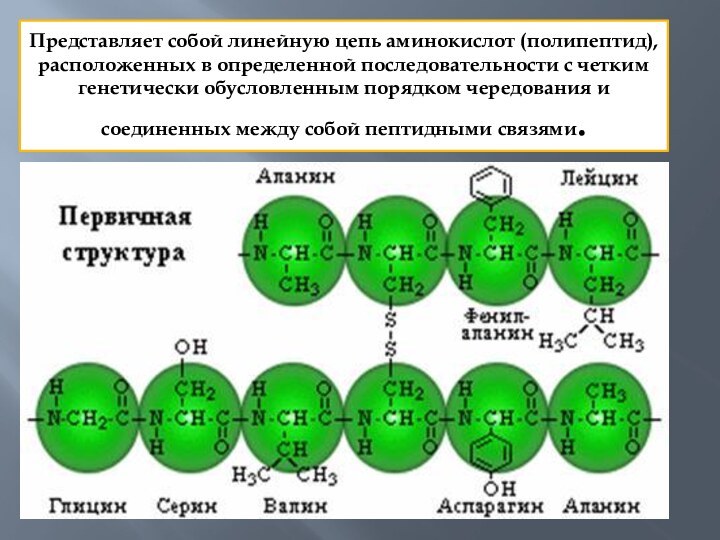
Представляет собой линейную цепь аминокислот (полипептид), расположенных в
определенной последовательности с четким генетически обусловленным порядком чередования и
соединенных между собой пептидными связями.
Слайд 9
АМИНОКИСЛО́ТЫ
-органические (карбоновые) кислоты, в составе которых имеется аминогруппа

(— NH2). Участвуют в обмене белков и углеводов, в
образовании важных для организмов соединений (например, пуриновых и пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот), входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов, антибиотикови т. д.; дигидроксифенилаланин (ДОФА) и g-аминомасляная кислота служат посредниками при передаче нервных импульсов.
В клетках и тканях живых организмов встречается около 300 различных аминокислот, но только 20 из них служат звеньями (мономерами), из которых построены пептиды и белки всех организмов (поэтому их называют белковыми аминокислотами). Последовательность расположения этих аминокислот в белках закодирована в последовательности нуклеотидов соответствующих генов (см. Генетический код). Остальные аминокислоты встречаются как в виде свободных молекул, так и в связанном виде. Многие из аминокислот встречаются лишь в определенных организмах, а есть и такие, которые обнаруживаются только в одном из великого множества описанных организмов.
Слайд 10
Аминокислотные остатки – мономеры белковых цепей.
Одни и те
же аминокислоты присутствуют в различных по структуре и функциям
белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке. Аминокислоты можно рассматривать как буквы алфавита, при помощи которых, как в слове, записывается информация. Слово несёт информацию, например о предмете или действии, а последовательность аминокислот в белке несёт информацию о построении пространственной структуры и функции данного белка
Белки - обязательная составная часть всех клеток. В состав этих биополимеров входят мономеры 20 типов. Такими мономерами являются аминокислоты, которые получили свое название потому, что содержат и аминогруппу (-NH2), и кислотную карбоксильную группу (-СООН). Каждая из 20 аминокислот имеет одинаковую часть, включающую обе эти группы,
и отличается от любой другой особой химической группировкой, так называемой R-группой, или радикалом
Слайд 11
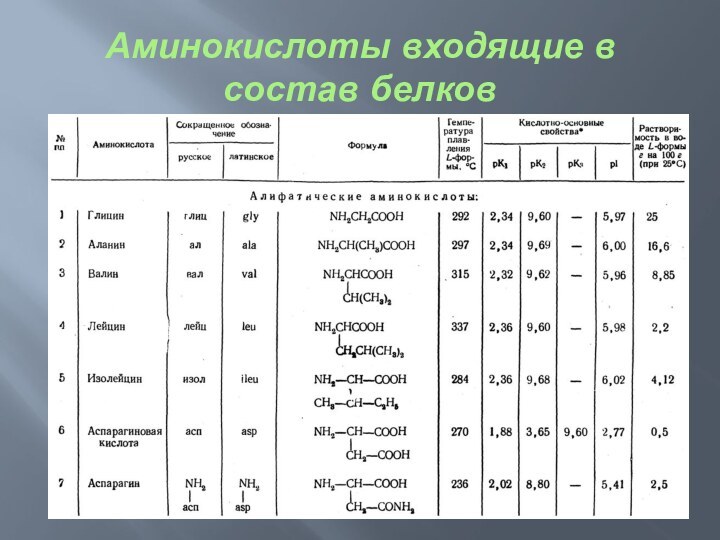
Аминокислоты входящие в состав белков
Слайд 12
Аминокислоты не входящие в состав белков
Слайд 13
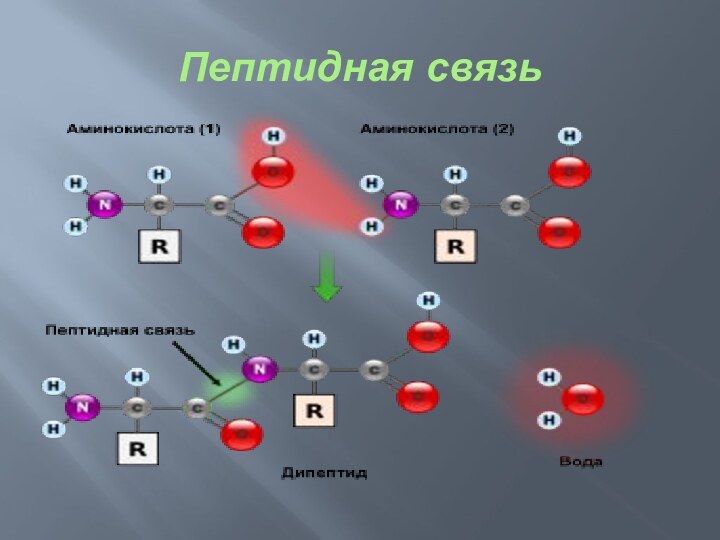
Пептидная связь
— вид амидной связи, возникающей при образовании
белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной
аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
Слайд 17
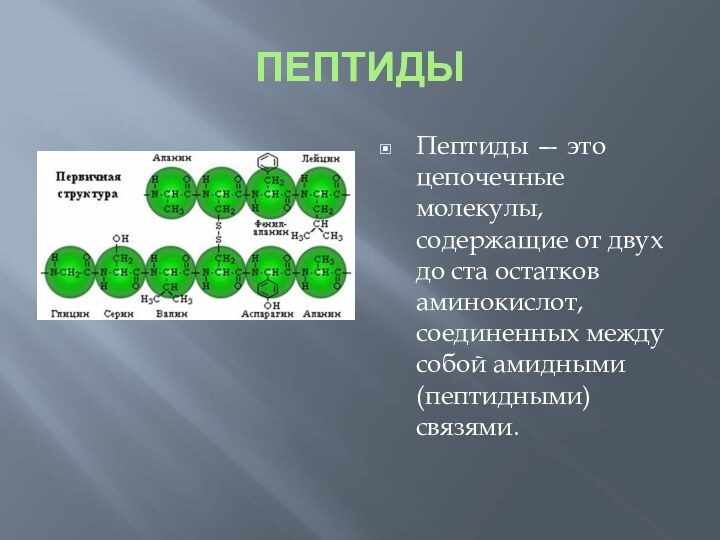
ПЕПТИДЫ
Пептиды — это цепочечные молекулы, содержащие от двух
до ста остатков аминокислот, соединенных между собой амидными (пептидными)
связями.
Слайд 18
Общие свойства пептидов
Свойства пептидов
Пептиды постоянно синтезируются во
всех живых организмах для регулирования физиологических процессов. Свойства пептидов
зависят, главным образом, от их первичной структуры — последовательности аминокислот, а также от строения молекулы и её конфигурации в пространстве (вторичная структура).
Слайд 19
Природные пептиды
Природные пептиды, наделенные биологической активностью, в зависимости
от характера действия и происхождения принято делить на 4
группы: 1) пептиды, обладающие гормональной активностью (вазопрессин, окси-тоцин, кортикотропин, глюкагон, кальцитонин, меланоцитстимулирующий гормон, рилизинг-факторы гипоталамуса и др.; см. главу 8); 2) пептиды, принимающие участие в процессе пищеварения (в частности, гастрин и секретин; см. главу 12); 3) пептиды, источник которых – α2-глобулиновая фракция сыворотки крови (такие, как ангиотензин, брадикинин и каллидин); 4) нейропептиды.
Слайд 20
Волокна содержат природные пептиды шелка
Слайд 21
Уровни организации белковой малекулы
Для того чтобы разобраться в

замысловатой укладке (архитектонике) белковой макромолекулы, следует рассмотреть в ней
несколько уровней организации. Первичной, самой простой структурой является полипептидная цепь, т. е. нить аминокислот, связанных между собой пептидными связями. В первичной структуре все связи между аминокислотами являются ковалентными и, следовательно, прочными
Следующий, более высокий уровень организации - это вторичная структура, когда белковая нить закручена в виде спирали. Между группами -СООН, находящимися на одном витке спирали, и группами -NH2 на другом витке образуются водородные связи. Они возникают на основе водорода, чаще всего находящегося между двумя отрицательными атомами (см. рис. 7 ). Водородные связи слабее ковалентных, но при большом их числе обеспечивают образование достаточно прочной структуры. Нить аминокислот (полипептид) далее свертывается, образуя клубок, или фибриллу или глобулу, для каждого белка специфичную. Таким образом, возникает сложная конфигурация, называемая третичной структурой . Определение ее производят обычно с помощью метода рентгеноструктурного анализа , который позволяет установить положение в пространстве атомов и групп атомов в кристаллах и сложных соединениях.
Слайд 22
Уровни организации белковой малекулы
Связи, поддерживающие третичную структуру

белка, также слабые. Они возникают, в частности, вследствие гидрофобных
взаимодействий. Это силы притяжения между неполярными молекулами или между неполярными участками молекул в водной среде. Гидрофобные остатки некоторых аминокислот в водном растворе сближаются, "слипаются" и стабилизируют, таким образом, структуру белка. Кроме гидрофобных сил, в поддержании третичной структуры белка существенную роль играют электростатические связи между электроотрицательными и электроположительными радикалами аминокислотных остатков. Третичная структура поддерживается также небольшим числом ковалентных дисульфидных -S-S-связей, возникающих между атомами серы серусодержащих аминокислот. Надо сказать, что и третичная; структура белка не является конечной. К макромолекуле белка нередко оказываются присоединенными макромолекулы такого же белка или молекулы иных белков. Например, сложная молекула гемоглобина - белка, находящегося в эритроцитах, состоит из четырех макромолекул глобинов: двух альфа-цепей и двух бета-цепей, каждая из которых соединена с железосодержащим гемом. В результате их объединения образуется функционирующая молекула гемоглобина (см. рис. 7 ). Только в такой упаковке гемоглобин работает полноценно, т. е. способен переносить кислород. Благодаря соединению нескольких молекул белков между собой образуется четвертичная структура (см. рис. 7 ). Если пептидные цепи уложены в виде клубка, то такие белки называются глобулярными. Если полипептидные цепи уложены в пучки нитей, они носят название фибриллярных белков. Начиная со вторичной структуры пространственное устройство (конформация) макромолекул белка, как мы выяснили, поддерживается в основном слабыми химическими связями. Под влиянием внешних факторов (изменение температуры, солевого состава среды, рН, под действием радиации и иных факторов) слабые связи, стабилизирующие макромолекулу, рвутся, и структура белка, а следовательно, и его свойства изменяются. Этот процесс называется денатурацией . Разрыв части слабых связей, изменения конформации и свойств белка происходят и под действием физиологических факторов (например, под действием гормонов). Таким образом регулируются свойства белков: ферментов, рецепторов, транспортеров. Эти изменения структуры белка обычно легко обратимы. Разрыв большого числа слабых связей ведет к денатурации белка, которая может быть необратимой (например, свертывание яичного белка при кипячении яиц). Иногда и денатурация белка имеет биологический смысл. Например, паук выделяет капельку секрета и приклеивает ее к какой-нибудь опоре. Затем, продолжая выделять секрет, он слегка натягивает ниточку, и этого слабого натяжения оказывается достаточно, чтобы белок денатурировался, из растворимой формы перешел в нерастворимую, и нить приобрела прочность.
Слайд 23
Уровни организации белковой малекулы
Слайд 24
Доказательства уникальности белка
Прежде всего способность белков подвергаться

денатурации, т.е. претерпевать такие изменения пространственного строения, которые приводят
к утрате или частичной потере функциональных свойств. Правда, денатурация во многих случаях обратима, однако эта обратимость не обеспечивается автоматически, а требует в каждом отдельном случае подбора специальных приемов. В то же время полностью или даже частично денатурированные белки весьма уязвимы для необратимых повреждений, в особенности для действия протеолитических ферментов, поэтому условий, способствующих денатурации, следует всемерно избегать. Ферменты (fermentatio лат. – брожение), другое их название – энзимы (en zumh греч. – в дрожжах) – это белки, обладающие каталитической активностью, они способны увеличивать скорости биохимических процессов в тысячи раз.
Под действием ферментов составные компоненты пищи: белки, жиры и углеводы – расщепляются до более простых соединений, из которых затем синтезируются новые макромолекулы, необходимые организму определенного типа. Ферменты принимают участие и во многих биохимических процессах синтеза, например, в синтезе белков (одни белки помогают синтезировать другие
Слайд 25
Микрогетерогенность белков
Различия в последовательности нуклеотидов отдельных тандемно повторяющихся
в геноме мономеров например, в составе мультигенных семейств multigene
family или сателлитных ДНК; у морских ежей в семействе генов гистонов (несколько сот повторов) М. обусловлена в основном изменениями в последовательности нуклеотидов нетранскрибируемых спейсеров, разделяющих гены 5 различных типов гистонов.
Слайд 26
Количественное определение аминокислотного белка
Среди азотистых веществ, входящих
в состав пищевых продуктов, растительного и животного происхождения главное
место принадлежит белкам. В связи с этим содержание белков в пищевых продуктах часто определяют на основании найденного в продукте количества общего азота; при этом при пересчете азота на белок исследуемого продукта учитывают процентное содержание азота в белке данного продукта; так, например, если азот составляет 16% белка продукта, то, очевидно, для пересчета найденного количества азота на белок нужно весовое количество азота умножить на 6,25. Таким образом, для данного случая пересчетным коэффициентом является число 6,25.
Слайд 27
Количественное определение аминокислотного белка
Этот способ расчета белка дает
представление о содержании в продуктах не чистого белка, а
так называемого «сырого протеина», так как вместе с азотом белка по обычно применяемому методу Кьельдаля определения азота, а пищевых продуктах одновременно определяется азот и других соединений, могущих присутствовать в пищевых продуктах; сюда относятся альбумозы и пептоны, аминокислоты, нуклеиновые кислоты, амиды, азотосодержащие экстрактивные вещества (креатин, мочевина, мочевая
кислота), алкалоиды(кофеин, теин, теобромин), некоторые глюкозиды( соланин, вицин, синигрин), некоторые азотосодержащие неорганические соединения( аммонийные и азотнокислые соли, свободный аммиак) и др. В отдельных случаях содержание некоторых из перечисленных веществ может достигать заметных размеров: так, содержание в мясе азотосодержащих экстрактивных веществ доходит до 10%.
Слайд 28
Методы количественных определений аминокислотного состава белка
М е
т о д К ь е л ь
д а л я состоит в том, что органические азотосодержащие вещества подвергаются разрушению с помощью крепкой серной кислоты с применением катализатора и при нагревании. При этом углерод и водород органических соединений полностью окисляются до СО2 и Н2О за счет кислорода, освобождающегося при восстановлении серной кислоты. Азот органических веществ отщепляется в виде аммиака, который с серной кислотой образует сульфат аммония.
При помощи крепкой щелочи разлагают затем сульфат аммония и освободившийся при этом аммиак отгоняют и улавливают в титрованный раствор серной кислоты, который берется с избытком. Обратным титрованием определяют этот избыток, а отсюда делают вывод о количестве кислоты, связавшейся с аммиаком и о количестве азота сожженного вещества.
Слайд 29
Методы определения количества
1.Биуретовый метод
2.Микробиуретовый метод
3.Метод Бредфорда
4.Метод Лоури
5.Спектрофотометрический метод

ы й м е т о д
.Основан на
образовании биуретового комплекса (имеет фиолетовый цвет) пептидных связей белков с двухвалентными ионами меди. В методе используют т. н. биуретовый реактив, состоящий из KOH, CuSO4 и цитрата натрия (или тартрата натрия). В образовавшемся комплексе медь связана с 4 азотами координационными связями, а с 2 кислородами — электростатическими. Полноценный комплекс образуется лишь с пептидами, состоящими более чем из 4 остатков.
Интенсивность окраски раствора прямо пропорциональна концентрации белка в сыворотке и определяется фотометрически.
К достоинствам метода стоит отнести его низкую чувствительность к посторонним веществам, невысокую погрешность.
М и к р о б и у р е т о в ы й м е т о д основан на образовании окрашенного в фиолетовый цвет комплекса, образующегося в результате взаимодействия пептидных связей с Cu2+ в щелочной среде. К 0,2 мл ПМ лимфоцитов, сыворотки или плазмы добавляли 3,5 мл раствора NаОН и 0,2 мл реактива Бенедикта. Выдерживали 15 мин при комнатной температуре и спектрофотометрировали на СФ — 46 при 330 нм. Построение калибровочного графика проводили по стандартному раствору белка.
М е т о д Б р э д ф о р д а один из наиболее популярных методов, используемый для определения концентрации белка в растворе. Метод определения концентрации белка по Брэдфорд успешно используется в случае измерения растворов с низкой концентрацией белка и растворов, содержащих компоненты, также обладающие значительным поглощением при 280 нм. Метод определения концентрации белка по Брэдфорд, так же, как и метод Лоури и BSA, требует построения стандартной калибровочной кривой перед измерением концентрации неизвестного белка.
Универсальность метода и его гибкость позволяют создавать модификации процедуры измерений для различных целей и типов измерений.
Метод Брэдфорд основан на сдвиге спектра поглощения кумасси (Coomassie Blue) в сторону значений 595 нм прямо пропорционально концентрации содержащегося в растворе белка. Кумасси образует комплекс с белком; этот комплекс измеряют при длине волны 595 нм. абсорбционная фотометрия комплекса кумасси / белок имеет очень высокую чувствительность и эффективна даже в случае следовых концентраций белков.
М е т о д Л о у р и. Метод количественного определения белка, основанный на измерении концентрации окрашенных продуктов, образующихся в результате сочетания двух химических реакций: биуретовой реакции на пептидную связь и взаимодействия реактива Фолина-Чокалтеу с ароматическими аминокислотами.
С п е к т р о ф о т о м е т р и ч е с к и й м е т о д. Спектрофотометрия (абсорбционная) — физико-химический метод исследования растворов и твёрдых веществ, основанный на изучении спектров поглощения в ультрафиолетовой (200—400 нм), видимой (400—760 нм) и инфракрасной (>760 нм) областях спектра. Основная зависимость, изучаемая в спектрофотометрии зависимость интенсивности поглощения падающего света от длины волны. Спектрофотометрия широко применяется при изучении строения и состава различных соединений (комплексов, красителей, аналитических реагентов и др.), для качественного и количественного определения веществ (определения следов элементов в металлах, сплавах, технических объектах).
у р и
Метод количественного определения
белка, основанный на измерении концентрации окрашенных продуктов, образующихся в результате сочетания двух химических реакций: биуретовой реакции на пептидную связь и взаимодействия реактива Фолина-Чокалтеу с ароматическими аминокислотами.
р е т о в ы й
м
е т о д
основан на образовании окрашенного в фиолетовый цвет комплекса, образующегося в результате взаимодействия пептидных связей с Cu2+ в щелочной среде. К 0,2 мл ПМ лимфоцитов, сыворотки или плазмы добавляли 3,5 мл раствора NаОН и 0,2 мл реактива Бенедикта. Выдерживали 15 мин при комнатной температуре и спектрофотометрировали на СФ — 46 при 330 нм. Построение калибровочного графика проводили по стандартному раствору белка.
э д ф о р д а
один из
наиболее популярных методов, используемый для определения концентрации белка в растворе. Метод определения концентрации белка по Брэдфорд успешно используется в случае измерения растворов с низкой концентрацией белка и растворов, содержащих компоненты, также обладающие значительным поглощением при 280 нм. Метод определения концентрации белка по Брэдфорд, так же, как и метод Лоури и BSA, требует построения стандартной калибровочной кривой перед измерением концентрации неизвестного белка
Слайд 34
Метод Брэдфорд
основан на сдвиге спектра поглощения кумасси
(Coomassie Blue) в сторону значений 595 нм прямо пропорционально
концентрации содержащегося в растворе белка. Кумасси образует комплекс с белком; этот комплекс измеряют при длине волны 595 нм. абсорбционная фотометрия комплекса кумасси / белок имеет очень высокую чувствительность и эффективна даже в случае следовых концентраций белков.
о т о м е т р и ч
е с к и й м е т о д.
Спектрофотометрия (абсорбционная) — физико-химический метод исследования растворов и твёрдых веществ, основанный на изучении спектров поглощения в ультрафиолетовой (200—400 нм), видимой (400—760 нм) и инфракрасной (>760 нм) областях спектра. Основная зависимость, изучаемая в спектрофотометрии зависимость интенсивности поглощения падающего света от длины волны. Спектрофотометрия широко применяется при изучении строения и состава различных соединений (комплексов, красителей, аналитических реагентов и др.), для качественного и количественного определения веществ (определения следов элементов в металлах, сплавах, технических объектах).
Слайд 37
Биохимические анализаторы
Биохимические анализаторы позволяют повысить производительность и рентабельность

работы лабораторий. Это оборудование упрощает и автоматизирует процесс проведения
исследований от этапа подготовки образцов до получения конечных результатов, позволяет сократить время выполнения анализов и улучшить качество исследований. Кроме выполнения рутинных задач (определение субстратов, ферментов, специфических белков, электролитов, гормонов) анализаторы могут быть использованы для определения терапевтических лекарственных средств, наркотиков, алкоголя. Разнообразие моделей позволяет выбрать анализатор
нужной производительности. анализатор для экспресс лабораторий, реанимационных служб и блоков интенсивной терапии, определяет 9 параметров (глюкоза, азот мочевины, креатинин, кальций, общий белок, натрий, калий, хлориды, CO2) менее чем за 1 минуту. Производительность до 625 тестов в час. Все анализаторы со-
вместимы с любыми компьютерными сетями, их можно подключить к
абораторной информационной системе или управлять несколькими
анализаторами с одного компьютера.
Слайд 39
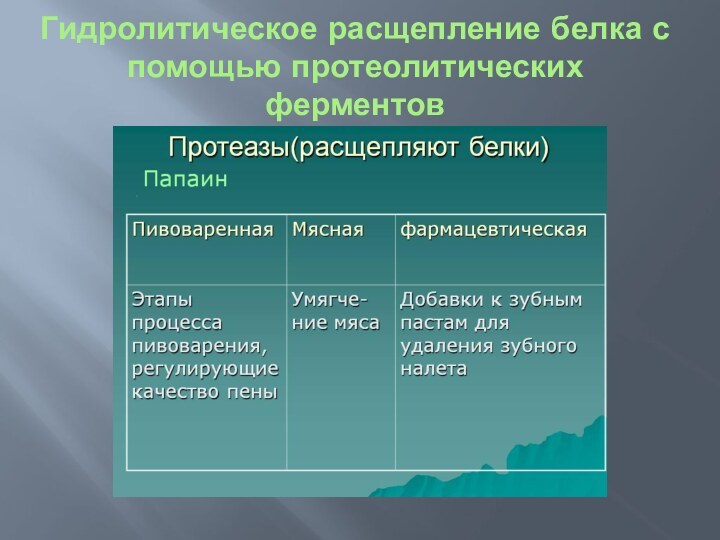
Гидролитическое расщепление белка с помощью протеолитических ферментов
Слайд 40
Протеазы, протеолиз
Протеолиз (проте [ины] + lysis разложение, распад)
— ферментативный гидролиз белков и пептидов, катализируется протеолитическими ферментами
(пептид-гидролазами, протеазами) и играет важную роль в регуляции обмена веществ в организме. С протеолизом связаны такие фундаментальные процессы жизнедеятельности, как внутриклеточный распад белков и регуляция их кругооборота (см. Азотистый обмен), пищеварение, оплодотворение, морфогенез, защитные реакции (см. Иммунитет), адаптационные перестройки обмена. Нарушение П. и его регуляции лежит в основе развития многих патологических состояний.
ПРОТЕАЗЫ, ферменты, производящие гидролитическое расщепление белковых веществ, или протеолиз. Соответственно преобладающему в белках способу соединения аминокислот, действие П. заключается в присоединении воды по месту пептидной связи, с образованием свободных карбоксилов и аминогрупп: R— CO—NH—B,’+H20=B,—COOH+NH2—R’.
Слайд 41
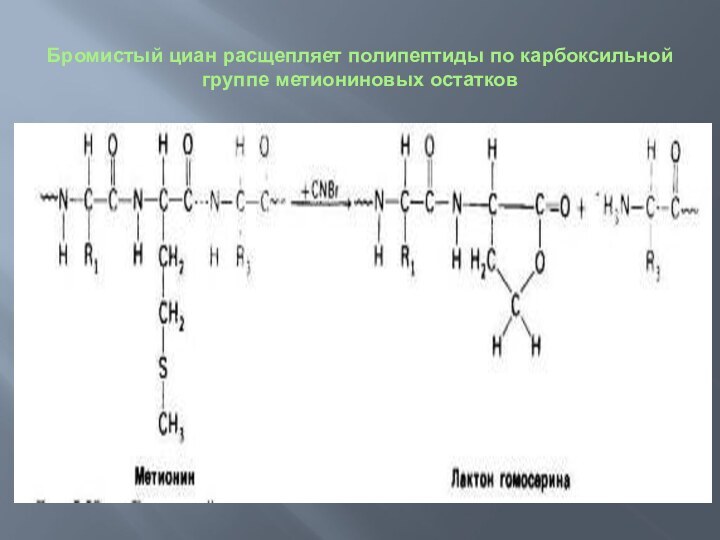
Расщипление белковой цепи по метиониновому остатку бромистым цианом.
Описанные

методы применимы к белкам, состоящим из одной полипептидной цепи,
не имеющей дисульфидных связей. В тех же случаях, когда в белке имеются дисульфидные связи или более одной полипептидной цепи, то необходимы дополнительные методические приемы, Например, если белок содержит две или более полипептидные цепи, соединенные нековалентными связями, то, воздействуя денатурирующими агентами, такими, как мочевина или гуанидингидрохлорид, вызывают диссоциацию цепей. Диссоциированные цепи разделяют и только после этого приступают к определению последовательности аминокислот в каждой из них. Если же полипептидные цепи соединены ковалентными дисульфидными связями, как это имеет место в инсулине, то их окисляют надмуравьиной кислотой; при этом дисульфидные связи разрываются и образуются остатки цистеиновой кислоты.
Анализ структуры белков удалось значительно ускорить путем создания секвенатора-специального прибора для автоматического определения последовательности аминокислот. При таком определении белок в виде тонкой пленки помещают во вращающийся цилиндрический сосуд, где он подвергается деградации по Эдману. Реактивы и растворители проходят над иммобилизованной белковой пленкой, а высвобождающиеся ФТГ-аминокислоты подвергаются жидкостной хроматографии при высоком давлении и таким образом идентифицируются. Один цикл деградации по Эдману занимает при этом менее двух часов. С помощью секвенатора можно определить аминокислотную последовательность полипептида или белка, содержащего до ста аминокислотных остатков.
Слайд 42
Бромистый циан расщепляет полипептиды по карбоксильной группе метиониновых
остатков
Слайд 43
Разделение и анализ пептидов.
Биологически активные пептиды Большую группу

таких пептидов составляют пептидные гормоны (в т.ч. нейропептиды)-адрепокортикотропин, вазопрессин,
гастрин, меланоцитстимулирующий гормон, окситоцин, опиоидные пептиды и др.
Некоторые пептиды - регуляторы иммунитета. К таким пептидам относят гормоны тимуса, тетрапептид тафтсин Thr—Lys—Pro—Arg (букв. обозначения см. в ст. Аминокислоты), являющийся фрагментом домена СН2 иммуноглобулина G, и пептидный антибиотик циклоспорин А, обладающий иммунодепрессивными свойствами. К пептидным антибиотикам относят также актиномицины и др. Важную роль в активном транспорте ионов через биол. мембраны играют ионофоры.
Среди пептидов известны вещества, обладающие высокой токсичностью,-токсины из яда пчел и ос, пептиды из бледной поганки (фаллоидин, аманитины и др.), нейротоксины из яда змей (см. Токсины). К биологически активным пептидам принадлежат анзерин, глутатион и карнозин, участвующие в биохим. реакциях в тканях животных, а также пептидные алкалоиды.
Некоторые пептиды обладают выраженными вкусовыми качествами, например аспартам слаще сахара в 200 раз.
Слайд 44
Идентификация N-и C- концевых остатков в белках и
пептидах.
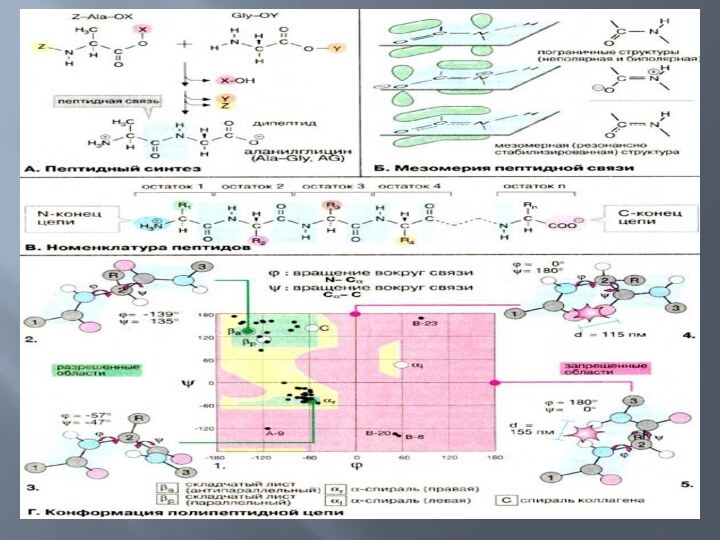
Хим. синтез пептидов заключается в создании пептидной связи между
группой COOH одной аминокислоты и NH2 др. аминокислоты или пептида. В соответствии с этим различают карбоксильную и аминную компоненты реакции пептидного синтеза. Для проведения целенаправленного контролируемого синтеза пептидов необходима предварит. временная защита всех (или некоторых) функц. групп, которые не участвуют в образовании пептидной связи, а также предварит. активация одной из компонент пептидного синтеза. После окончания синтеза защитные группы удаляют. При получении биологически активных пептидов необходимое условие - предотвращение рацемизации аминокислот на всех этапах пептидного синтеза.
Все защитные группы делят на N-защитные (для временной защиты группы NH2), С-защитные (для временной защиты карбоксильных групп COOH) и R-защитные (для временной защиты др. функц. групп в боковой цепи аминокислот H2NCHRCOOH).
Слайд 45
Идентификация N- и C- концевых остатков в белках

и пептидах.
Среди N-защитных групп наиб. важными являются ациль-ные защитные
группы [в т.ч. типа ROC(O)], а также алкильные и аралкильные защитные группы. Примеры N-защитных групп типа ROC(O)-бензилоксикарбонильная группа (карбобензоксигруппа) C6H5CH2OCO и трет-бутокси-карбонильная группа (СН3)3СОСО. К ацильным N-защитным группам относят: формильную HCO, трифторацетильную CF3CO и др. Представители N-защитных групп алкильной и аралкильной природы - триметилсилильная (CH3)3Si и трифенилметильная (тритильная) (C6H 5)3С.
Среди С-защитных групп важнейшими являются сложно-эфирные и замещенные гидразидные группы. К первым относят, например, метокси-, этокси- и трет-бутоксигруппы. С-защитные группы гидразидного типа - бензилоксикарбонил-, трет-бутилоксикарбонил-, тритил- и фенил-гидразиды.
В качестве R-защитных групп широко используют ацильные группы, в т. ч. типа ROC(O) (для защиты аминогрупп и гуанидиногрупп в боковых цепях лизина и аргинина соотв.), сложноэфирные группировки (для защиты карбоксилов в боковых цепях аспарагиновой и глутаминовой кислот), а также алкильные и аралкильные группы (для защиты групп ОН и SH в боковых цепях гидроксиаминокислот и цистеина соотв.).
Слайд 46
Метод Сегнера(Сенджер)
Метод Сэнджера используется с самого своего открытия
в 1977 году для определения последовательности оснований в ДНК.
Этот хитроумный метод определения расположения специфического основания во фрагменте ДНК также называется «методом обрыва цепи», потому что основан на остановке синтеза новой цепочки ДНК. Принцип данного метода зависит от двух фактов: (а) синтез фрагмента двуцепочечной ДНК из одноцепочечной цепочки ДНК инициируется в присутствии ДНК-полимеразы; (б) синтез ДНК останавливается, если включенное в цепочку основание находится в форме дидезоксинулеотида вместо дезоксинулеотида. В дидезокси-форме нуклеотида отсутствует гидроксильная группа в определяющей позиции (3′-позиция)
Слайд 47
Метод Сенджера
Поэтому, если вы снабдите синтезирующуюся молекулу ДНК,
к примеру, дидезоксиаденозином (ддАТФ) в смеси с дезоксиаденозином (дАТФ)
и другими тремя дезоксинуклеотидами, то синтез второй цепочки остановится там, где в цепочку встроится дидезоксиаденозин вместо дезоксиаденозина. По теории вероятности в части синтезируемых ДНК репликация прервется в каждой точке, где необходим аденозин.
Слайд 48
Метод Сенджера
Метод Сэнджера использует дидезоксинуклеотиды для всех четырех

нуклеотидов. Есть четыре набора реагентов, каждый из которых содержит
все четыре нуклеотида в нормальной дезокси-форме и один из нуклеотидов в дидезокси-форме. Копии одной и той же одноцепочечной ДНК инкубируют в каждом наборе. В каждом из четырех наборов синтез ДНК останавливается по всем соотвествующим сайтам фрагмента ДНК. Электрофорез проводится во всех четырех наборах раздельно. Поскольку длина пути передвижения в геле при электрофорезе зависит от размера молекулы, фрагменты ДНК будут распределяться линейно в соответствии со своим размером. Если взять, например, набор с ддАТФ, то мы увидим, что в образце будут присутствовать фрагменты ДНК, укороченные по каждой из позиций, где в синтезируемой цепи находился аденозин. Некоторые фрагменты, в цепи которых аденозин появляется рано, будут короткими. Другие (аденозин появляется позже в последовательности ДНК) — длиннее. Вы можете определить локализацию аденозина по длине этих фрагментов. Затем можно сравнить данные, полученные после электрофореза в каждом наборе. Так вы определите локализацию каждого нуклеотида в исследуемой последовательности ДНК
Слайд 49
Определение последовательности ДНК с использованием метода Сэнджера
Слайд 50
Метод Эдмана
один из ранних методов определения первичной последовательности
(секвенирования) пептидов. Разработан в 1950—1956 годах шведским биохимиком Пэром
Виктором Эдманом. Суть метода заключается в обработке исследуемого пептида определенным набором реагентов, что приводит к отщеплению одной аминокислоты с N-конца последовательности. Циклическое повторение реакции и анализ продуктов реакций дают информацию о последовательности аминокислот в пептиде. Метод Эдмана был широко распространен во второй половине ХХ века. В настоящее время практически не применяется из-за многих присущих ему недостатков (неколичественное протекание реакции, множественные побочные процессы).
Слайд 51
Метод Эдмана
ФИТЦ (фенилизотиоцианат)— реагент используемый для определения N-концевой
аминокислоты в пептиде. Он способен реагировать с альфа-аминокислотами и
альфа-карбоксильной группой свободных аминокислот. В результате взаимодействия с N-концевой аминокислотой полипептида образуется фенилтиогидантионовое производное, в котором дестабилизирована связь между альфа-карбоксильной группой N-концевой аминокислоты в пептиде. Эта связь избирательно гидролизуется без повреждения других пептидных связей. после реакции выделяют комплекс ФИТЦ с N-концевой аминокислотой, и идентифицируют его хроматографическим методом. Далее этот процесс повторяют с укороченным пептидом. Таким образом получают последовательность аминокислот в пептиде
Слайд 52
Автоматические секвенаторы
К концу 70-х годов перед исследователями, работавшими
в сфере молекулярной биологии, остро встала проблема установления последовательности
нуклеотидов в цепи ДНК («секвенирования ДНК»). Как подойти к решению этой проблемы? За 10 лет до того Эрдманом и Беггом была решена задача выяснения последовательности аминокислот в белках («секвенирования белков») в автоматическом режиме. Собственно говоря, новым в их методе был только способ автоматизации. Существо же этого метода было для химии тривиальным. Был найден способ последовательного отщепления по одной аминокислоте (хотя и в модифицированном виде) от конца изучаемой белковой цепи с последующей идентификацией каждого из полученных таким образом простых продуктов.
Отыскание аналогичного подхода для секвенирования ДНК не вдохновляло исследователей, поскольку для секвенирования хотя бы одного структурного гена предстояло определять последовательность в 1-3 тысячи нуклеотидов, не говоря уже о всем геноме, когда счет должен идти на миллионы, а у высших организмов на миллиарды нуклеотидов.
Слайд 53
Автоматические секвенаторы
расшифровка генома человека с его тремгя миллиардами

пар нуклеотидов. Там, разумеется, есть свои приемы. Но, тем
не менее, задача эта столь громоздка, что над ее разрешением координированно работают уже несколько лет многие лаборатории мира. (Общая программа «Геном человека».) О важности такой расшифровки для медицинских целей написано немало в общедоступной литературе. В первую очередь она ведется для тех участков генома, где расположены активные гены, в особенности гены, имеющие отношение к болезням человека. Эти гены во многих случаях могут быть найдены в геноме через синтез кДНК по иРНК, соответствующей белку — продукту деятельности интересующего гена, с дальнейшей гибридизацией с определенным куском генома. Для отыскания примерной локализации гена нет нужды получать соответствующие полноразмерные иРНК и кДНК. Достаточно знать последовательность в сотню нуклеотидов. Ее уникальность во всем геноме не вызывает сомнения — вероятность повтора составляет 1/4100.
Слайд 54
Автоматические секвенаторы
PS: К концу 1998 года были расшифрованы
последовательности 50—60 тысяч генов, что составляет более половины всего
предполагаемого числа генов человека. Это звучит оптимистически. Но стоит вспомнить, что все активные гены человека в совокупности составляют лишь около 3% его генома. Нужно ли расшифровывать остальные 97% ? Наверное нужно, хотя бы для того, чтобы подойти к пониманию роли этого огромного количества как будто «молчащей» наследственной информации. Неужели — это пустой балласт? Или эта «внегенная» информация играет какую- то роль в обеспечении жизнедеятельности человека во всех ее аспектах? На этом пути, быть может, ученых ждут еще великие открытия!
Слайд 57
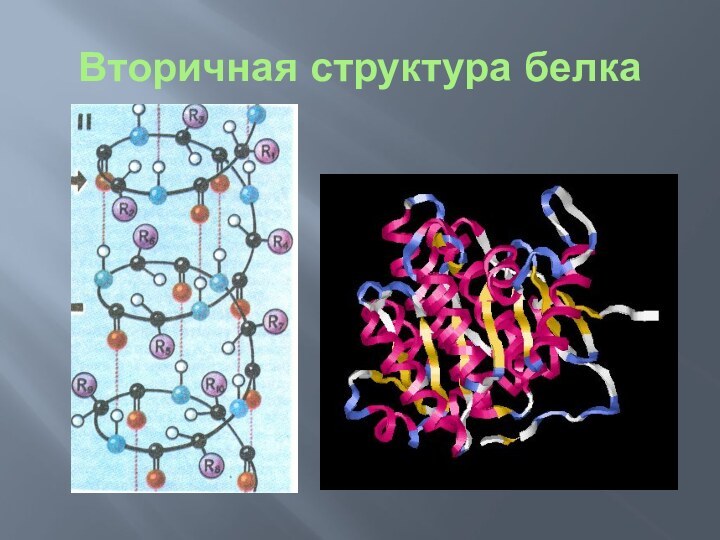
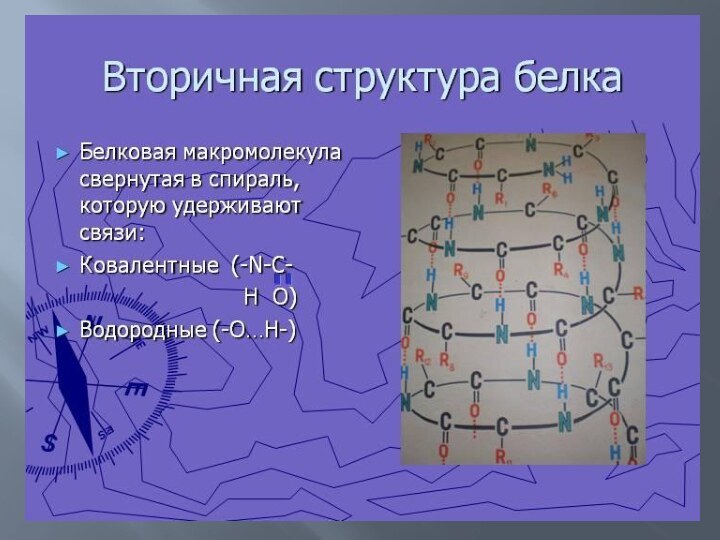
Вторичная структура белка
Вторичная структура белка — способ скручивания
полипептидной цепи в пространстве (за счет водородной связи между
водородом амидной группы —NH— и карбонильной группы — СО—, которые разделены четырьмя аминокислотными фрагментами). Наиболее распространённой формой вторичной структуры ДНК является двойная спираль. Эта структура образуется из двух взаимно комплементарных антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль. При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов — наружу. Впервые эту структуру описали Джеймс Уотсон и Френсис Крик в 1953 году
Слайд 58
Пептидные цепи
Пептидные цепи содержат десятки, сотни и тысячи
аминокислотных остатков, соединённых прочными пептидными связями. За счёт внутримолекулярных
взаимодействий белки образуют определённую гфостранственную структуру, называемую "конформация белков". Линейная последовательность аминокислот в белке содержит информацию о построении трёхмерной пространственной структуры. Различают 4 уровня структурной организации белков, называемых первичной, вторичной, третичной и четвертичной структурами (рис. 1-3). Существуют общие правила, по которым идёт формирование пространственных структур белков.
Слайд 59
Вторичная структура белков - пространственная структура, образующаяся в

результате взаимодействий между функциональными группами, входящими в состав пептидного
остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: ?-спираль
В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали (рис. 1-5). На один виток ?-спирали приходится 3,6 аминокислотных остатка.
В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате ?-спираль "стягивается" множеством водородных связей. Несмотря на то, что данные связи относят к разряду слабых, их количество обеспечивает максимально возможную стабильность ?-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой) ?-спиралей уменьшается, а их гидрофобность увеличивается. Спираль
-Спиральная структура - наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования ?-спиралей полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится. Радикалы аминокислот находятся на наружной стороне ?-спирали и направлены от пептидного остова в стороны. Они не участвуют в образовании водородных связей, характерных для вторичной структуры, но некоторые из них могут нарушать формирование ?-спирали. К ним относят:
пролин. Его атом азота входит в состав жёсткого кольца, что исключает возможность вращения вокруг -N-CH- связи. Кроме того, у атома азота пролита, образующего пептидную связь с другой аминокислотой, нет атома водорода. В результате пролин не способен образовать водородную связь в данном месте пептидного остова, и ?-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб;
участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми возникают электростатические силы отталкивания;
участки с близко расположенными объёмными радикалами, механически нарушающими формирование ?-спирали, например метионин, триптофа
Слайд 60
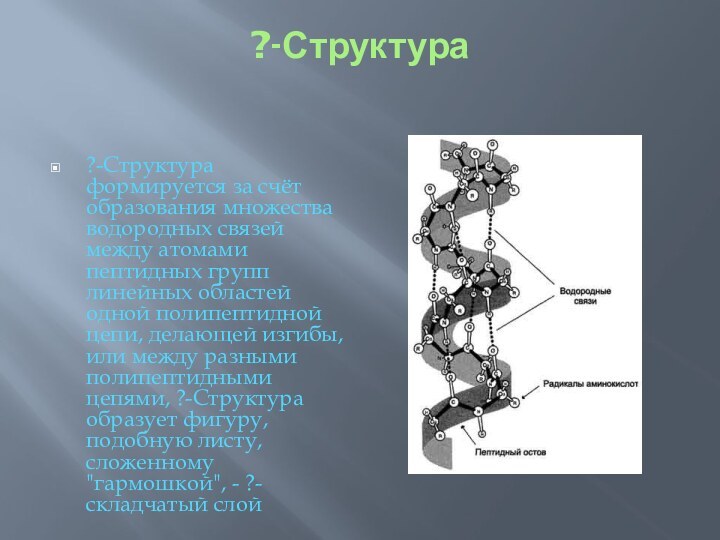
?-Структура
?-Структура формируется за счёт образования множества водородных
связей между атомами пептидных групп линейных областей одной полипептидной
цепи, делающей изгибы, или между разными полипептидными цепями, ?-Структура образует фигуру, подобную листу, сложенному "гармошкой", - ?-складчатый слой
Слайд 61
Регулярные вторичные структуры
Регулярными называются вторичные структуры, образованные аминокислотными
остатками с одинаковой конформацией главной цепи (углы φ и
ψ), при разнообразии конформаций боковых групп. К регулярным вторичным структурам относят:
Слайд 62
α-спираль
или спираль 413, — самая распространённая в белках

вторичная структура. Данная спираль характеризуется плотными витками вокруг длинной
оси молекулы, один виток составляет 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[3] (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали.
310-спираль — очень «тугая» спираль, в сечении имеет форму треугольника, в белках встречается в основном её правая форма, и то только в виде 1-2 витков[2].
π-спираль, или спираль 516, — спираль с широкими витками, в результате в центре спирали остаётся пустое пространство. В белках встречается редко, обычно не более одного витка.
Слайд 63
β-листы
(β-структура, складчатые слои) — несколько зигзагообразных полипептидных

цепей, в которых водородные связи образуются между относительно удалёнными
друг от друга (0,347 нм на аминокислотный остаток[3]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Полипептидные цепи в составе β-листов могут быть направлены N-концами в противоположные стороны (антипараллельная β-структура), в одну сторону (параллельная β-структура), также возможно существование смешанной β-структуры (состоит из параллельной и антипараллельной β-структуры)[2]. Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин. β-структура является второй по частоте встречаемости в белках после α-спирали.
полипролиновая спираль — плотная левая спираль, которая стабилизирована Ван-дер-Ваальсовыми взаимодействиями, а не системой водородных связей. Такая структура формируется в полипептидных цепях богатых пролином, где формирование насыщенной системы водородных связей по этой причине невозможно. Полипролиновая спираль типа poly(Pro)II реализуется в коллагене, при этом три левых полипролиновых спирали перевиваются в правую суперспираль, которая стабилизируется водородными связями между отдельными цепями
Слайд 64
Нерегулярные вторичные структуры
Нерегулярные вторичные структуры
Нерегулярными называют стандартные вторичные
структуры, аминокислотные остатки которых имеют разную конформацию главной цепи
(углы φ и ψ). К нерегулярным вторичным структурам относят:
повороты — нерегулярные участки полипептидной цепи, которые обеспечивают поворот её направления на 180°. Если участок, обеспечивающий поворот, достаточно длинный, используется термин петля. В 1968 году при описании поворотов из минимально возможного числа аминокислотных остатков (4) Венкатачалам ввёл для них термин β-изгиб[4]. Также существуют повороты из 4, 5 и 6 аминокислотных остатков.
полуповороты, или переходы, — нерегулярные участки полипептидной цепи, которые обеспечивают поворот её направления на 90°. Минимальный полуповорот состоит из 3 аминокислотных остатков.
Слайд 65
Возможность предсказания вторичной стуктуры
предсказание по аминокислотной последовательности
трёхмерной структуры белка (вторичной, третичной или четвертичной). Существенно отличается
от обратной проблемы дизайна белка (англ. protein design). Предсказание структуры белка — одна из самых важных целей биоинформатики и теоретической химии. Оно применяется в медицине (например, в фармацевтике) и биотехнологии (например, при создании новых ферментов). Каждые два года результативность существующих методов предсказания оценивается в эксперименте CASP (англ. Critical Assessment of Techniques for Protein Structure Prediction — критическая оценка технологий предсказания структуры белка).
Слайд 66
Фолдинг белка
В биохимии и молекулярной биологии фо́лдингом белка

(укладкой белка, от англ. folding) называют процесс спонтанного сворачивания
полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура).
Переход первичной структуры полипептида (слева) в третичную структуру (справа).
Каждая молекула белка начинает формироваться как полипептид, транслируемый из последовательности мРНК в виде линейной цепочки аминокислот. У полипептида нет устойчивой трёхмерной структуры (пример в левой части изображения). Однако все аминокислоты в цепочке имеют определённые химические свойства: гидрофобность, гидрофильность, электрический заряд. При взаимодействии аминокислот друг с другом и клеточным окружением получается хорошо определённая трёхмерная структура — конформация. В результате на внешней поверхности белковой глобулы формируются полости активных центров, а также места контактов субъединиц мультимерных белков друг с другом и с биологическими мембранами.
Слайд 67
Фолдинг белка
В редких случаях нативными могут быть сразу

две конформации белка (т. н. конформеры). Они могут сильно
различаться, и даже выполнять различные функции. Для этого необходимо, чтобы в разных областях фазового пространства белковой молекулы существовали два примерно равных по энергии состояния, каждое из которых будет встречаться в нативной форме с соответствующей вероятностью.
Для стабилизации третичной структуры многие белки в клетке подвергаются посттрансляционной модификации. Весьма часто встречаются дисульфидные мостики между пространственно близкими участками полипептидной цепи.
Для корректной работы белков весьма важна правильная трёхмерная структура. Ошибки сворачивания обычно приводят к образованию неактивного белка с отличающимися свойствами (более подробно это описано в статье Прионы). Считается, что некоторые болезни происходят от накопления в клетках неправильно свёрнутых белков.
В фолдинге участвуют белки-шапероны. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Механизм сворачивания белков до конца не изучен. Экспериментальное определение трёхмерной структуры белка часто очень сложно и дорого. Однако аминокислотная последовательность белка обычно известна. Поэтому учёные пытаются использовать различные биофизические методы, чтобы предсказать пространственную структуру белка из его первичной аминокислотной последовательности.
Слайд 68
Стабильность вторичной структуры
Таким образом, стабильность вторичной структуры обеспечивается

в основном водородными связями (определенный вклад вносят и главновалентные
связи – пептидные и дисульфидные).
Водородная связь представляет собой слабое электростатическое притяжение (взаимодействие, связь) между одним электроотрицательным атомом (например, кислородом или азотом) и водородным атомом, ковалентно связанным со вторым электроотрицательным атомом. Типы водородных связей представлены далее.
По современным представлениям, водородная связь включает не только электростатические силы притяжения между полярными группами (взаимодействие атомов водорода с электроотрицательными элементами: кислородом, азотом, хлором), но и электронные связи такого же типа, как в ряде комплексных соединений. Водородные связи, являясь нековалентными, отличаются малой прочностью. Так, если для разрыва химических межатомных связей необходимо затратить от 84 до 8400 кДж, то для разрыва одной водородной связи требуется затратить всего лишь 6,3 кДж на 1 моль. Поскольку в белковой молекуле число водородных связей очень велико (в образование водородных связей вовлечены все пептидные группы), они в сумме обеспечивают скручивание полипептидной цепи в спиральную структуру, сообщая ей компактность и стабильность.
Механизм возникновения водородных связей в элементарной форме может быть представлен на примере взаимодействия двух молекул воды (диполи). В диполе воды, как известно, избыток положительных зарядов приходится на атомы водорода, а избыток отрицательных – на атомы кислорода
Слайд 69
Водородная связь вторичной структуры
Благодаря особенностям строения атома водорода
при достаточном сближении двух молекул воды возникает электростатическое взаимодействие
между атомом кислорода одной молекулы и атомом водорода второй молекулы воды. Следствием этого является ослабление связи между атомами водорода и кислорода в каждой молекуле воды и соответственно возникновение новой, непрочной связи (отмечена пунктиром) между атомом водорода первой молекулы и атомом кислорода второй молекулы воды. Эту непрочную связь принято обозначать водородной связью.

































![Формирование и свойства белка Протеазы, протеолизПротеолиз (проте [ины] + lysis разложение, распад) — ферментативный гидролиз белков](/img/tmb/13/1261973/a254b3126600560629dd3691c0bc340c-720x.jpg)