План
Особенности
функционирования олигомерных белков на примере гемоглобина и миоглобина
Структура и функции миоглобина
Структура и функции гемоглобина
Кооперативные изменения конформации протомеров
2,3-Бифосфоглицерат - аллостертеский регулятор сродства гемоглобина к О2
Слайд 3
Олигомерные белки проявляют свойства, отсутствующие у мономерных белков.
Влияние четвертичной структуры на функциональные свойства белка можно рассмотреть,
сравнивая строение и функции двух родственных гемсодержащих белков: миоглобина и гемоглобина. Оба белка имеют общее эволюционное происхождение, сходную конформацию отдельных полипептидных цепей и сходную функцию (участвуют в транспорте кислорода), но миоглобин - мономерный белок, а гемоглобин - тетрамер. Наличие четвертичной структуры у гемоглобина придаёт этому белку свойства, отсутствующие у миоглобина.
Слайд 4
Структура и функции миоглобина
Миоглобин относят к классу гемсодержащих
белков, т.е. он содержит простетическую группу - гем, довольно
прочно связанную с белковой частью. Миоглобин относят к глобулярным белкам; он имеет только одну полипептидную цепь.
Клеточная локализация и функция
Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в ткани падает, О2освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения необходимой для работы мышц энергии.
Слайд 5
Строение миоглобина
Миоглобин содержит небелковую часть (гем) и белковую

часть (апомиоглобин).
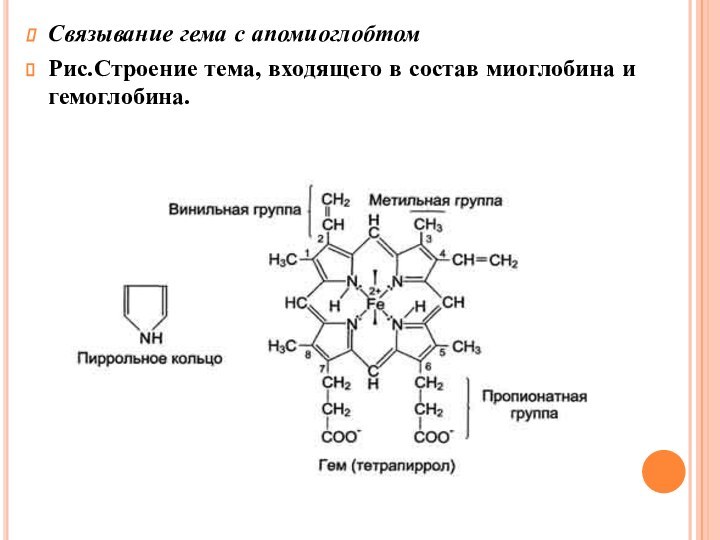
Гем - молекула, имеющая структуру циклического тетрапиррола, где 4
пиррольных кольца соединены метиленовыми мостиками и содержат 4 метильные, 2 винильные и 2 пропионатные боковые цепи. Эта органическая часть тема называется протопорфирином. Возможны 15 вариантов расположения боковых цепей, но в составе гемопротеинов присутствует только один изомер, называемый протопорфирин IX. Атом азота пиррольных колец протопорфирина IX связаны четырьмя координационными связями с Fe2+, находящимся в центре молекулы .
Апомиоглобин - белковая часть миоглобина; первичная структура представлена последовательностью из 153 аминокислот, которые во вторичной структуре уложены в 8 -спиралей. Спирали обозначают латинскими буквами от А до Н, начиная с N-конца полипептидной цепи, и содержат от 7 до 23 аминокислот. Для обозначения индивидуальных аминокислот в первичной структуре апомиоглобина используют либо написание их порядкового номера от N-конца (например, Гис64, Фен138), либо букву -спирали и порядковый номер данной аминокислоты в этой спирали, начиная с N-конца (например, Гис F8).
Третичная структура имеет вид компактной глобулы (внутри практически нет свободного места), образованной за счёт петель и поворотов в области неспирализованных участков белка. Внутренняя часть молекулы почти целиком состоит из гидрофобных радикалов, за исключением двух остатков Гис, располагающихся в активном центре.
Слайд 6
Связывание гема с апомиоглобтом
Рис.Строение тема, входящего в состав
миоглобина и гемоглобина.
Слайд 7
Гем - специфический лиганд апомиоглобина,
присоединяющийся к белковой

части в углублении между двумя-спиралями F и Е. Центр
связывания с гемом образован преимущественно гидрофобными остатками аминокислот, окружающими гидрофобные пиррольные кольца тема. Две боковые группы пропионовых кислот, ионизированные при физиологических значениях рН, выступают на поверхности молекулы.
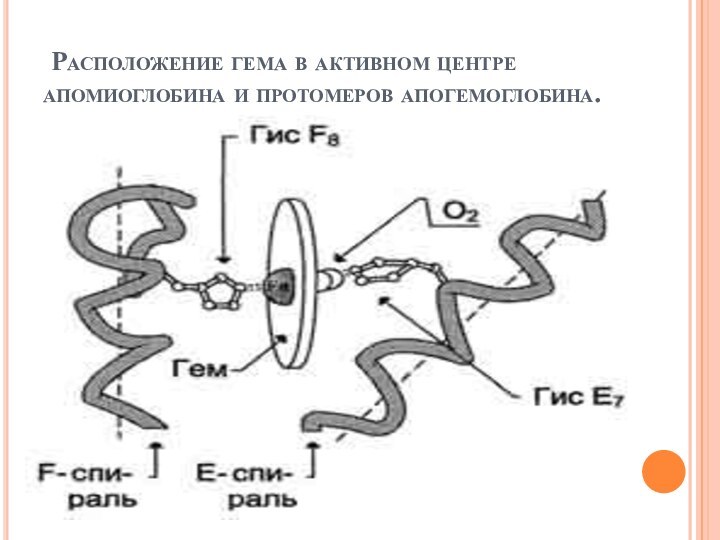
В активный центр апомиоглобина кроме гидрофобных аминокислот входят также 2 остатка Гис (Гис64 и Гис93 или Гис Е7 и Гис F8), играющие важную роль в функционировании белка. Они расположены по разные стороны от плоскости тема и входят в состав спиралей F и Е, между которыми располагается гем. Атом железа в теме может образовывать 6 координационных связей, 4 из которых удерживают Fe2+ в центре протопорфирина IX (соединяя его с атомами азота пиррольных колец), а 5-я связь возникает между Fe2+ и атомом азота имидазольного кольца Гис F8
Гис Е7 хотя и не связан с гемом, но необходим для правильной ориентации и присоединения другого лиганда - О2 к миоглобину.
Аминокислотное окружение тема создаёт условия для довольно прочного, но обратимого связывания О2 с Fe2+ миоглобина. Гидрофобные остатки аминокислот, окружающие гем, препятствуют проникновению в центр связывания миоглобина воды и окислению Fe2+ в Fe3+. Трёхвалентное железо в составе тема не способно присоединять О2.
Слайд 8
Структура и функции гемоглобина
Гемоглобины - родственные белки, находящиеся

в
эритроцитах человека и позвоночных животных. Эти белки выполняют 2
важные функции:
перенос О2 из лёгких к периферическим тканям;
участие в переносе СО2 и протонов из периферических тканей в лёгкие для последующего выведения из организма.
Кровь ежедневно должна переносить из лёгких в ткани около 600 л ,О2. Так как О2 плохо растворим в воде, то практически весь кислород в крови связан с гемоглобином эритроцитов.
От способности гемоглобина насыщаться О2 в лёгких и относительно легко отдавать его в капиллярах тканей зависят количество получаемого тканями О2 и интенсивность метаболизма. С другой стороны, О2 - сильный окислитель, избыток поступления О2 в ткани может привести к повреждению молекул и нарушению структуры и функций клеток. Поэтому важнейшая характеристика гемоглобина - его способность регулировать сродство к О2 в зависимости от тканевых условий.
Гемоглобины, так же как миоглобин, относят к гемопротеинам, но они имеют четвертичную структуру (состоят из 4 полипептидных цепей), благодаря которой возникает возможность регуляции их функций.
Слайд 9
Расположение гема в активном центре апомиоглобина и протомеров
апогемоглобина.
Слайд 10
Гемоглобины человека
Гемоглобины взрослого человека
В эритроцитах

взрослого человека гемоглобин составляет 90% от всех белков данной
клетки.
Гемоглобин А - основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер.Гемоглобин A2 находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина.
Гемоглобин А1с - гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (так называемый гликозилированный гемоглобин).
Гемоглобины, синтезирующиеся в период внутриутробного развития плода:
Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер .Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
Гемоглобин F - фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру. После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
Слайд 11
Роль гистидина E7 в функционировании миоглобина и гемоглобина
Гем имеет
высокое сродство к оксиду углерода (СО). В водной среде
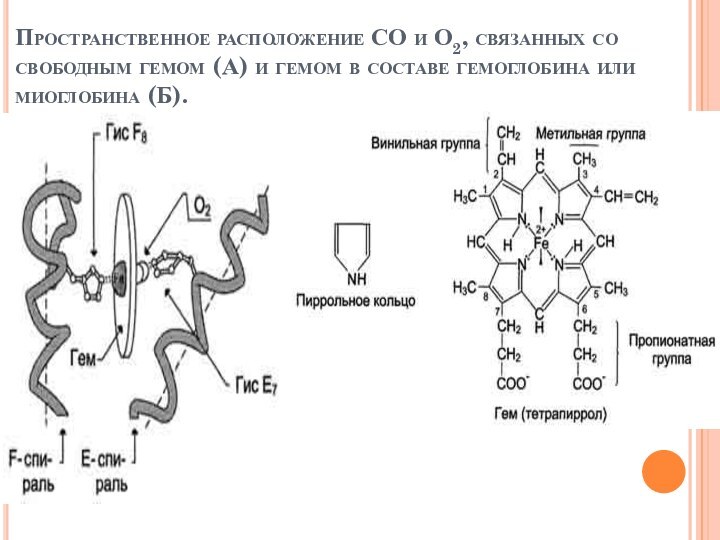
свободный от белковой части гем связывается с СО в 25 000 раз сильнее, чем О2. Высокая степень сродства гема к СО по сравнению с О2 объясняется разным пространственным расположением комплексов Fe2+ гема с СО и О2 (рис. 1-31, А).
В комплексе Fe2+ гема с СО атомы Fe2+, углерода и кислорода расположены на одной прямой, а в комплексе Fe2+ гема с О2 атомы железа и кислорода расположены под углом, что отражает их оптимальное пространственное расположение.
В миоглобине и гемоглобине над Fe2+ в области присоединения О2 расположен Гис Е7, нарушающий оптимальное расположение СО в центре связывания белков и ослабляющий его взаимодействие с гемом. Напротив, тот же Гис Е7 создаёт оптимальные условия для связывания О2 (рис. 1-31, Б). В результате сродство гема к СО в белках всего в 200 раз превышает его сродство к О2
Слайд 12
Пространственное расположение СО и О2, связанных со свободным
гемом (А) и гемом в составе гемоглобина или миоглобина
(Б).
Слайд 13
Четвертичная структура- это и количество, и способ укладки
полипептидных цепей (протомеров) в пространстве. Если белки состоят из
двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой. Такие агрегаты стабилизируются водородными связями, ионными связями и электростатическими взаимодействиями между остатками аминокислот, находящимися на поверхности глобулы. Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т.д.
Слайд 14
Четвертичная структура гемоглобина
Четыре полипептидные цепи, соединённые вместе, образуют
почти правильную форму шара, где каждая -цепь контактирует с
двумя -цепями
Так как в области контакта между α1-и–α2, а также между β1- иβ2-цепями находится много гидрофобных радикалов, то между этими полипептидными цепями формируется сильное соединение за счёт возникновения в первую очередь гидрофобных, а также ионных и водородных связей. В результате образуются димеры .Между этими димерами в тетрамерной молекуле гемоглобина возникают в основном полярные (ионные и водородные) связи, поэтому при изменении рН среды в кислую или щелочную сторону в первую очередь разрушаются связи между димерами. Кроме того, димеры способны легко перемещаться относительно друг друга.
Так как поверхность протомеров неровная, полипептидные цепи в центральной области не могут плотно прилегать друг к другу, в результате в центре формируется "центральная полость", проходящая сквозь всю молекулу гемоглобина.
Слайд 15
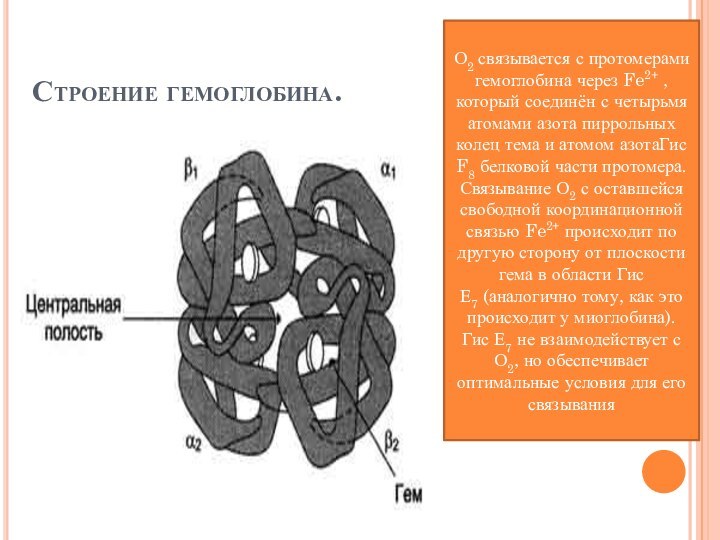
Строение гемоглобина.
О2 связывается с протомерами гемоглобина через Fe2+ , который
соединён с четырьмя атомами азота пиррольных колец тема и
атомом азотаГис F8 белковой части протомера. Связывание О2 с оставшейся свободной координационной связью Fe2+ происходит по другую сторону от плоскости гема в области Гис Е7 (аналогично тому, как это происходит у миоглобина). Гис Е7 не взаимодействует с О2, но обеспечивает оптимальные условия для его связывания
Слайд 16
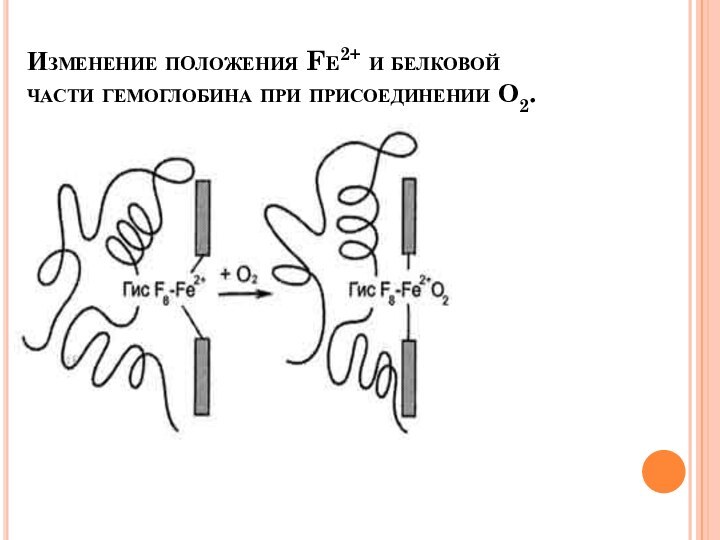
Изменение пoложения Fe2+ и белковой части гемоглобина при присоединении
О2.
Слайд 17
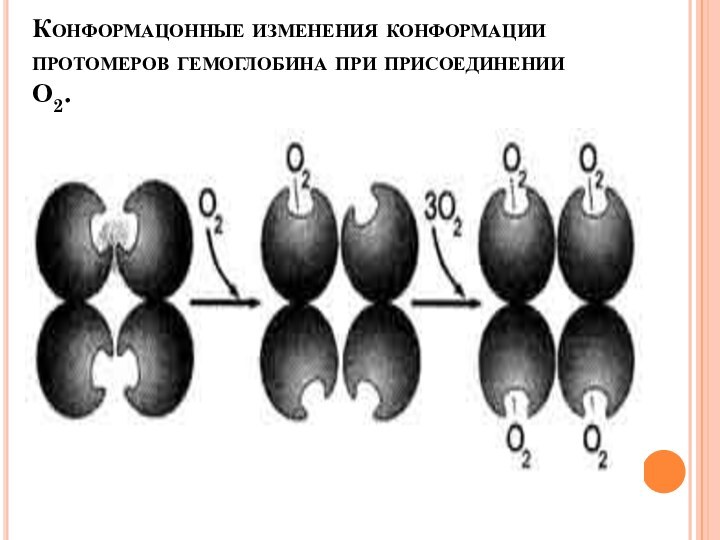
Конформацонные изменения конформации протомеров гемоглобина при присоединении О2.
Слайд 18
Конформационная лабильность белков
Гидрофобные взаимодействия, а также ионные и

водородные связи относят к числу слабых, так как их
энергия лишь ненамного превышает энергию теплового движения атомов при комнатной температуре (т.е. уже при данной температуре возможен разрыв таких связей). Поддержание характерной для белка конформации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи. Однако белки состоят из огромного числа атомов, находящихся в постоянном (броуновском) движении, что приводит к небольшим перемещениям отдельных участков полипептидной цепи, которые обычно не нарушают общую структуру белка и его функции. Следовательно, белки обладают конформационной лабильностью - склонностью к небольшим изменениям конформации за счёт разрыва одних и образования других слабых связей. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом. Конформационные изменения играют огромную роль в функционировании белков в живой клетке. Разрыв большого количества слабых связей в молекуле белка приводит к разрушению её нативной конформации. Так как разрыв связей под действием различных факторов носит случайный характер, то молекулы одного индивидуального белка приобретают в растворе форму случайно сформировавшихся беспорядочных клубков, отличающихся друг от друга трёхмерной структурой. Потеря нативной конформации сопровождается утратой специфической функции белков. Этот процесс носит название денатурации белков. При денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается. В денатурированном белке гидрофобные радикалы, которые в нативной структуре молекулы спрятаны внутри гидрофобного ядра, оказываются на поверхности. При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда молекулы могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит образование осадка. Компактная, плотная пространственная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами
Слайд 19
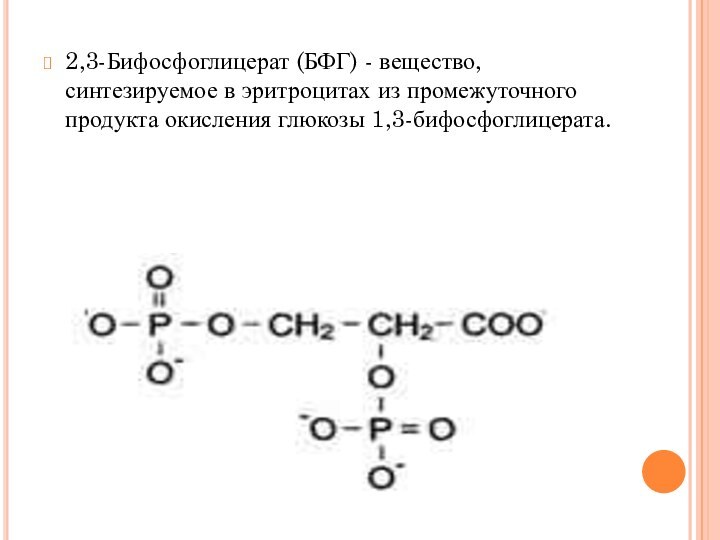
2,3-Бифосфоглицерат (БФГ) - вещество, синтезируемое в эритроцитах из
промежуточного продукта окисления глюкозы 1,3-бифосфоглицерата.
Слайд 20
Регуляция с помощью 2,3 бифосфоглицерата сродства гемоглобина

к О2
В нормальньж условиях 2,3-бифосфоглицерат присутствует в эритроцитах примерно
в той же концентрации, что и гемоглобин. БФГ, присоединяясь к гемоглобину, также может менять его сродство к О2.
В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров.
Центральная полость - место присоединения БФГ.
Размеры центральной полости могут меняться: отщепление О2 от оксигемоглобина вызывает его конформационные изменения, которые способствуют образованию дополнительных ионных связей между димерами α 1-и–α2, а также между β1- иβ2. В результате пространственная структура дезоксигемоглобина становится более жёсткой, напряжённой, а центральная полость расширяется.
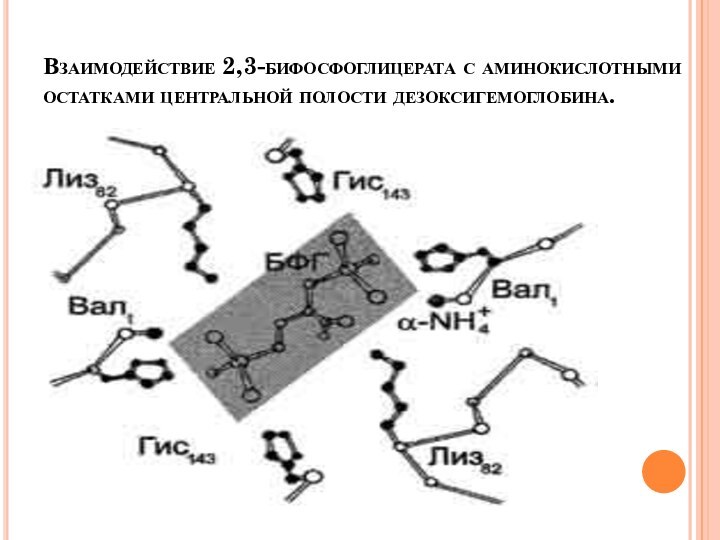
Поверхность полости ограничена остатками аминокислот, в числе которых имеются положительно заряженные радикалы Лиз82, Гис143 β1- иβ2 и положительно заряженные аминогруппы N-концевого валина - α 1-и–α2, цепей. В расширенную полость дезоксигемоглобина БФГ, имеющий сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дезоксигемоглобина и снижает сродство белка к О2
Присоединение БФГ к дезоксигемоглобину происходит в участке, ином по сравнению с гемом, где происходит связывание О2. Такой лиганд называется "аллостерический", а центр, где связывается аллостерический лиганд, - "аллостерический центр" (от греч. "аллос" - другой, иной, "стерос" - пространственный).
Слайд 21
Взаимодействие 2,3-бифосфоглицерата с аминокислотными остатками центральной полости дезоксигемоглобина.
Слайд 23
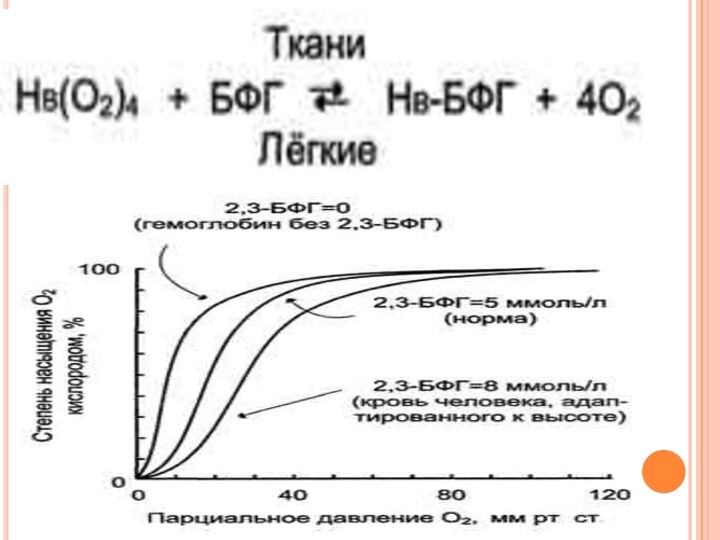
Изменение концентрации БФГ как механизм адаптации организма к
гипоксии. Концентрация БФГ в эритроцитах людей, живущих в определённых климатических
условиях, - величина постоянная. Однако в период адаптации к высокогорью, когда человек поднимается на высоту более 4000 м над уровнем моря, концентрация БФГ уже через 2 дня возрастает почти в 2 раза (от 4,5 до 7,0 мМ). Это снижает сродство гемоглобина к О2 и увеличивает количестве О2, транспортируемого в ткани.
Такую же адаптацию наблюдают у больных с заболеваниями лёгких, при которых развивается общая гипоксия тканей. Так, у больных с тяжёлой обструктивной эмфиземой лёгких парциальное давление в них снижается от 100 до 50 мм рт. ст. Но при этом в эритроцитах усиливается выработка БФГ, и его концентрация повышается с 4,5 до 7,0 мМ, что существенно увеличивает доставку О2 в ткани.
Слайд 24
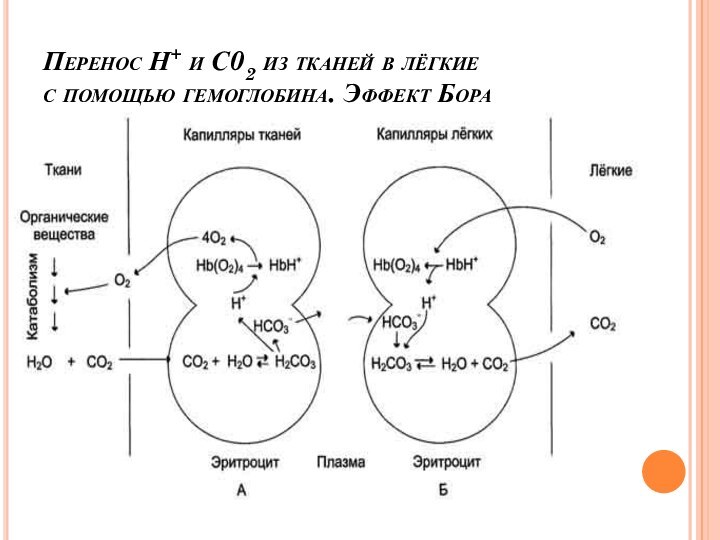
Перенос Н+ и С02 из тканей в лёгкие
с помощью гемоглобина.
Эффект Бора
Слайд 25
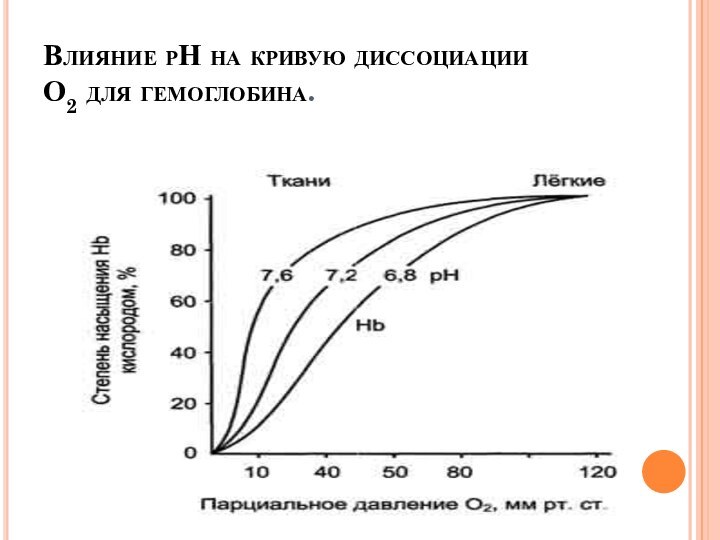
Влияние рН на кривую диссоциации О2 для гемоглобина.