Слайд 2
История открытия
В 20-е годы XX века американские ученые
Литтл (G.D. Little) и Снелл (G. Snell) c соавторами
установили существование более 30 генетических локусов, различие в которых приводит к отторжению трансплантатов
Они обозначили их как локусы гистосовместимости (H-локусы)
Одновременно с Литтлом и Снеллом английский иммунолог Горер (P. Gorer) решил аналогичную проблему при изучении групп крови у мышей
В 1948 году в совместной работе Снелла и Горера описан локус гистосовместимости, связанный с наиболее сильным отторжением. Он был назван H-2
Слайд 3
…
В 60-е годы французский иммуногематолог Доссе (J. Dausset)
описал несколько лейкоцитарных антигенов у человека, сходных с продуктами
локусов H-2. Открытый генетический комплекс получил название HLA
Позднее аналогичные комплексы были обнаружены у всех исследуемых млекопитающих и птиц и были названы MHC
Слайд 4
Определение
Главный комплекс гистосовместимости - комплекс тесно сцепленных генетических
локусов (и их белковых продуктов), ответственных за развитие иммунного
ответа и синтез трансплантационных антигенов
Слайд 5
Основные физиологические функции ГКГС
Обеспечение взаимодействия клеток организма
Обеспечение процессинга
(переработки) и презентации пептидов – индукторов и мишеней иммунного
ответа
Распознавание собственных, измененных собственных и чужеродных клеток => запуск и реализация иммунного ответа против носителей генетической чужеродности
Поддержание иммунологической толерантности (в том числе во время беременности)
Участие в позитивной и негативной селекции T-лимфоцитов
Создание генетического разнообразия и обеспечение выживаемости вида
Слайд 6
Основные свойства ГКГС
Полигенность (открыто более 200 генов, входящих
в состав главного комплекса гистосовместимости)
Полиморфность (для значительной части генов
системы гистосовместимости существуют множественные аллельные варианты)
Кодоминантность (в гетерозиготном состоянии проявляются оба аллельных варианта)
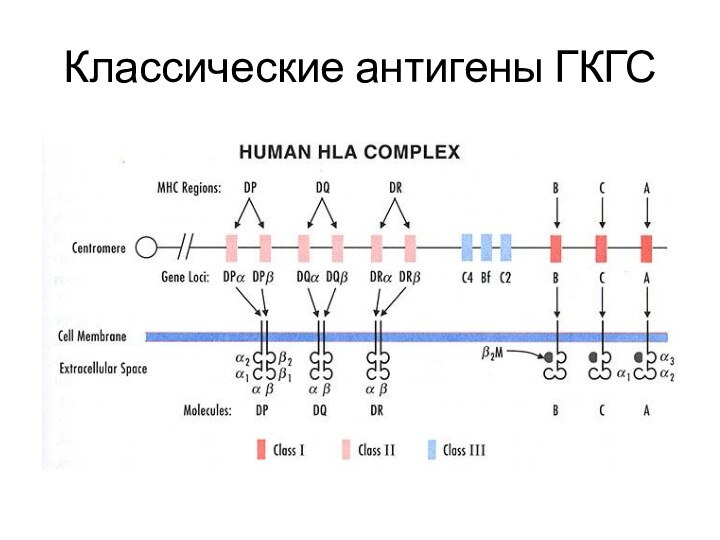
Слайд 8
Антигены I класса
Классические антигены ГКГС представляют собой эпитопы
к Т-клеточному рецептору CD8+ Т-лимфоцитов
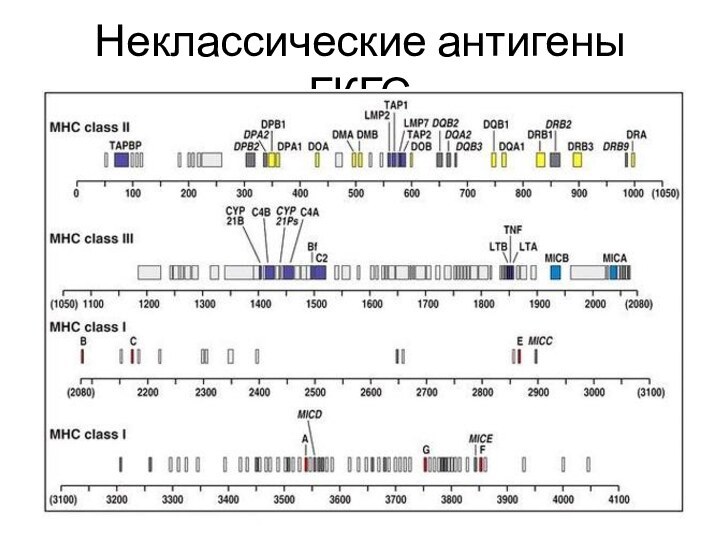
Неклассические антигены ГКГС проявляют ограниченный
полиморфизм, паттерны экспрессии и презентируемые антигены. Эту группу можно разделить на гены, закодированные в локусе 1 класса ГКГС (такие как HLA-E, -F, -G), и остальные (например, стресс-индуцированные лиганды)
Слайд 9
Антигены II класса
Классические антигены ГКГС презентируют антигены CD4+
лимфоцитам
Неклассические антигены ГКГС локализованы не на поверхности мембраны, а
в лизосомах, способствуя загрузке антигенных пептидов в пептид-связывающие белки второго класса
Слайд 12
Наследование антигенов ГКГС
Аллельные формы генов ГКГС наследуются кодоминантно,
как сцепленные группы, называемые гаплотипами
Слайд 13
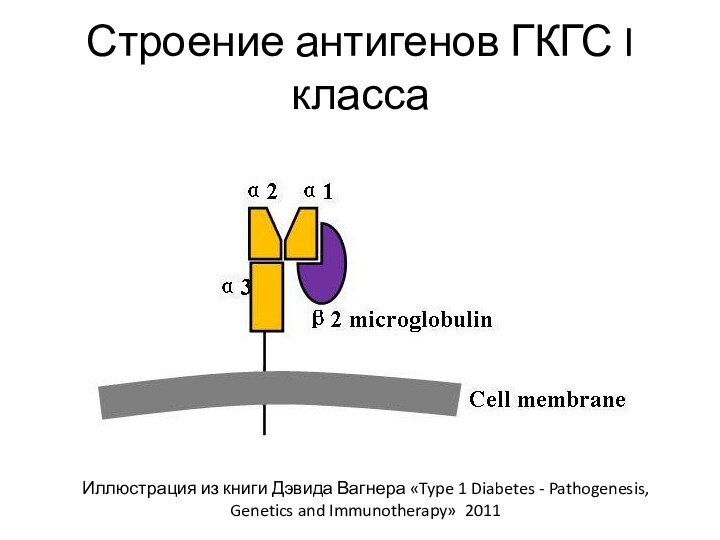
Антигены ГКГС I класса
Располагаются на клеточной мембране (трансмембранный
гликопротеин)
Представляют из себя гетеродимер (белок состоит из 2 разных
субъединиц)
α-цепь заякорена в мембране и включает в себя 3 домена (α1, α2, α3)
β-цепь (β2-микроглобулин) с мембраной не связана, прикреплена к α-цепи нековалентно
β2-микроглобулин не полиморфен и кодируется генами, расположенными в 15 хромосоме
Домен α3 и β-цепь по структуре относятся к суперсемейству иммуноглобулинов
Домен α3 способен связываться с молекулой CD8
Домены α1 и α2 образуют особую структуру – щель/бороздку Бьоркмана, в которую встраивается антигенный пептид длиной 9-13 аминокислот, заякоренный в двух местах
Слайд 14
Строение антигенов ГКГС I класса
Иллюстрация из книги Дэвида
Вагнера «Type 1 Diabetes - Pathogenesis, Genetics and Immunotherapy»
2011
Слайд 15
Какие клетки экспрессируют гены ГКГС I класса?
Продукты генов
MHC I класса экспрессируются (располагаются) на мембранах ВСЕХ соматических
клеток
Исключение составляют эритроциты (лишены ядра) и клетки ворсинчатого трофобласта (обеспечение толерантности к плоду; на трофобласте экспрессированы неклассические молекулы MHC I)
Слайд 16
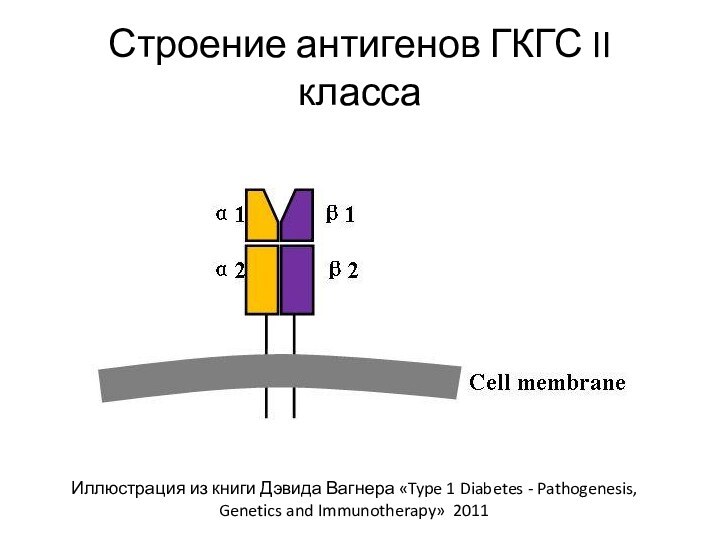
Антигены ГКГС II класса
Располагаются на клеточной мембране (трансмембранный
гликопротеин)
Представляют из себя гетеродимер (белок состоит из 2 разных
субъединиц)
α-цепь и β-цепь заякорены в мембране и включает в себя по 2 домена (α1, α2 и β1, β2, соответственно)
Домен α2 и β2 по структуре относятся к суперсемейству иммуноглобулинов
Домены α1 и β1 образуют особую структуру – щель/бороздку Бьоркмана, в которую встраивается антигенный пептид длиной 12-25 аминокислот. Он заякорен в 5 местах и плотно прилегает к ГКГС II класса
Слайд 17
Строение антигенов ГКГС II класса
Иллюстрация из книги Дэвида
Вагнера «Type 1 Diabetes - Pathogenesis, Genetics and Immunotherapy»
2011
Слайд 18
Какие клетки экспрессируют ГКГС II класса?
Продукты генов MHC
II класса постоянно экспрессируются на мембранах антигенпредставляющих клеток (дендритные
клетки, макрофаги, B-лимфоциты)
Молекулы MHC II могут присутствовать на мембранах нейтрофилов, тучных клеток, базофилов, эозинофилов, при стимуляции появляются на эпителии и эндотелии
Слайд 19
Щель Бьоркмана
предназначена для встраивания в нее антигенного пептида
У
MHC I класса
Образована доменами α1 и α2
Вмещает пептид
размером 9-13 а/к
Встраиваемый пептид имеет эндогенное происхождение
У MHC II класса
Образована доменами α1 и β1
Вмещает пептид размером 12-25 а/к
Встраиваемый пептид имеет экзогенное происхождение
Слайд 20
Роль ГКГС в иммунных процессах
Взаимодействуя с CD4 рецепторами
на поверхности Т-хелперов, антигены II класса ГКГС модулируют приобретенный
иммунитет
Взаимодействуя с CD8 рецепторами на поверхности цитотоксических Т-лимфоцитов, антигены I класса ГКГС вызывают элиминацию инфицированных и злокачественных клеток. Таким образом антигены I класса ГКГС способствуют работе клеточного иммунитета
Опосредованно антигены III класса ГКГС участвуют в работе гуморального иммунитета
Слайд 22
При типировании определяют:
Гаплотип (набор генов HLA на одной
из гомологичных хромосом) – определяют с помощью типирования родителей
Генотип
(набор генов на двух хромомсомах)
Фенотип (антигенное представительство молекул HLA на поверхности клеток)
Слайд 23
Это метод определения тканевой совместимости донора и реципиента,
основанный на феномене агглютинации лейкоцитов донора под действием антилейкоцитарных
антител (т.е. метод направлен на определение в сыворотке реципиента АТ против HLA-молекул донора)
Постановка:
Ряд разведений исследуемой сыворотки реципиента
Добавление взвеси лейкоцитов донора
Встряхивание и инкубация
Центрифугирование
Удаление супернатанта и лизис э/ц уксусной кислотой
Мазок для микроскопирования
Реакция лейкоагглютинации
Слайд 24
Выраженность агглютинации:
интенсивная, т.е. крупные агломераты, значительная площадь свободной
жидкости ++++
выраженная - наряду с агломератами лейкоцитов в жидкости
можно видеть небольшое количество свободных меток +++
средняя - среди взвешенных клеток выявляются островки агглютинатов ++
слабая мелкоглыбчатая - преобладают свободные клетки, но встречаются небольшие комочки склеившихся клеток +
Разведение сыворотки, в которой еще отмечается агглютинация
Минусы:
Низкая воспроизводимость рез-ов
Неспецифическая агглютинация
Спонтанная агглютинация при высокой концентрации нежизнеспособных Лц
Учет реакции лейкоагглютинации
Слайд 25
Метод заключается в следующем:
К сывороткам против разных антигенов
HLA добавляют по 2000 исследуемых лимфоцитов.
После инкубации добавляют комплемент
Лимфоциты, несущие антиген, против которого направлена сыворотка, под действием комплемента разрушаются.
Затем к лимфоцитам добавляют краситель, который окрашивает только живые клетки (также можно исп-ть 51Cr)
Результат оценивают по относительному числу погибших лимфоцитов
Резко положительный результат свидетельствует о том, что лимфоциты несут исследуемый антиген.
Лимфоцитотоксический тест
Слайд 26
Применяют в основном для определения HLA II класса
В
качестве «-» контроля используются культуры, состоящие только из отвечающих
клеток
В качестве «+» контроля - культура отвечающих клеток, стимулированных смесью лимфоцитов от разных доноров
Если радиоак-ть в СКЛ > радиоак-ти в «-» контроле не более чем на 20% или составляет не более 20% от радиоак-ти в «+» контроле, считают, что донор и реципиент совместимы по антигенам HLA
СКЛ
Слайд 27
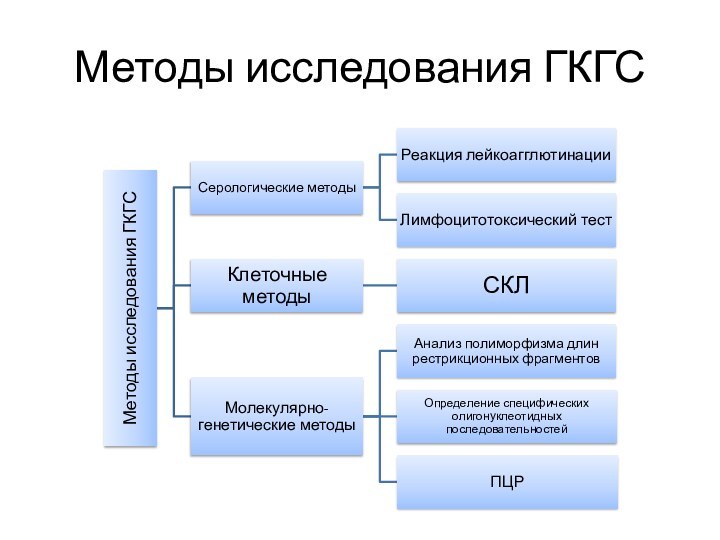
В настоящее время молекулярно- генетические методы используются только
для типирования генов HLA класса II.
Анализ полиморфизма длин рестрикционных
фрагментов
Определение специфических олигонуклеотидных последовательностей
ПЦР
Молекулярно-генетические методы
Слайд 28
Метод основан на способности бактериальных эндонуклеаз расщеплять ДНК
в сайтах рестрикции (участки, в которых сосредоточены специфические для
определенной эндонуклеазы последовательности нуклеотидов)
Длину рестрикционных фрагментов оценивают методом гибридизации ДНК на твердой подложке
I. Анализ полиморфизма длин рестрикционных фрагментов
Слайд 29
Постановка:
Фрагменты ДНК, полученные после ее обработки эндонуклеазами, разделяют
с помощью электрофореза в геле
Перенос на нитроцеллюлозную мембрану и
инкубация с мечеными фрагментами ДНК, комплементарными уникальным нуклеотидным последовательностям какого-либо аллеля гена HLA
Выявление фрагментов, с которыми связались меченые фрагменты ДНК, и определение их длины (по длине пробега фрагментов ДНК в геле)
Учет:
По длине фрагментов судят о присутствии тех или иных аллелей HLA у исследуемого
Если у донора и реципиента выявляются фрагменты одинаковой длины, считается, что они несут одинаковый аллель HLA
Слайд 30
Недостатки метода:
большие затраты времени (обычно 2-3 нед);
невозможность различить
аллели, сайты рестрикции в которых расположены в одних и
тех же участках;
большое количество клеток для исследования (для получения достаточного количества ДНК необходимо по крайней мере 10-15 млн клеток);
отсутствие эндонуклеаз, специфичных для определенных аллелей.
Слайд 31
Аллели генов HLA иногда отличаются друг от друга
лишь по одной паре нуклеотидов
Синтезированы одноцепочечные олигонуклеотидные зонды, состоящие
из 19-24 нуклеотидов, полностью комплементарные уникальным последовательностям каждого известного аллеля гена HLA
Созданы также зонды, комплементарные общим для нескольких аллелей последовательностям
Т.о., для определения неизвестного аллеля можно последовательно использовать серию зондов разной специфичности
Для гибридизации с олигонуклеотидными зондами можно использовать как рестрикционные фрагменты ДНК, полученные с помощью эндонуклеаз, так и фрагменты ДНК, полученные с помощью полимеразной цепной реакции
II. Определение специфических олигонуклеотидных последовательностей
Слайд 32
метод избирательной амплификации, предназначенный для получения большого количества
копий фрагментов ДНК с определенной нуклеотидной последовательностью
Достоинства метода:
высокая чувствительность
высокая
специфичность
прост в исполнении
нет необходимости в сложной очистке матрицы
подходит практически любой материал
Реакция проводится в программируемом термостате – амплификаторе
III. ПЦР
Слайд 33
Для проведения ПЦР в простейшем случае требуются следующие
компоненты:
ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать.
Два праймера,
комплементарные концам требуемого фрагмента.
Термостабильная ДНК-полимераза — полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermusaquaticus (Taq-полимераза), Pyrococcusfuriosus (Pfu-полимераза), Pyrococcuswoesei (Pwo-полимераза) и другие.
dNTP (dATP, dGTP, dCTP, dTTP).
Буферный раствор, обеспечивающий необходимые условия реакции —pH, ионную силу раствора. Содержит соли, бычий сывороточный альбумин.
Компоненты реакции
Слайд 34
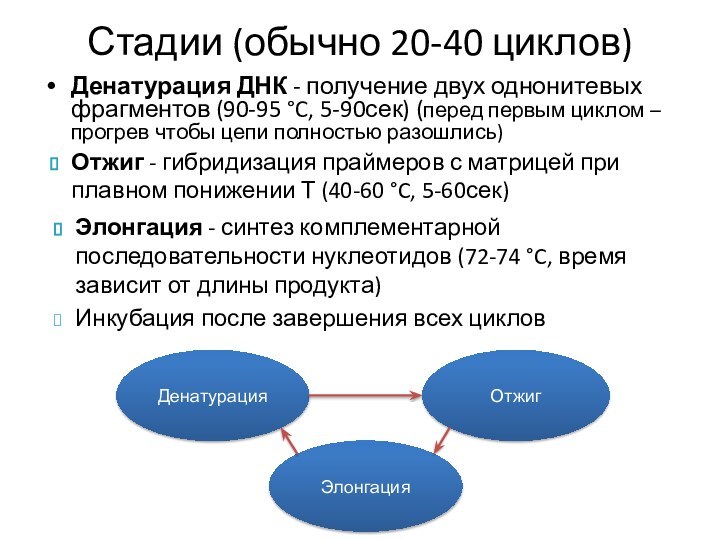
Денатурация ДНК - получение двух однонитевых фрагментов (90-95
°C, 5-90сек) (перед первым циклом – прогрев чтобы цепи
полностью разошлись)
Стадии (обычно 20-40 циклов)
Денатурация
Элонгация
Отжиг
Отжиг - гибридизация праймеров с матрицей при плавном понижении Т (40-60 °C, 5-60сек)
Элонгация - синтез комплементарной последовательности нуклеотидов (72-74 °C, время зависит от длины продукта)
Инкубация после завершения всех циклов
Слайд 35
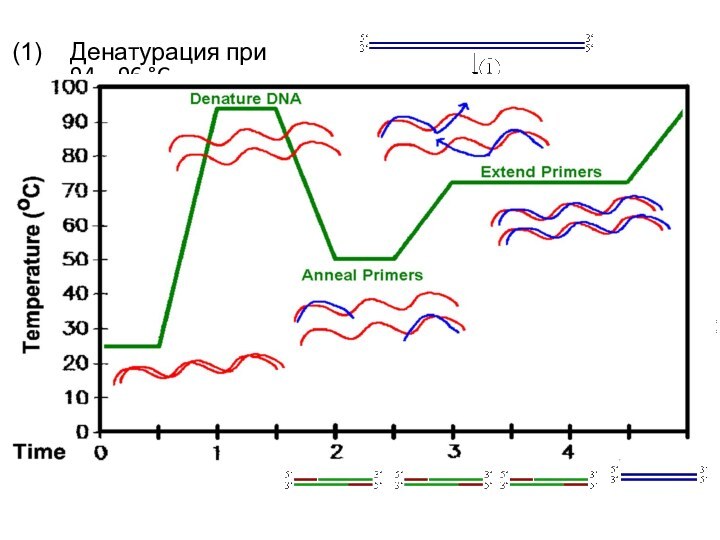
Денатурация при 94—96 °C
Отжиг при 68 °C
(например)
Элонгация при 72 °C (P=полимераза)
Закончен первый цикл.
Две
получившиеся ДНК-цепи служат матрицей для следующего цикла, поэтому количество матричной ДНК в ходе каждого цикла удваивается
Слайд 36
Количественная ПЦР или ПЦР в реальном времени (Q-PCR,
RT-PCR)
«Вложенная» ПЦР (Nested PCR)
«Инвертированная» ПЦР (Inverse PCR)
ПЦР с обратной
транскрипцией (Reverse Transcription PCR, RT-PCR)
Мультипраймерная полимеразная цепная реакция ПЦР (multiplex PCR, multiprimer PCR)
Заякоренная ПЦР
ПЦР длинных фрагментов (Long-range PCR)
Ассиметричная ПЦР (Asymmetric PCR)
Touchdown (Stepdown) ПЦР
Метод молекулярных колоний (ПЦР в геле, Polony - PCR Colony)
RAPD PCR (RandomAmplification of Polymorphic DNA PCR) ПЦР со случайной амплификацией полиморфной ДНК
ПЦР с использованием горячего старта (Hot-start PCR)
Виды ПЦР
Слайд 37
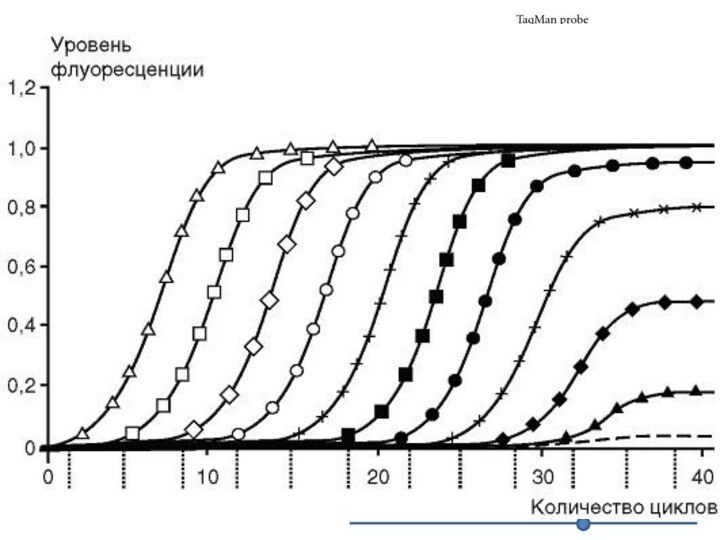
Регистрируется количественное накопление продукта в реальном времени, т.е.
после каждого цикла
Т.о. можно оценить кинетику реакции
Для этого исп-я
специфические комп-ты:
- флуоресцентный интеркалирующий краситель (SYBR-green)
- гибридизационные зонды (метод «TaqMan») - добавляют олигонуклеотидный зонд, меченный по 5'-концу флюорофором и содержащий глушитель флуоресценции, в ходе реакции термостабильная Taq-полимераза вытесняет зонд из дуплекса, а затем отщепляет его 5'-концевой нуклеотид, меченный флуорофором (светится, если отделен от глушителя)
Real time-PCR
Слайд 39
Исп-т 2 пары праймеров для уменьшения кол-ва побочных
продуктов
Вторая пара амплифицирует уч-к ДНК внутри первой пары
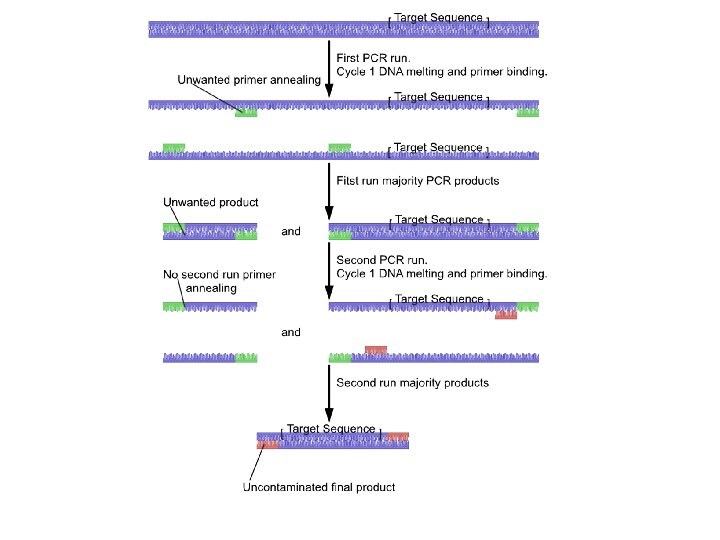
«Вложенная» ПЦР
(Nested PCR)
Слайд 41
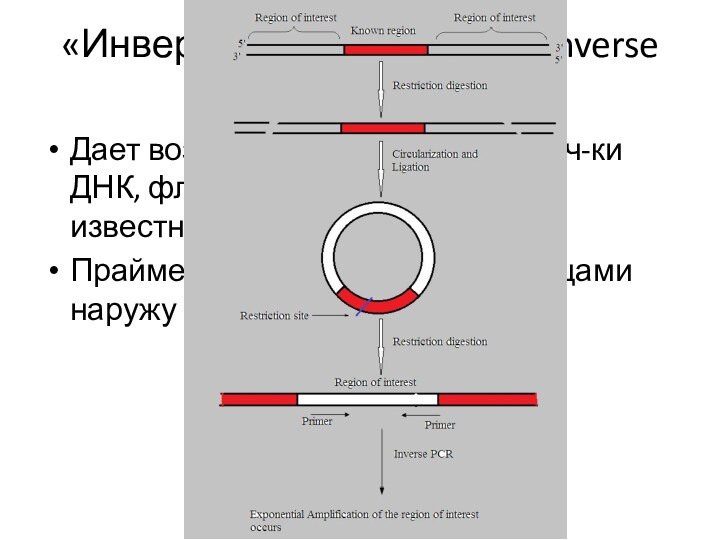
Дает возм-ть амплифицировать уч-ки ДНК, фланкирующие область с
известной последовательностью
Праймеры ориентированы 3’-концами наружу
«Инвертированная» ПЦР (Inverse PCR)
Слайд 42
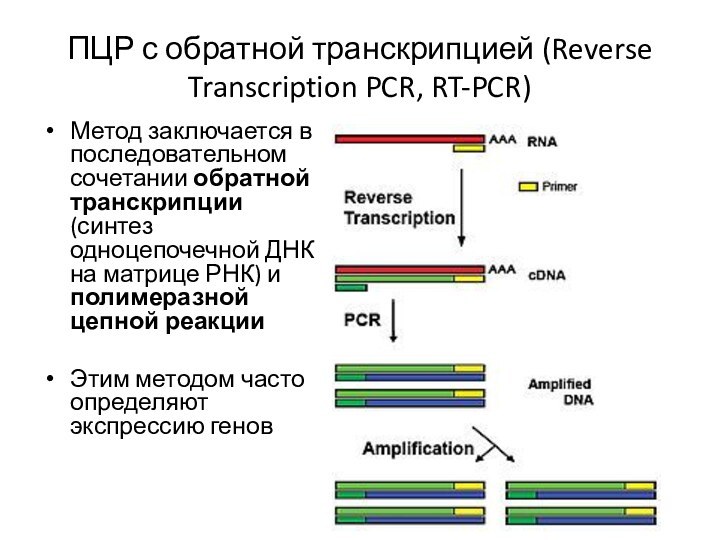
Метод заключается в последовательном сочетании обратной транскрипции (синтез
одноцепочечной ДНК на матрице РНК) и полимеразной цепной реакции
Этим
методом часто определяют экспрессию генов
ПЦР с обратной транскрипцией (Reverse Transcription PCR, RT-PCR)
Слайд 43
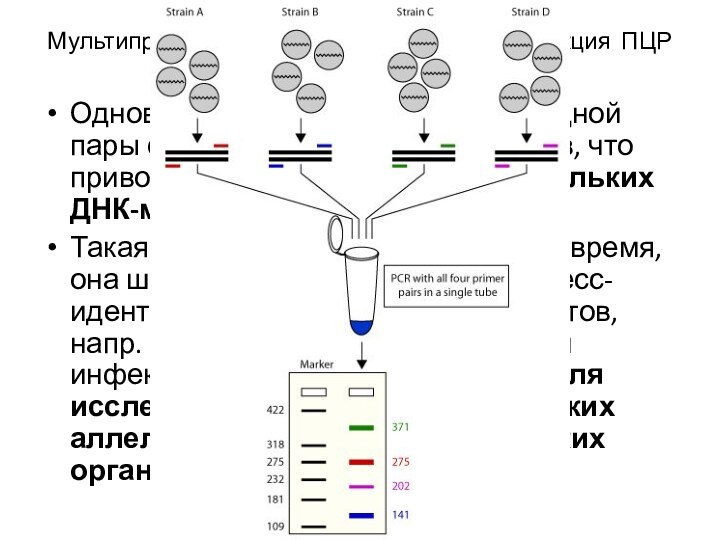
Одновременно используют более одной пары олигонуклеотидных праймеров, что
приводит к коамплификации нескольких ДНК-матриц
Такая реакция позволяет экономить время,
она широко используется для экспресс-идентификации инфекционных агентов, напр. скрининга сразу по нескольким инфекционным возбудителям, или для исследования состояния нескольких аллельных генов у эукариотических организмов
Мультипраймерная полимеразная цепная реакция ПЦР (multiplex PCR, multiprimer PCR)
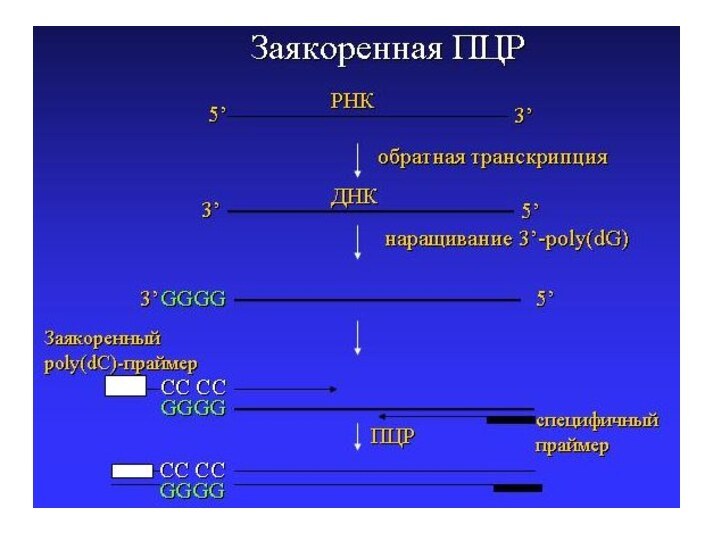
Слайд 44
Исп-т если в молекуле НК известна последовательность лишь
для одного из праймеров (н-р в случае РНК, легко
определить 3’-конец)
Принцип:
РНКДНК, к 3’-концу которой присоединяют поли(dG)-блок с пом-ю терминальной трансферазы
Амплификацию проводят при участии «заякореннго» праймера, сод-го поли(dC)-послед-ть, и специфичного праймера
Заякоренная ПЦР
Слайд 45
Модификация ПЦР для амплификации протяженных участков ДНК (10
тысяч и более оснований)
Используют смесь двух полимераз, одна из
которых — Taq-полимераза с высокой процессивностью (то есть, способная за один проход синтезировать длинную цепь ДНК), а вторая — ДНК полимераза с 3'-5' экзонуклеазной активностью, обычно это Pfu полимераза
Вторая полимераза необходима для того, чтобы корректировать ошибки, внесённые первой
ПЦР длинных фрагментов (Long-range PCR)
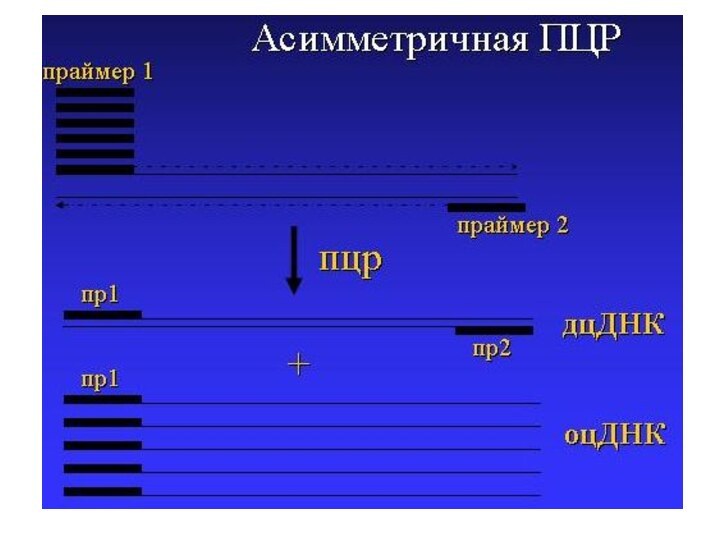
Слайд 46
Вариант ПЦР, при котором концентрация одного из двух
праймеров очень низка, и он быстро истощается в ходе
реакции
С этого момента синтез ДНК продолжается с одного праймера и нарабатываются одноцепочечные фрагмены ДНК
Проводится тогда, когда нужно амплифицировать преимущественно одну из цепей исходной ДНК
Используется в некоторых методиках секвенирования ДНК и гибридизационного анализа
Ассиметричная ПЦР (Asymmetric PCR)
Слайд 47
С помощью этого подхода уменьшают влияние неспецифического связывания
праймеров
Первые циклы проводят при температуре выше оптимальной температуры отжига,
затем каждые несколько циклов температуру отжига постепенно снижают до оптимальной
Это делается для того, чтобы праймер гибридизовался с комплементарной цепью всей своей длиной; тогда как при оптимальной температуре отжига, праймер частично гибридизуется с комплементарной цепью.
Touchdown (Stepdown) ПЦР
Слайд 48
Метод молекулярных колоний (ПЦР в геле, англ. Colony
- PCR Colony) — акриламидный гель полимеризуют со всеми
компонентами ПЦР на поверхности и проводят ПЦР. В точках, содержащих анализируемую ДНК, происходит амплификация с образованием молекулярных колоний.
ПЦР с использованием горячего старта (Hot-start PCR) — вариант полимеразной цепной реакции для предотвращения неспецифической амплификации фрагментов ДНК (в одном из вариантов метода для этой цели первоначально ДНК-полимеразу и реакционную смесь разделяют легкоплавким физическим барьером (напр., воском); при нагревании пробирки переход ДНК-полимеразы в реакционную смесь происходит при температуре около 55 °С)
Слайд 49
SSO (sequence specific oligonucleotide) — неспецифическая амплификация исследуемого

участка (локуса) ДНК с последующей специфической гибридизацией с мечеными
ДНК-зондами.
RFLP (restriction fragment length polymorphism) — неспецифическая амплификация с последующим расщеплением продуктов амплификации набором рестриктаз. По длине полученных продуктов судят о нуклеотидном составе.
SSCP (single-strand conformation polymorphism) — различие аллелей по электрофоретической подвижности одноцепочечных ДНК, обусловленной характерными элементами вторичной структуры.
SSP (sequence specific primer) — наиболее распространенная и технически простая методика, когда каждому аллельному варианту либо группе аллелей соответствует своя пара праймеров.
MSSP (mixture of sequence specific primer, новый вариант SSP) — позволяющая за счет более рационального выбора праймеров и режимов амплификации выявить сразу несколько специфичностей, используя одну пробирку и одну дорожку на геле. Длительность определения — около часа.
Методы ПЦР применительно к генотипированию HLA