- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Хімічний склад об’єктів природного середовища
Содержание
- 2. Атмосфера
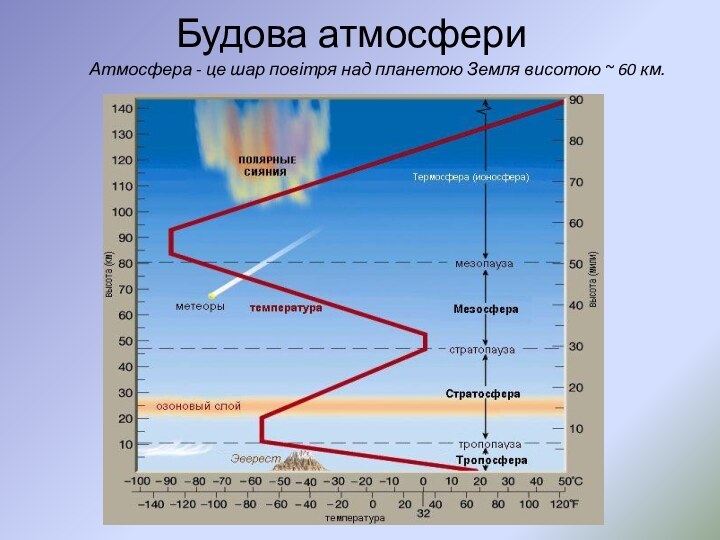
- 3. Будова атмосфериАтмосфера - це шар повітря над планетою Земля висотою ~ 60 км.
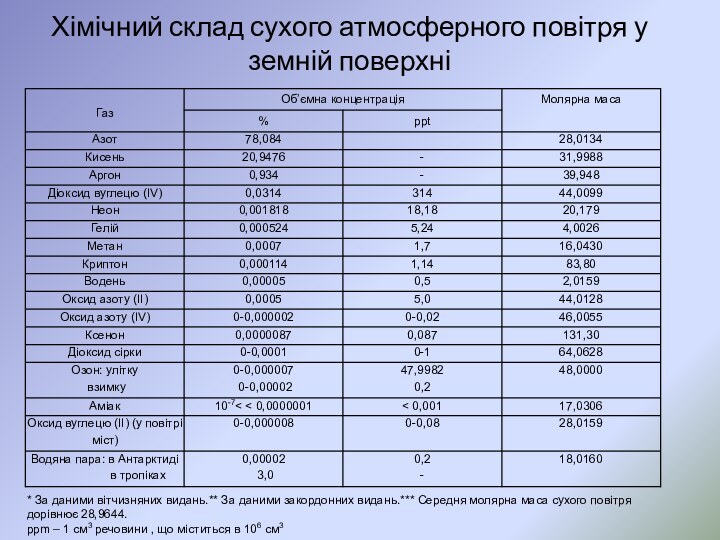
- 4. Хімічний склад сухого атмосферного повітря у земній
- 5. Шкідливі речовини в атмосфері:частки сажі, азбесту,свинцю, пилу,зважені
- 6. Нормальний склад (компоненти чистого сухого повітря) атмосфери Землі в % (об'ємних)
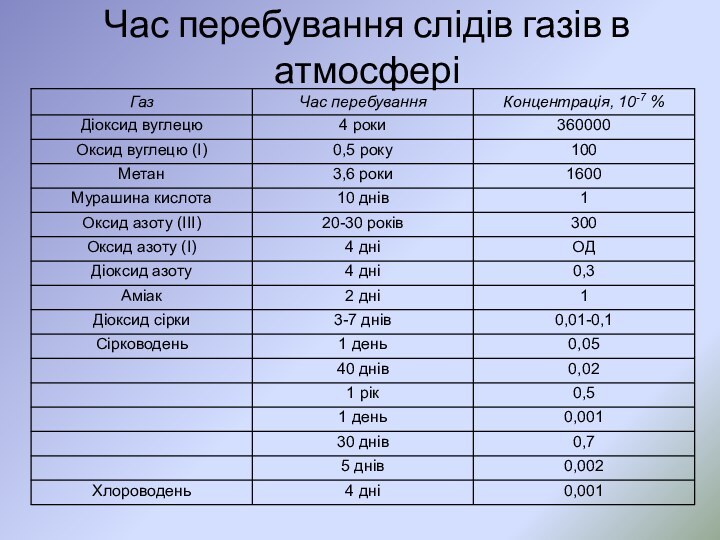
- 7. Час перебування слідів газів в атмосфері
- 8. Атмосферні опадидощснігградводи мряки роси іній
- 9. Основні забруднювачі атмосфериоксиди сірки (SO2 і SO3);оксиди
- 10. Оксиди сірки (SO2 і SO3) Оксиди сірки
- 11. Оксид вуглецю (II)(CO) Джерела СО в атмосфері
- 12. Оксид вуглецю (IV)(CO2) де 2820 кДж - кількість сонячної енергії, використаної в процесі фотосинтезу 700
- 13. Пил Основний внесок вносять виробництва:будматеріалів, дроблення порід у гірничодобувній промисловості, виробництво цементу, будівництво.
- 14. Аерозолі (пил, дим, туман та ін.)За розмірами
- 15. Кисень (O2) Вміст газів в атмосфері Землі,
- 16. Озон (O3) Цикл ЧепменаОзон утворюється у верхніх
- 17. ХФВНаслідки зменшення озонного шару від 30 до
- 18. Фізико-хімічні методи очищення атмосфери від газоподібних забруднювачів
- 19. Основні методи очисткиАбсорбція - поглинання газів або
- 20. Очищення газів від CO2 Абсорбція водою. Цей
- 21. Цеоліти або молекулярні ситаЦеоліти - це синтетичні
- 22. Основні властивості синтетичних цеолітів Caa(5A) наведені в таблиці:
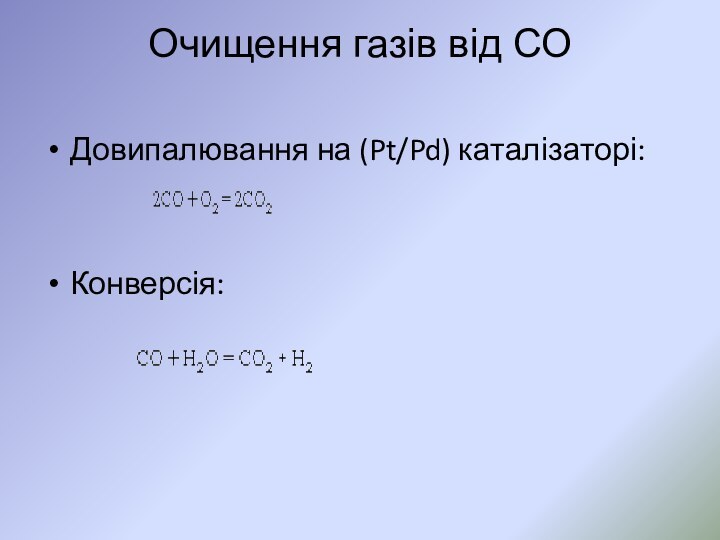
- 23. Очищення газів від СО Довипалювання на (Pt/Pd) каталізаторі:Конверсія:
- 24. Очищення газів від оксидів нітрогену Каталітичне окиснення
- 25. Очищення газів від SO2Аміачні методи взаємодія SO2
- 26. Очищення газів від зважених часток Гравітаційне осідання.Центрифугирование.Електростатичне осідання.Інерційний удар.Пряме захоплення.Дифузія.
- 27. Система державних і міжнародних стандартів з якості
- 28. Хімічний склад, класифікація природних вод
- 29. Класифікація природних вод за величиною мінералізації
- 30. Якісний склад матриці природних водМатриця природних вод
- 31. Класифікація природних вод за вмістом іонівЗа вмістом
- 32. Основні групи хімічних інгредієнтів природних водГоловні іони(сольові
- 33. Основні показники властивостей природних водпрозорість,кольоровість,каламутність,смак, запах, кислотність рН,окисно-відновний потенціал (Еh), електропровідність п'ятидобове біохімічне споживання кисню (БСК5).
- 34. За фізико-географічними умовами формування хімічного складу природні
- 35. Поверхневі води суші
- 36. Склад поверхневих вод суші
- 37. Склад поверхневих вод сушіФК— аніони фульфокислот. ГК
- 38. Середній ступінь зв'язування іонів деяких мікроелементів у
- 39. Органічна речовина природних вод
- 40. Підземніі води
- 41. При тісному контакті води з різноманітними породами
- 42. Основні хімічні критерії класифікації лікувальних мінеральних водЗагальна
- 43. Основні хімічні критерії класифікації лікувальних мінеральних водЗагальна
- 44. Морські та океанські води
- 45. Особливості хімічного складу води океанів єНадзвичайно різноманітний
- 46. Середній хімічний склад морської води
- 47. Іонний склад річкової та морської води
- 48. Головні іони води океанів та
- 49. Зони глибини океанських вод, за концентрацією розчиненного
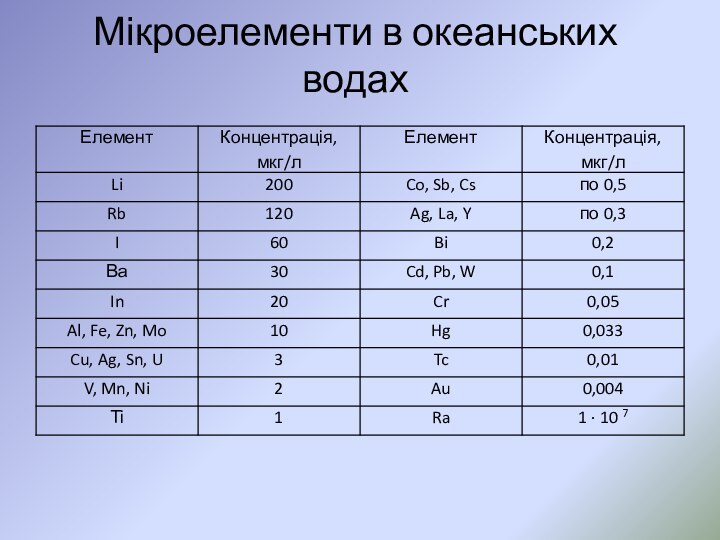
- 50. Мікроелементи в океанських водах
- 51. Хімічний склад ґрунтів та донних відкладень (сапропель)
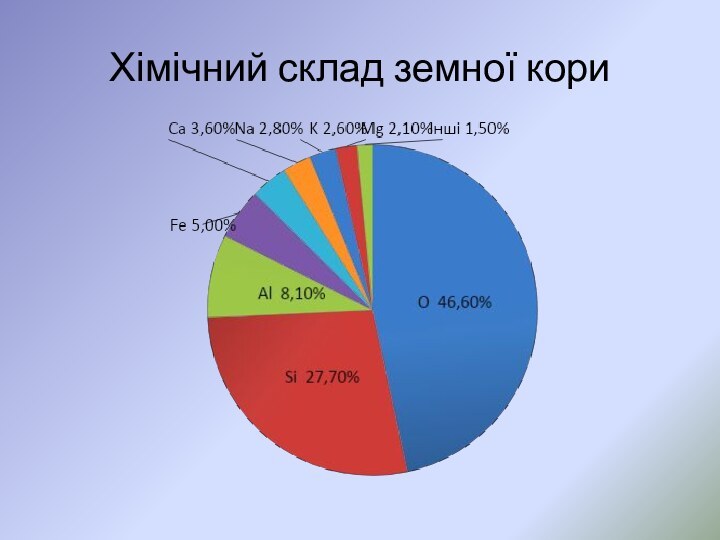
- 52. Хімічний склад земної кори
- 53. Склад ґрунтів Хімічний склад ґрунтів виражають через
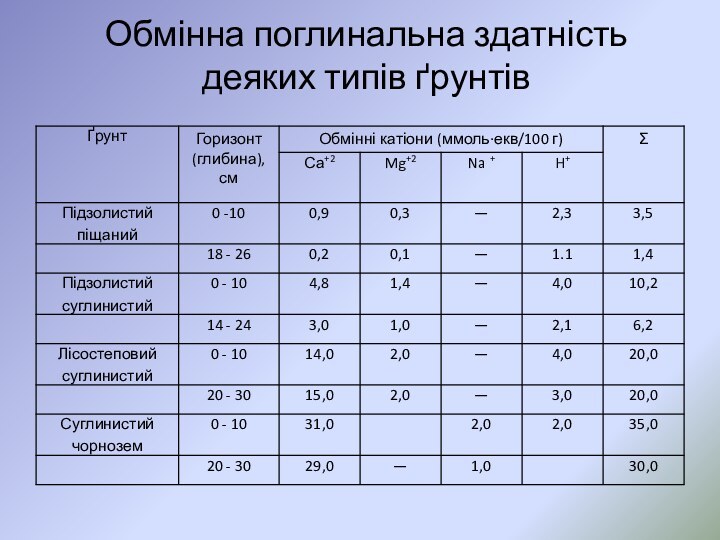
- 54. Обмінна поглинальна здатність деяких типів ґрунтів
- 55. Забруднення літосфериЗагальна площа суши Землі - 148
- 56. Тверді побутові відходи і їх утилізація Основні
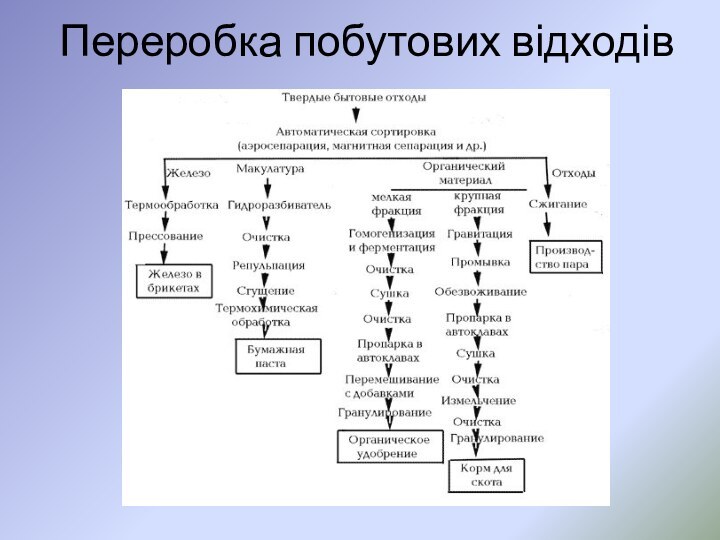
- 57. Переробка побутових відходів
- 58. Тверді промислові відходи і їх переробка Розрізняють
- 59. Скачать презентацию
- 60. Похожие презентации















































Слайд 4
Хімічний склад сухого атмосферного повітря у земній поверхні
*
За даними вітчизняних видань.** За даними закордонних видань.*** Середня
молярна маса сухого повітря дорівнює 28,9644.ppm – 1 см3 речовини , що міститься в 106 см3
Слайд 5
Шкідливі речовини в атмосфері:
частки сажі,
азбесту,
свинцю,
пилу,
зважені рідкі
краплі вуглеводнів,
сірчана кислота,
оксиди вуглецю,
оксиди нітрогену,
оксиди сірки і
т.д.
Слайд 9
Основні забруднювачі атмосфери
оксиди сірки (SO2 і SO3);
оксиди нітрогену
(NxОy);
оксиди вуглецю (CO і CO2);
вуглеводні (CxНy);
пил
200 млн. тонн оксиду
сірки (IV) і пилу,~ 60 млн. тонн оксидів нітрогену,
80 млн. тонн, оксидів вуглецю,
~ 80 млн. тонн різних вуглеводнів
Слайд 10
Оксиди сірки (SO2 і SO3)
Оксиди сірки потрапляють в
атмосферу в результаті :
Спалювання палива (бурого вугілля, мазуту, сірковмісних
нафтопродуктів),у процесі роботи теплових електростанцій (ТЕС),
при переробці поліметалевих сірковмісних руд різних металів (PbS, ZnS, CuS, NiS, MnS і т.д.).
ТЕС потужністю 1 млн. кВт при роботі на кам'яному вугіллі викидає 11 тис. тонн SO2 у рік, при роботі на газі - 20% від цієї кількості
Переробка сірковмісних руд S окиснюється до SO2 і SO3. До SO3 окиснюється менш 3% вихідної сірки.
Слайд 11
Оксид вуглецю (II)(CO)
Джерела СО в атмосфері міст :
(понад
90%) є автотранспорт,
тютюновий дим, з яким зустрічаються не
тільки курці, але і їх найближче оточення. Норма ГДК —3 мг/м3 (СО)
Слайд 12
Оксид вуглецю (IV)(CO2)
де 2820 кДж - кількість сонячної
енергії, використаної в процесі фотосинтезу
700
ІЧ випромінювання400 <λ< 700 нм видима ділянка спектру
Відбиває 700 <λ< 1400 нм , поглинає 400 <λ< 700 нм
З 1850 року по теперішній час зміст CO2 в атмосфері Землі зріс з 0,027% до 0,033%.
Вилучається з атмосфери:
1- в процесі фотосинтезу
2- зв’язування в карбонати
Слайд 13
Пил
Основний внесок вносять виробництва:
будматеріалів,
дроблення порід у гірничодобувній
промисловості,
виробництво цементу,
будівництво.
Слайд 14
Аерозолі (пил, дим, туман та ін.)
За розмірами поділяють:
найдрібніші
(частинки Айткена) з радіусом r=2∙10-5 см
великі (r = 2∙10-5
см-1 - 1∙10-4 см)гігантські (r >1∙10-4 см)
В аерозолях міститься основна маса хімічних інгредієнтів, які випадають на поверхню Землі з атмосферними опадами
Осередки конденсації атмосферної вологи.
Слайд 15
Кисень (O2)
Вміст газів в атмосфері Землі, Венери й
Марса, %
Продуценти кисню на Землі:
зелені водорості поверхневих вод світового
океану (60%)тропічні ліси суши (30%).
Слайд 16
Озон (O3)
Цикл Чепмена
Озон утворюється у верхніх шарах стратосфери
й нижніх шарах мезосфери за реакціями:
M - різні складові
атмосфери, наприклад, кисень або нітроген2. Озон поглинає УФ-випромінювання,
3. Озон і атомарний кисень можуть реагувати в кисневій атмосфері за реакціями:
Слайд 17
ХФВ
Наслідки зменшення озонного шару від 30 до 90%.:
а)
рак шкіри прийме епідемічний характер, тому що очікується, що
кожний відсоток зменшення товщини озонного шару спричинить збільшення числа випадків захворювання раком шкіри на 5-6%;б) різко скоротиться кількість планктонів у світовому океані;
в) зникнуть багато видів тварин, (ракоподібні);
г) УФ-випромінювання несприятно позначиться на сільськогосподарських культурах.
Слайд 19
Основні методи очистки
Абсорбція - поглинання газів або пару
з газових або парових сумішей рідкими поглиначами, абсорбентами.
Адсорбція –
селективне відділення компонентів за допомогою твердих матеріалів, адсорбентами, що й мають більшу питому поверхню.Каталітичне - очищення засноване на каталітичних реакціях, у результаті яких домішки перетворюються в нешкідливі, менш шкідливі або сполуки, що легко віддаляються.
Санітарне очищення промислових викидів містить у собі очищення від оксидів вуглецю, оксидів нітрогену, оксидів сірки й пилу.
Слайд 20
Очищення газів від CO2
Абсорбція водою. Цей спосіб простий
і дешевий, однак ефективність очищення в цьому випадку мала,
тому що максимальна поглинальна здатність води становить 8 кг CO2 на 100 кг води.Поглинання розчинами этанол-амінів:
Очищення цеолітами типу CaА.
Слайд 21
Цеоліти або молекулярні сита
Цеоліти - це синтетичні або
природні мінерали (алюмосилікати) загальної формули: М2/n* Al2O3n *xSiO2* yH2O,
де М - лужний або лужно-земельний метал; n - його ступінь окисненняСелективність адсорбції цеолітами обумовлена наявністю тонких пор певного розміру, тому їх часто називають молекулярними ситами.
Слайд 24
Очищення газів від оксидів нітрогену
Каталітичне окиснення 80% здійснюється
за рахунок перетворень на каталізаторах.
окиснення оксидів нітрогену з наступним
поглинанням водою й утворенням нітратної кислоти.окиснення озоном у рідкій фазі:
окиснення киснем при високій температурі:
відновлювальтні методи засновані на відновленні оксидів нітрогену до нейтральних продуктів у присутності каталізаторів або під дією високих температур:
розкладання оксидів нітрогену до нейтральних складових атмосфери (N2 + O2) відбувається в потоці низькотемпературної плазми (10000°С).
Сорбційні методи:
- адсорбція оксидів нітрогену водяними розчинами лугів і вапном,
- адсорбція твердими сорбентами (буре вугілля, торф, силікагелі, цеоліти)
Слайд 25
Очищення газів від SO2
Аміачні методи взаємодія SO2 з
водяним розчином сульфіту амонію:
гідросульфіт амонію
легко
розкладається кислотами (сірчаною, нітратною, фосфорною):Метод нейтралізації - поглинання SO2 розчином соди, вапна або суспензіями основних оксидів:
а) содовий метод:
б) вапняний метод:
в) магнезитовий метод:
г) цинковий метод:
Каталітичні методи перетворення SO2 в H2SO4 у присутності каталізаторів (піролюзит).
Слайд 26
Очищення газів від зважених часток
Гравітаційне осідання.
Центрифугирование.
Електростатичне осідання.
Інерційний удар.
Пряме
захоплення.
Дифузія.
Слайд 27 Система державних і міжнародних стандартів з якості атмосферного
повітря
ДСТУ ISO 4226:2004 Якість повітря. Загальні положення.
Одиниці ISO
4226:1993 вимірювання.ДСТУ ISO 6879-2003 Якість повітря. Характеристики і настанови щодо ISO 6879:1995 вимірювання якості повітря.
ДСТУ ISO 7168-1 -2003 Якість повітря. Обмін даними. Частина 1.
ISO 7168-1:1999 Загальний формат даних
ДСТУ ISO 7168-2-2003 Якість повітря. Обмін даними. Частина 2.
ISO 7168-2-1999 Стислий формат даних.
ДСТУ ISO 7708-2003 Визначення розміру фракцій під час відбирання
ISO 7708:1995 проб частинок, які впливають на здоров'я людини.
ISO 1000:1992 Одиниці СІ, рекомендації по використанню.
ISO 3534-1:1993 Статистичні дані. Глосарій та символи. 4.1. Вірогідність та загальні статистичні терміни. Міждержавні і європейські ГОСТ 17.2.1.01
Слайд 30
Якісний склад матриці природних вод
Матриця природних вод –
сума сольових компонентів, мінералізація І [г/кг]
Характеризується співвідношенням іонів:
Na+, Mg2+,Ca2+, Cl-, SO42-,HCO3-, CO32-
Слайд 31
Класифікація природних вод за вмістом іонів
За вмістом аніонів:
- гідрокарбонатні і карбонатні (HCO3- і CO32-);
- сульфатні (SO4-2);- хлоридні (Cl-)
За вмістом катіонів:
- кальцієві,
- магнієві,
- натрієві.
Поверхневі води України є в основному гідрокарбонатно-кальцієвими, морські води – хлоридно-натрієві, колодязні води – сульфатно-магнієві (“гірка вода”)
Слайд 32
Основні групи хімічних інгредієнтів природних вод
Головні іони
(сольові компоненти)
Na+,
Mg+2, Ca+2, Cl-, SO4-2 HCO3-, CO3-2
Розчинені гази
О2, СO2, Н2S,
СН4 тощо
Біогенні елементи
NH4+, NO, NO-, NO3-, азот органічний, фосфор органічний, орто-, поліфосфати, ортосилікати, Fe2+ і Fe3+
Мікроелементи
Mn, Zn, Co, Cu, Мо
біометали
Ni, Cr, Cd, Pb, Hg, F та інші компоненти (неорганічні промислові забруднювачі).
Органічні речовини
Вуглець, білки, аміни, амінокислоти, карбонові кислоти, гумусові та фульвокислоти та інші.
Слайд 33
Основні показники властивостей природних вод
прозорість,
кольоровість,
каламутність,
смак,
запах,
кислотність рН,
окисно-відновний
потенціал (Еh),
електропровідність
п'ятидобове біохімічне споживання кисню (БСК5).
Слайд 34 За фізико-географічними умовами формування хімічного складу природні води
поділяють:
поверхневі води суші (річки, озера, водоймища, ставки)
підземні води (артезіанські
та мінеральні)морські та океанські води
атмосферні опади
Слайд 37
Склад поверхневих вод суші
ФК— аніони фульфокислот. ГК —
гумінових кислот. L — лимонної та глутамінової кислот.
У
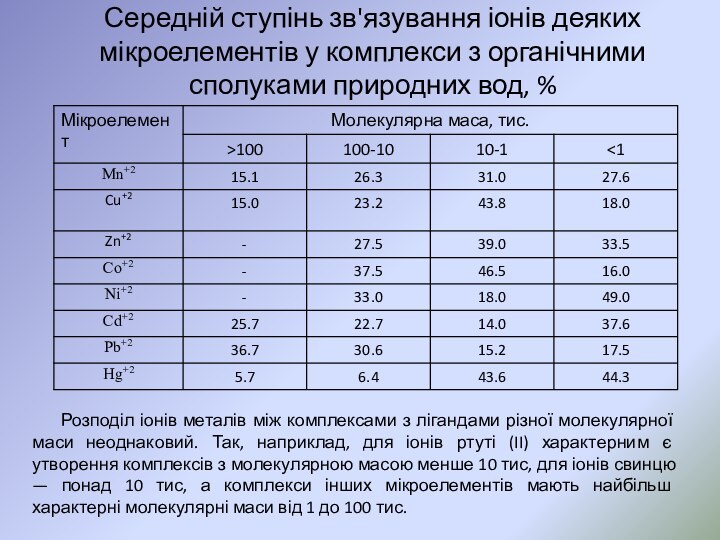
переважній більшості випадків n= 1, z = 1 або 2.Слайд 38 Середній ступінь зв'язування іонів деяких мікроелементів у комплекси
з органічними сполуками природних вод, %
Розподіл іонів металів між
комплексами з лігандами різної молекулярної маси неоднаковий. Так, наприклад, для іонів ртуті (II) характерним є утворення комплексів з молекулярною масою менше 10 тис, для іонів свинцю — понад 10 тис, а комплекси інших мікроелементів мають найбільш характерні молекулярні маси від 1 до 100 тис.Слайд 41 При тісному контакті води з різноманітними породами та
мінералами протягом тривалого часу
На великих глибинах взаємодія води з
породами відбувається при тиску в сотні тисяч атмосфер і часто при високих (понад 100°С) температурах, Наявність малопроникних порід, які роз'єднують окремі водоносні горизонти, створює умови для утворення досить різноманітних та інертних за хімічним складом вод.
Слайд 42
Основні хімічні критерії класифікації лікувальних мінеральних вод
Загальна мінералізація:
2—5 г/л — води слабкої мінералізації,
5—10 г/л
— середньої мінералізації, 15—35 г/л — високої мінералізації,
35—150 г/л води розсольні,
понад 150 г/л — сильно-розсольні;
За вмістом СО2 :
0,5—1,4 г/л —води слабковуглекислі,
1,4—2,5 мг/л — вуглекислі,
понад 2,5 мг/л — сильно вуглекислі «газуючі», які спонтанно виділяють СО2;
За вмістом H2S:
10—50 мг/л — води слабкосульфідні,
50— 100 мг/л — сульфідні середньої концентрації,
100—250 мг/л — сильносульфідні,
понад 250 мг/л — дуже сильносульфідні, які при рН < 6,5 називаються сірководневими, а при рН = 6,5—7,5 — сірководнево-сульфідними і при рН > 7,5 — гідросульфід ними;
За вмістом As :
0,7—5,0 мг/л — води арсенисті,
5,0—10 мг/л — сильноарсенисті,
понад 10 мг/л —дуже сильноарсенисті;
За вмістом Fe(II, III):
20—40 мг/л —води залізисті,
40—100 мг/л — сильнозалізисті,
понад 100 мг/л —дуже сильнозалізисті);
Слайд 43
Основні хімічні критерії класифікації лікувальних мінеральних вод
Загальна мінералізація
2—5г/л — води слабкої мінералізації,
5—10 г/л —
середньої мінералізації, 15—35 г/л високої мінералізації,
35—150 г/л — води розсольні,
понад 150 г/л — сильно-розсольні;
За вмістом СО2 :
0,5—1,4 г/л —води слабковуглекислі,
1,4—2,5 мг/л — вуглекислі,
понад 2,5 мг/л — сильно вуглекислі «газуючі», які спонтанно виділяють СО2;
За вмістом H2S:
10—50 мг/л — води слабкосульфідні,
50— 100 мг/л — сульфідні середньої концентрації,
100—250 мг/л — сильносульфідні,
понад 250 мг/л — дуже сильносульфідні, які при рН < 6,5 називаються сірководневими, апри рН = 6,5—7,5 — сірководнево-сульфідними
при рН > 7,5 — гідросульфід- ними;
За вмістом As :
0,7—5,0 мг/л — води арсенисті,
5,0—10 мг/л — сильноарсенисті,
понад 10 мг/л —дуже сильноарсенисті;
За вмістом Fe(II, III):
20—40 мг/л —води залізисті,
40—100 мг/л — сильнозалізисті,
понад 100 мг/л —дуже сильнозалізисті);
За вмістом Вг :
> 25 мг/л — води бромні;
За вмістом І- :> 5 мг/л — води йодні;
За вмістом силікатів: > 50 мг/л — води силіцисті;
За вмістом Rn:
200—1600 Бк/л — води слабкорадонові,
1600— 8000 Бк/л — радонові середньої концентрації,
понад 8000 Бк/л —високорадонові;
рН води:
3—3,5 —води сильнокислі,
3,5—5,5 —кислі,
5,5— 6,8 —слабкокислі,
6,8—7,2 —нейтральні,
7,2—8,5 —слабколужні,
8,5 —лужні;
За температурою:
< 20°С —води холодні,
20—35°С —теплі, слабкотермальні,
35—42°С — гарячі, термальні,
42°С — дуже гарячі, високотермальні).
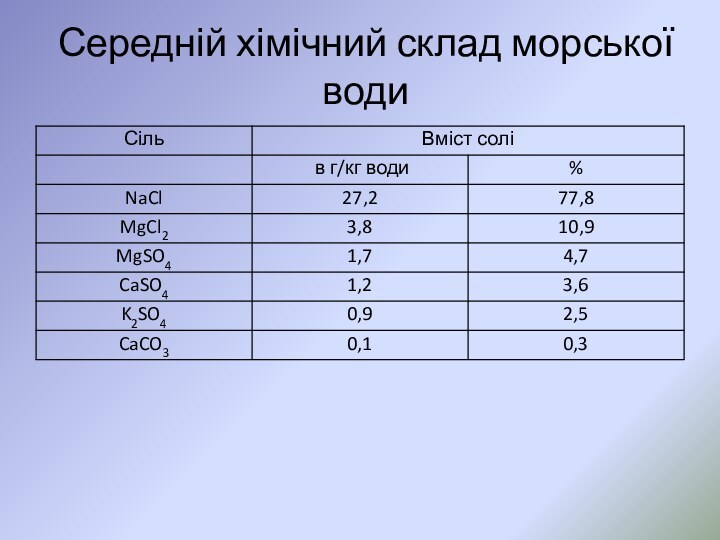
Слайд 45
Особливості хімічного складу води океанів є
Надзвичайно різноманітний якісний
склад води.
Загальна мінералізація морських та океанських вод досягає
35 г/кг.;Постійний в часі та однорідний у різних частинах океану основний хімічний склад води, стабільність сольової маси океану. Однорідність сольового складу океанів по акваторії та глибині
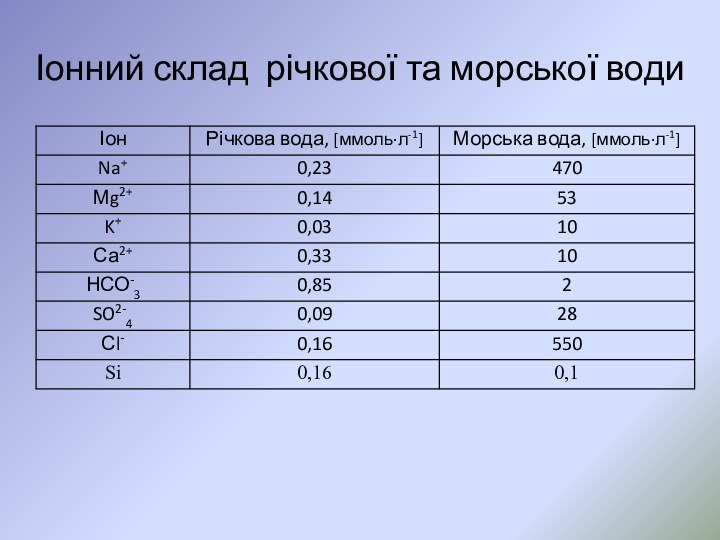
Слайд 48
Головні іони води океанів та їх концентрація
Сl-
> SO2-4 > НСО3- > СО32- Na+ > Mg2+
> Ca2+ > К+.
* концентрацію головних іонів у морських та океанських водах прийнято виражати в г/кг і позначати символом °/00 (проміле);
Слайд 49
Зони глибини океанських вод, за концентрацією розчиненного кисню:
верхня
(глибина 100—300 м) з максимальним вмістом кисню 95—100% насичення,
проміжна (300—1400 м) з мінімальним насиченням киснем 5—30% ,
глибинна (глибше 1400—1600 м) з дещо більшим, до 70—80%, насиченням киснем.
розподіл розчиненого кисню пояснюється тим, що у поверхневих шарах відносно теплої води відбувається інтенсивний фотосинтез, який згасає в міру збільшення глибини.
Слайд 53
Склад ґрунтів
Хімічний склад ґрунтів виражають через процентний
вміст оксидів елементів, віднесений до повітряно-сухої проби.
Мінеральна частина
- силікати та алюмосилікати, (сумарний вміст, виражений в оксидах, становить понад 80—85%).До складу ґрунтів входять у значних кількостях сполуки магнію, кальцію, натрію, титану, мангану, фосфору (фосфати), сірки (сульфати) та неорганічного вуглецю (карбонати).
З органічних компонентів до валового складу ґрунтів входять органічний вуглець (Сор,) та азот (Nорг).
Вміст неорганічного фосфору (Р2О5) в ґрунтах є досить сталим. В той же час вміст сульфатної сірки (SO42-) та карбонатного вуглецю(СO2) може коливатися в широких межах; це саме стосується Сорг та Nорг .
Найбільш важливими з мікроелементів для розвитку рослин є бор (його вміст змінюється в межах 1—200 мг/кг), манган (20—5000 мг/кг), мідь (1—150 мг/кг), цинк (5—100 мг/кг), кобальт (0,5—20 мг/кг) та молібден (0,2— 10 мг/кг).
Слайд 55
Забруднення літосфери
Загальна площа суши Землі - 148 млн.
км2, для проживання людей придатні 133 млн. км2.
Причини забруднення
літосфери: стічних вод,
нафтопродуктів,
викид аерозолів, пилу,
забруднення ґрунту пестицидами
тверді побутові й промислові відходи.
До складу твердих побутових відходів входять харчові відходи, папір, картон, скло, текстиль, метали, полімери і т.д.
До складу твердих промислових відходів входять метали (чорні й кольорові), сміття, деревина, пластмаси, шлаки, окалина, зола і т.д.
1- мешканець міста - 1 тонна твердих відходів у рік
Слайд 56
Тверді побутові відходи і їх утилізація
Основні методами знешкодження
:
сміттяспалювальні заводи,
сміттяпереробні заводи
санкціоновані смітники.
Санкціоновані смітники – це
складування ТПВ, яке передбачає довгочасну переробку відходів при участі кисню повітря й мікроорганізмів. Сміттяспалювальні заводи - більш ефективні за способом знешкодження ТПВ ніж санкціоновані смітники.
Сміттяпереробні заводи - це найбільш перспективний метод знешкодження ТПВ, основний продукт переробки є компост.
Слайд 58
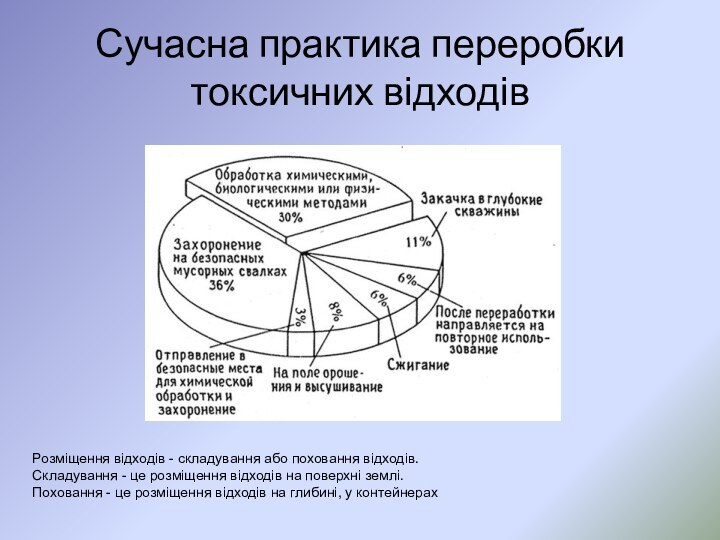
Тверді промислові відходи і їх переробка
Розрізняють нетоксичні й
токсичні промислові відходи.
Токсичні відходи підрозділяють на чотири класи
токсичності: -надзвичайно токсичні,
-високотоксичні,
-помірковано токсичні
-малотоксичні.
Основними видами твердих промислових відходів є:
-шлаки теплових електростанцій і металургійних заводів,
-природні відвали гірничодобувних підприємств і горнозбагачувальних комбінатів,
-будівельне сміття і т.д.
Знешкодження, утилізація й розміщення відходів - це обов'язок підприємства, відповідальні за забруднення навколишнього середовища.
Знешкодження відходів - це видалення з них шкідливих домішок.
Утилізація відходів означає й знешкодження й одночасний витяг з них корисних продуктів.
Токсичні відходи піддають знешкодженню й похованню на спеціально організованих полігонах. Навколо ділянок поховання токсичних відходів відводять санітарно-захисні зони з радіусом не менш 3 км.





























