История развития представлений о металлах.
Знакомство человека с металлами началось с золота, серебра и меди, то есть с металлов, встречающихся в свободном состоянии на земной поверхности; впоследствии к ним присоединились металлы, значительно распространенные в природе и легко выделяемые из их соединений: олово, свинец, железо и ртуть. Эти семь металлов были знакомы человечеству в глубокой древности. Среди древнеегипетских артефактов встречаются золотые и медные изделия, которые, по некоторым данным, относятся к эпохе, удаленной на 3000—4000 лет от н. э.
К семи известным металлам в средние века прибавились цинк, висмут, сурьма и в начале XVIII столетия мышьяк. С середины XVIII века число открытых металлов быстро возрастает и к началу XX столетия доходит до 65.
Ни одно из химических производств не способствовало столько развитию химических знаний, как процессы, связанные с получением и обработкой металлов; с историей их связаны важнейшие моменты истории химии. Свойства металлов так характерны, что уже в самую раннюю эпоху золото, серебро, медь, свинец, олово, железо и ртуть составляли одну естественную группу однородных веществ, и понятие о «металле» относится к древнейшим химическим понятиям. Однако воззрения на их натуру в более или менее определенной форме появляются только в средние века у алхимиков. Правда, идеи Аристотеля о природе: образовании всего существующего из четырёх элементов (огня, земли, воды и воздуха) уже тем самым указывали на сложность металлов; но эти идеи были слишком туманны и абстрактны. У алхимиков понятие о сложности металлов и, как результат этого, вера в возможность превращать одни металлы в другие, создавать их искусственно, является основным понятием их миросозерцания.
Слайд 3
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов,в виде простых вещество обладающих характерными
металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и
металлический блеск.
Свойства металлов:
-Металлический блеск (характерен не только для металлов: его имеют и неметаллы йод и углерод в виде графита)
-Хорошая электропроводность
-Возможность лёгкой механической обработки (см.: пластичность; однако некоторые металлы, например германий и висмут непластичны)
-Высокая плотность (обычно металлы тяжелее неметаллов)
-Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
-Большая теплопроводность
-В реакциях чаще всего являются восстановителями.
Металлы делят на черные и цветные, тугоплавкие и легкоплавкие, благородные и неблагородные. Все они имеют кристаллическое строение. В жидком состоянии атомы располагаются хаотически.
Слайд 4
Температуры плавления чистых металлов лежат в диапазоне от

−39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов
(за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Слайд 5
Все металлы хорошо проводят электрический ток; это обусловлено наличием

в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля.
Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Слайд 6
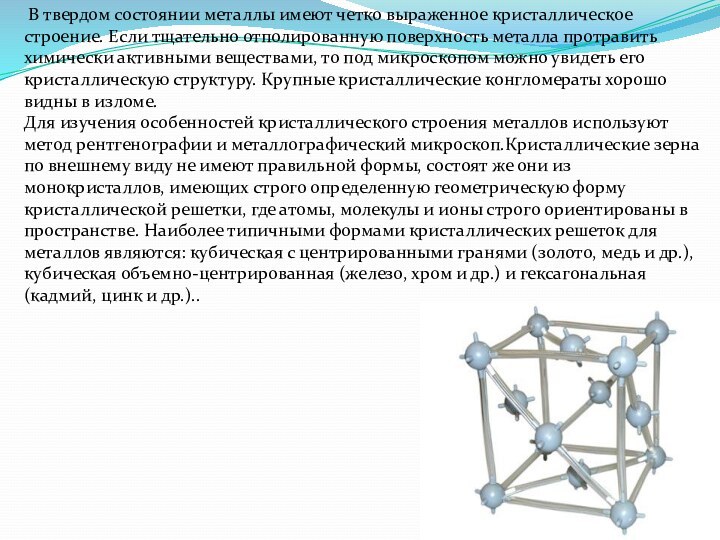
В твердом состоянии металлы имеют четко выраженное кристаллическое
строение. Если тщательно отполированную поверхность металла протравить химически активными
веществами, то под микроскопом можно увидеть его кристаллическую структуру. Крупные кристаллические конгломераты хорошо видны в изломе.
Для изучения особенностей кристаллического строения металлов используют метод рентгенографии и металлографический микроскоп.Кристаллические зерна по внешнему виду не имеют правильной формы, состоят же они из монокристаллов, имеющих строго определенную геометрическую форму кристаллической решетки, где атомы, молекулы и ионы строго ориентированы в пространстве. Наиболее типичными формами кристаллических решеток для металлов являются: кубическая с центрированными гранями (золото, медь и др.), кубическая объемно-центрированная (железо, хром и др.) и гексагональная (кадмий, цинк и др.)..
Слайд 7
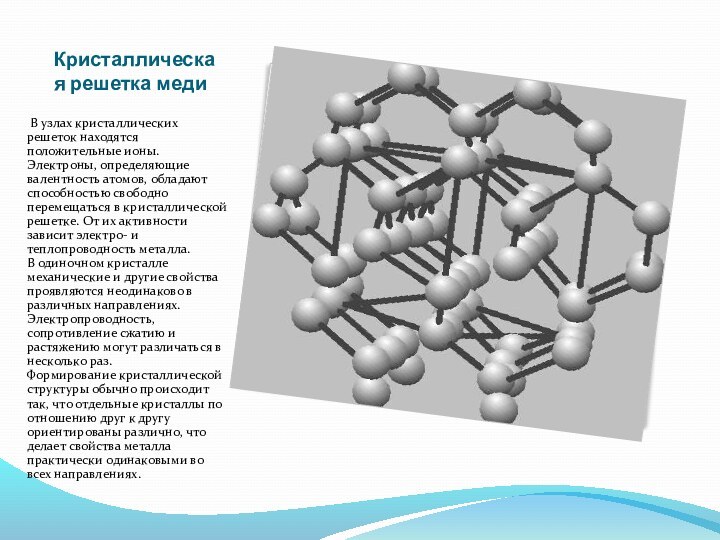
Кристаллическая решетка меди
В узлах кристаллических решеток находятся положительные
ионы. Электроны, определяющие валентность атомов, обладают способностью свободно перемещаться
в кристаллической решетке. От их активности зависит электро- и теплопроводность металла.
В одиночном кристалле механические и другие свойства проявляются неодинаково в различных направлениях. Электропроводность, сопротивление сжатию и растяжению могут различаться в несколько раз.
Формирование кристаллической структуры обычно происходит так, что отдельные кристаллы по отношению друг к другу ориентированы различно, что делает свойства металла практически одинаковыми во всех направлениях.
Слайд 8
Общие сведения
Все металлы обладают рядом свойств: специфическим блеском,
хорошей электро-и теплопроводностью, способностью давать основные окислы и т.
д.
Химические свойства металлов определяются активностью подвижных электронов, непрочно связанных с атомами.
В природе металлы встречаются в виде химических соединений (руд), и только небольшая группа металлов, устойчивых к коррозии (золото, платина),— в виде самородков.
Слайд 10
БЛАГОРО́ДНЫЕ МЕТА́ЛЛЫ, наиболее химически стойкие металлы: золото Au, серебро Ag, платина Pt и металлы

платиновой группы (рутений Ru, родий Rh,палладий Pd, осмий Os, иридий Ir), сопутствующие ей в
природе. Благородные металлы получили свое название главным образом благодаря своим свойствам и красивому внешнему виду в изделиях. Золото, серебро и платина на воздухе практически не окисляются, даже при плавлении. На воздухе золото покрывается тончайшим адсорбционным слоем кислорода.
Золото, серебро и платина обладают высокой пластичностью, а металлы платиновой группы – тугоплавкостью (Тпл 1800оС и выше). Все эти металлы имеют высокий удельный вес, не имеют аллотропных превращений (кроме Rh и Os). Благородные металлы и сплавы на их основе обладают химической стойкостью, в том числе и при повышенных температурах. Благородные металлы при сплавлении друг с другом образуют твердые растворы.
В природе благородные металлы встречаются в виде самородков и в различных рудах. В результате металлургической, химической и электролитической переработки получают благородные металлы очень высокой чистоты. Для извлечения благородных металлов используют методы гидрометаллургии, часто комбинируемые с обогащением. Гравитационное обогащение благородных металлов позволяет выделять крупные частицы металла. Его дополняют цианирование и амальгамация. Для получения металлов высокой чистоты используют аффинаж.
Слайд 11
В ортопедической практике применяются сплавы золота 900 и
750 пробы :
900 проба , состав: 90%
золота
6% меди
4% серебра. Применяется для изготовления искусственных коронок и зубов.
750 проба , состав: 75%золота
8%серебра
9%платина
8%меди.Применяется для изготовления каркасов бюгельных протезов, штифтов, крампонов, вкладок, проволки.
Слайд 12
На свойствах сплава, его "поведении" на этапах изготовления

протеза и при пользовании последним сказывается качество проведения технологического
процесса. Свойства неблагородных конструкционных сплавов в большей степени зависят от вида, процентного содержания элементов, входящих в сплав. Вещества, которые добавляются для исправления тех или иных свойств сплава в нужном направлении, называются легирующими, а сам сплав - легированным. В первую очередь характеристику того или иного конструкционного материала данной группы определяют следующие материалы: железо, хром, никель, кобальт, молибден, марганец. Железо: металл синевато-серебристого цвета. Плотность-7,86. Температура плавления - 1535°С. Твердость по Бринеллю - 65 кгс/мм2. Мягкий, пластичный материал. Химически очень активный, может вступать в химические соединения с углеродом. Сплав железа, содержащий от 4,5 до 1,7% углерода, называется чугуном: содержащий от 1,7 до 0,1% - сталью. В виде оксидов железо применяется для изготовления полировочных паст. Хром:белый с синеватым опенком металл. Плотность -7,2. температура плавления - 1°10"С. Твердость по Бринеллю - 450. Хром обладает твердостью, равной твердости корунда, а последний уступает по твердости лишь алмазу. Хром имеет малую усадку. В полости рта не изменяется. В чистом виде применяется для хромирования инструментов. Входит в состав нержавеющей хромоникелевой стали и кобальтохромовых сплавов (КХС). Придает им устойчивость к коррозии и твердость. Например, для того, чтобы сталь стала нержавеющей, требуется 11-13% хрома. Для полной гарантии его вводят, как правило, 18%. Отрицательные качества хрома, в том числе чрезмерную твердость, исправляют другими металлами. В виде оксидов хром применяется для приготовления полировочных паст.
Слайд 13
Молибден. Светлосерый металл. Плотность - 10,2. Температура плавления
- 2620"С (самая высокая из всех металлов, применяемых для
зуботехнических целей). Твердость по Бринеллю - 155. На воздухе, в щелочах и некоторых кислотах устойчив против окисления. Растворяется в азотной кислоте и царской водке. Входит в состав КХС и подобных ему сплавов, улучшая их межкристаллитную структуру.
Марганец. Серебристо-белый металл. Плотность 2,3. Температура плавления - 1215°С. При комнатной температуре, на воздухе, не окисляется. При нагревании реагирует с кислородом, углеводом, азотом, серой. Легко растворим в соляной и разбавленной серной кислотах. Введенный в сплав, уменьшает содержание в нем серы, раскисляет сплав и повышает ею износостойкость.
Слайд 14
Сплавы , их виды.
Сплав — макроскопически

однородный металлический материал, состоящий из смеси двух или большего числа химических элементов с
преобладанием металлических компонентов. Для зуботехнических целей необходимы металлы, обладающие самыми разнообразными свойствами. Так, основные металлы должны обладать высокими физико-механическими свойствами, устойчивостью к коррозии, некоторые вспомогательные — низкой температурой плавления. Все металлы по своим свойствам должны соответствовать требованиям технологии: обладать нужной температурой плавления, быть ковкими или, наоборот, упругими, иметь допустимую усадку, коэффициент термического расширения и т. д. Этим требованиям в большей степени отвечают различные сплавы. Создание сплавов возможно потому, что многие металлы способны к взаимному растворению или к образованию химических соединений, другие — к образованию смесей.
Подбирая различные металлы в нужных соотношениях, можно получить сплавы с необходимыми свойствами, нередко существенно отличающимися от свойств каждого из компонентов.
Слайд 15
Все сплавы металлов разделены на следующие группы:
1. Сплавы благородных

металлов на основе золота.
2. Сплавы благородных металлов, содержащих 25-50%
золота или платины или других драгоценных металлов.
3. Сплавы неблагородных металлов.
4. Сплавы для металлокерамических конструкций:
а) с высоким содержанием золота (>75%);
б) с высоким содержанием благородных металлов (золота и платины или золота и палладия — > 75%);
в) на основе палладия (более 50%);
г) на основе неблагородных металлов:
— кобальта (+ хром > 25%, молибден > 2%); химический состав: кобальт - 66%, хром - 28%, молибден - 5%, марганец, кремний, углерод - остальное.
— никеля (+ хром > 11%, молибден > 2%).состав: 77% Ni, 12% Сг и 3,5% Мо.
Более упрощенно выглядит классическое подразделение на благородные и неблагородные сплавы. Кроме того, применяемые в ортопедической стоматологии сплавы можно классифицировать по другим признакам:
— по назначению (для съемных, металлокерамических, металло-полимерных протезов);
— по количеству компонентов сплава;
— по физической природе компонентов сплава;
— по температуре плавления;
— по технологии переработки и т. д.
Слайд 16
Обобщая изложенное выше о металлах и сплавах металлов,
нужно еще раз подчеркнуть основные общие требования, предъявляемые к
сплавам металлов, применяемым в клинике ортопедигеской стоматологии:
1) биологическая индифферентность и антикоррозионная стойкость к воздействию кислот и щелочей в небольших концентрациях;
2) высокие механические свойства (пластичность, упругость, твердость, высокое сопротивление износу и др.);
3) наличие набора определенных физических (невысокой температуры плавления, минимальной усадки, небольшой плотности и т. д.) и технологических свойств (ковкости, текучести при литье и др.), обусловленных конкретным назначением
сплавы
На основе благородных металлов
На основе неблагородных
металлов
— золотые;
— золото-палладиевые;
— серебряно-палладиевые.
Сплавы металлов благородных групп имеют лучшие литейные свойства и коррозионную стойкость, однако по прочности уступают сплавам неблагородных металлов.
— хромоникелевую (нержавеющую) сталь;
— кобальтохромовый сплав;
— никелехромовый сплав;
— кобальтохромомолибденовый сплав;
— сплавы титана;
— вспомогательные сплавы алюминия и бронзы для временного пользования. Кроме того, применяется сплав на основе свинца и олова, отличающийся легкоплавкостью.
Слайд 19
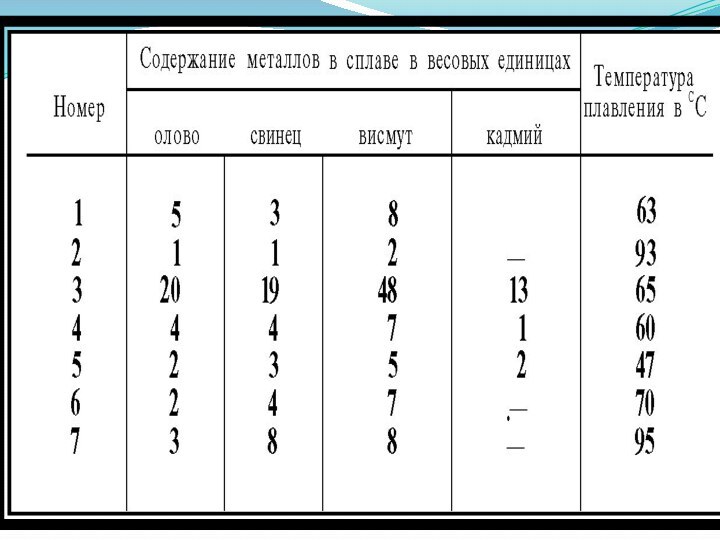
Механические смеси. Такой вид сплава возникает в случае соединения

взаимно не растворимых металлов. Примером такой смеси может быть
сплав свинца, висмута и кадмия. Каждый компонент сплава сохраняет свою кристаллическую решетку, и свойства его в основном определяются соотношением составных частей. Непрочные связи компонентов делают такие сплавы легкоплавкими, однако достаточно твердыми. Эти качества имеют вспомогательные легкоплавкие сплавы, используемые в технике.
Химические соединения могут возникать между металлами и металлом с металлоидом. Типы таких соединений разнообразны. Примером могут быть карбиды железа и хрома (Fe3C и Cr3C2), возникающие в нержавеющей стали . на технологических этапах. Некоторые химические соединения металлов (Mg2S) отличаются твердостью и хрупкостью. Характерно, что такой тип химических соединений является по своему составу непостоянным.
В металлургии и практике зуботехнических лабораторий существуют различные приемы, позволяющие управлять процессами соединения металлов для получения необходимых свойств.
Слайд 20
Твердый раствор. Кристаллическая структура сплавов этой группы представляет собой

решетку основного металла, в которой размещены атомы растворенного металла.
Элементы таких сплавов способны к взаимному растворению как в жидком, так и в твердом состоянии. Примерами такого типа соединений являются широко применяемые в ортопедической стоматологии сплавы на основе золота, хромоникелевые, хромокобальтовые, железоуглеродистые сплавы.
При затвердевании металла слиток может приобрести различную структуру, которая характеризуется большей или меньшей неоднородностью, что зависит от состава сплава, скорости охлаждёния и ряда других факторов.
Возникновение неоднородности связано с особенностями процесса кристаллизации сплава, компоненты которого имеют разные точки плавления. При охлаждении сплава первыми начинают выпадать кристаллы тугоплавкого компонента, и далее в зависимости от скорости понижения температуры формирование структуры кристаллов будет происходить более однородно при медленном и неоднородно при быстром охлаждении. Явление неоднородности структуры отдельных кристаллов называется внутрикристаллической ликвацией.
Неоднородная структура сплава, обусловленная внутрикристаллической ликвацией, ухудшает его эластические свойства. Так, сплав золота с платиной может оказаться хрупким и непригодным для зуботехнических целей вследствие внутрикристаллической ликвации, возникшей при недостаточном растворении платины в золоте.


















![Рекомендации для родителей в логопедический уголок. Звук [Ц]. методическая разработка](/img/tmb/9/831134/6cadfc56f1e7be6450e5812f98e91eeb-210x.jpg)