Слайд 2
Статистический прогноз (статья 2008г )
Согласно
расчетам специалистов Всемирной организации здравоохранения, через два года онкологические
заболевания вырвутся в безусловные лидеры в списке главных причин смерти жителей нашей планеты. K 2010 году рак потеснит такие распространенные причины смертности, как сердечнососудистые заболевания, СПИД, малярию и туберкулёз.
Согласно опубликованным данным, через два года общее количество онкологических больных во всем мире приблизится к отметке в 27 миллионов человек, а уже к 2030 году ежегодно рак будет забирать жизни приблизительно 17 миллионов человек.
Слайд 3
До тех пор, пока не будет найдено

лекарство от рака, лучшим методом борьбы с ним будет
оставаться его Профилактика.
Виды профилактики:
Первичная профилактика - предупреждение возникновения злокачественных опухолей и предшествующих им предопухолевых состояний путем устранения или нейтрализации воздействий неблагоприятных факторов окружающей среды и образа жизни, а также путем повышения неспецифической резистентности организма.
Онкогигиеническая профилактика, т.е. выявление и устранение возможности действия на человека канцерогенных факторов окружающей среды, а также выявление и использование возможностей уменьшения опасностей такого воздействия - Контроль курения, употребления алкоголя, защита от ионизирующих излучений, УФ облучения и ЭМ излучения бытовой техники, защита от стрессов и диеты.
Биохимическая профилактика имеет целью предотвращение бластоматозного эффекта от действия канцерогенов путем применения определенных химических препаратов и соединений.
Теоретически эффективность мероприятий по онкогигиенической и биохимической профилактике оцениваются снижением онкологической заболеваемости на 70-80%, так как по данным Международного агенства изучения рака (Лион, Франция) 80-90% злокачественных новообразований детерминировано средовыми факторами.
Слайд 4
Медико-генетическая профилактика путем выделения семей с наследуемыми предрасположенностями
к предопухолевым и опухолевым заболеваниям, лиц с хромосомной нестабильностью
и организации мероприятий по снижению опасности возможного действия на них канцерогенных факторов.
Иммунобиологическая профилактика проводится путем выделения людей или формирования групп с иммунологической недостаточностью и организации мероприятий по ее коррекции или устранении одновременно с защитой от возможных канцерогенных воздействий.
Эндокринно-возрастная профилактика проводится путем выявления и коррекции дисгормональных состояний и возрастных нарушений гомеостаза, способствующих возникновению и развитию злокачественных новообразований.
Теоретическая эффективность каждого из этих направлений оценивается снижением онкологической заболеваемости на 10%.
Слайд 5
Вторичная профилактика злокачественных новообразований представляет собой комплекс мероприятий,

направленных на выявление предопухолевых заболеваний и состояний, а также
раннюю диагностику онкологических заболеваний, что обеспечивает наиболее высокую эффективность их хирургического (и других видов противоопухолевого) лечения.
В индивидуальной профилактике сохраняет свое большое значение диспансеризация, при проведении которой всеми врачами-специалистами должна проявляться онкологическая настороженность, т.е. исключение бластоматозной природы заболевания и опухолевых процессов обследуемой области, включая при необходимости и применение специальных методов исследования. Такой образ действия в процессе диспансеризации в достаточной степени обеспечивает своевременное выявление ранних стадий онкологических заболеваний и лиц с повышенным риском их возникновения, что позволяет формировать группы риска. Лица, отнесенные к этим группам, должны подвергаться специальным методам исследования - такие группы, помимо определенных соответствующими положениями, встречаются также страдающие некоторыми формами анемии, зобом, ожирением II-III ст., хроническими заболеваниями легких и желудочно-кишечного тракта, прежде всего воспалительной природы, в возрасте старше 40 лет. В эти группы включаются курильщики и страдающие алкогольной зависимостью, лица имеющие кровных родственников больных или болевших онкологическими заболеваниями, прежде всего раком легкого, раком желудка, толстой и прямой кишки, раком молочной железы и др. В группы риска должны включаться также лица, у которых обнаружена триада: гипертоническая болезнь, диабет, ожирение.
Слайд 6
Канцерогенные факторы
Химические факторы
Вещества ароматической природы (полициклические и гетероциклические

ароматические углеводороды, ароматические амины), некоторые металлы и пластмассы обладают
выраженным канцерогенным свойством благодаря их способности реагировать с ДНК клеток, нарушая ее структуру (мутагенная активность). Канцерогенные вещества в больших количествах содержатся в продуктах горения автомобильного и авиационного топлива, в табачных смолах. При длительном контакте организма человека с этими веществами могут возникнуть такие заболевания, как рак легкого, рак толстого кишечника и др. Известны также эндогенные химические канцерогены (ароматические производные аминокислоты триптофана), вызывающие гормонально зависящие опухоли половых органов.
Физические факторы
Солнечная радиация (в первую очередь ультрафиолетовое излучение) и ионизирующее излучение также обладает высокой мутагенной активностью. Так, после аварии Чернобыльской АЭС отмечено резкое увеличение заболеваемости раком щитовидной железы у людей, проживающих в зараженной зоне. Длительное механическое или термическое раздражение тканей также является фактором повышенного риска возникновения опухолей слизистых оболочек и кожи (рак слизистой рта, рак кожи, рак пищевода).
Биологические факторы
Доказана канцерогенная активность вируса папиломы человека в развитии рака шейки матки [2], вируса гепатита В в развитии рака печени, ВИЧ — в развитии саркомы Капоши. Попадая в организм человека, вирусы активно взаимодействуют с его ДНК, что в некоторых случаях вызывает трансформацию собственных протоонкогенов человека в онкогены. Геном некоторых вирусов (ретровирусы) содержит высоко активные онкогены, активирующиеся после включения ДНК вируса в ДНК клеток человека.
Слайд 7
Теория четырёхстадийного канцерогенеза
Материальным субстратом опухолевой трансформации клеток являются

различного типа повреждения генетического аппарата клетки ,вызывающие превращение протоонкогенов
в онкогены или резко повышающие уровень их экспрессии. Повреждение генетического материала клетки происходит под воздействием внешних и внутренних канцерогенных факторов, рассмотренных выше. Первичное воздействие канцерогенного фактора на клетку носит название «инициации» и заключается в возникновении потенциально трансформирующего изменения клеточных онкогенов, а также несанкционированном выключении генов-супрессоров или генов, вызывающих апоптоз и активизации генов, препятствующих апоптозу. Внутриклеточные сигнальные каскады устроены таким образом, что нарушение лишь одного из их звеньев вызовет апоптоз клетки, а не её бесконтрольное деление, поэтому для успешного канцерогенеза необходимы изменения многих звеньев, максимально имитирующие влияние цитокинов и устраняющие возможность гибели клетки. Это первая стадия канцерогенеза.
Однако для осуществления опухолевой трансформации клетки — «промоции» — необходимо повторное воздействие на клетку или канцерогенного фактора (того же, что вызвал инициацию, или другого), или фактора, не являющегося канцерогеном, но способного вызвать активизацию изменённых онкогенов - промотора. Промоция - вторая стадия канцерогенеза.
Образование опухолей вследствие воздействия онкогенных ретровирусов, привносящих в клетку активный онкоген, эквивалентно осуществлению первых двух стадий канцерогенеза - в этом случае инициация имела место в других клетках иного организма, где изменённый онкоген был захвачен в геном ретровируса.
Слайд 8
Появление несанкционированных сигналов является хотя и необходимым, но

не достаточным условием образования опухоли. Опухолевый рост становится возможным
лишь после осуществления ещё одной, третьей стадии канцерогенеза – уклонения трансформированных клеток от дальнейшей дифференцировки, которое обычно вызывается несанкционированной активностью генов некоторых клеточных микроРНК. Последние препятствуют функционированию белков, отвечающих за протекание специализации клеток; известно, что не менее 50% опухолей ассоциированы с теми или иными повреждениями в участках генома, которые содержат гены микроРНК. Прекращение дифференцировки возможно также из-за отсутствия цитокинов, необходимых для перехода созревающих клеток на следующий этап специализации (в этом случае присутствие цитокина может вызвать нормализацию и продолжение дифференцировки раковых клеток - процесс, обратный канцерогенезу). Созревание трансформированных клеток приостанавливается, и они – в результате непрерывной пролиферации и подавления апоптоза – накапливаются, формируя опухоль - клон клеток, обладающих рядом особенностей, не свойственных нормальным клеткам организма
В ходе развития опухоли, в силу её генетической нестабильности, происходит частое изменение ее клеточного состава и смена стволовой линии Такая стратегия роста имеет адаптативный характер, так как выживают только наиболее приспособленные клетки. Мембраны опухолевых клеток не способны реагировать на стимулы микроокружения (межклеточная среда, кровь, лимфа), что приводит к нарушению морфологических характеристик ткани (клеточный и тканевой атипизм). Сформировавшийся опухолевый клон (стволовая линия) синтезирует собственные цитокины и идёт по пути наращивания темпов деления, предотвращения истощения теломер, уклонения от иммунного надзора организма и обеспечения интенсивного кровоснабжения. Это четвёртая, заключительная стадия канцерогенеза - опухолевая прогрессия. Её биологический смысл заключается в окончательном преодолении препятствий на пути опухолевой экспансии. Опухолевая прогрессия носит скачкообразный характер и зависит от появления новой стволовой линии опухолевых клеток. Прорастая в кровеносные и лимфатические сосуды опухолевые клетки разносятся по всему организму и, оседая в капиллярах различных органов, формируют вторичные (метастатические) очаги опухолевого роста.
Слайд 9
Иммунологические особенности онкологических процессов
Существует мнение что в организме
человека постоянно образуются потенциальные опухолевые клетки. Однако в силу
своей антигенной гетерогенности они быстро распознаются и разрушаются клетками иммунной системы. Таким образом нормальное функционирование иммунной системы является основным фактором натуральной защиты от опухолей. Этот факт доказан клиническими наблюдениями за больными с ослабленной иммунной системой, у которых опухоли встречаются в десятки раз чаще чем у людей с нормально работающей иммунной системой. Иммунный механизм сопротивляемости опухолям опосредован большим количеством специфических клеток (В- и Т-лимфоциты, NK-клетки, моноциты, полиморфо-ядерные лейкоциты) и гуморальных механизмов. В процессе опухолевой прогрессии клетки опухоли оказывают выраженное антииммунное действие, что приводит к ускорению темпов роста опухоли и появлению метастазов.
Слайд 10
Защита организма от опухоли. Антиканцерогенные механизмы.
Воздействие на организм
канцерогенных агентов, активация онкогенов и даже образование опухолевой клетки
далеко не всегда приводят к формированию опухоли. Это возможно лишь при наличии важного условия — снижения эффективности механизмов противоопухолевой защиты, обеспечивающих антибластомную резистентность организма.
Антибластомная резистентность — свойство организма препятствовать проникновению канцерогенных агентов в клетку, её ядро и/или их действию на геном; обнаруживать и устранять онкогены или подавлять их экспрессию; обнаруживать и разрушать опухолевые клетки, тормозить их рост.
Различают антиканцерогенные, антимутационные и антицеллюлярные механизмы противоопухолевой защиты.
Слайд 11
Антиканцерогенные механизмы обеспечивают торможение и/или блокаду проникновения канцерогенов
в клетку, её ядро, действие их на геном и
инактивацию и элиминацию бластомогенных агентов из клетки и организма.
Слайд 12
• Механизмы, препятствующие действию химических канцерогенных факторов
-
Физико-химическая фиксация (например, глюкуронизация, сульфатирование) и удаление из организма
(с мочой, экскрементами, слюной, жёлчью, потом).
- Поглощение канцерогенов в процессе фагоцитоза, сочетающееся с их инактивацией и разрушением.
- Инактивация бластомогенных агентов как гаптенов при помощи AT и Т-лимфоцитов с последующей их деструкцией и элиминацей из организма.
- Конкурентная блокада неканцерогенными метаболитами клеточных рецепторов, с которыми способны взаимодействовать истинные бласто-могенные вещества.
- Разрушение и/или инактивация канцерогенов в клетках и биологических жидкостях в процессе их окисления, восстановления, деметилиро-вания, глюкуронизации, сульфатирования.
- Ингибирование («гашение») свободных радикалов и гидроперекисей органических и неорганических соединений ферментативными и неферментными факторами антиоксидантной защиты.
Слайд 13
• Механизмы, препятствующие действию онкогенных вирусов
- Инактивация

вирусов Ig, образуемыми плазматическими клетками под влиянием антигенных вирусных
белков. Ig взаимодействуют с вирусом и препятствуют его контакту с рецепторами мембран клеток. Это предотвращает проникновение нуклеиновой кислоты вируса в ядро клетки (трансфекцию) и её опухолевую трансформацию.
- Ингибирование ИФН — белками, тормозящими или блокирующими процесс внутриклеточной репликации вирусов.
- Обнаружение и разрушение вируссодержащих клеток организма неспецифическими цитолитическими клетками. Такой способностью обладают естественные киллеры, цитотоксические Т-лимфоциты, мононук-леарные фагоциты.
• Механизмы, препятствующие действию канцерогенов физической природы
- Улавливание и/или инактивация свободных радикалов кислорода, липидов, других органических и неорганических веществ.
Такими свойствами обладают:
- СОД, катализирующая реакцию взаимодействия радикалов 02 при участии Н+ с образованием Н202.
- Неферментные «гасители» радикалов, например токоферолы, соединения глутатиона.
- Разрушение перекисей и гидроперекисей различных веществ (кислорода, липидов, белков). К эндогенным антиперекисным агентам относятся каталазы, глутатионпероксидазы, глутатионредуктаза.
Слайд 14
Классификация опухолей
Существует множество критериев классификации опухолей. Объединяя гистологические

(тканевая принадлежность опухоли), клинические (течение заболевания) и патоморфологические (структура
опухолевой ткани) признаки, опухоли можно разделить на две большие группы.
Злокачественные опухоли. возникают в результате злокачественной трансформации (малигнизации) нормальных клеток, которые начинают бесконтрольно размножаться, теряя способность к апоптозу. Злокачественная трансформация вызывается одной или несколькими мутациями, заставляющими клетки неограниченно делиться и нарушающими механизмы апоптоза. Если иммунная система организма не распознаёт вовремя такую трансформацию, опухоль начинает разрастаться, и со временем метастазирует. Метастазы могут образовываться во всех без исключения органах и тканях. Наиболее часто метастазы образуются в костях, печени, мозгу и надпочечниках.
Доброкачественные опухоли. отличаются тем, что не образуют метастазов, не вторгаются в другие ткани и потому редко опасны для жизни. Однако доброкачественные опухоли часто превращаются в злокачественные (перерождение опухоли).
Слайд 15
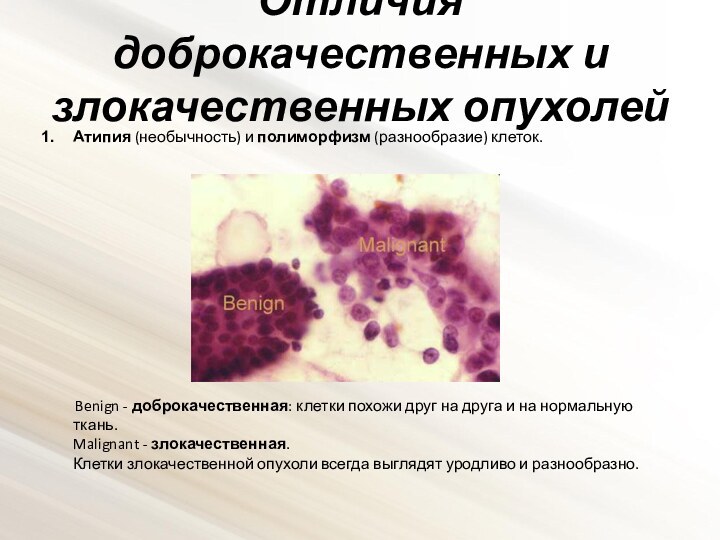
Отличия доброкачественных и злокачественных опухолей
Атипия (необычность) и полиморфизм
(разнообразие) клеток.
Benign - доброкачественная:
клетки похожи друг на друга и на нормальную ткань.
Malignant - злокачественная.
Клетки злокачественной опухоли всегда выглядят уродливо и разнообразно.
Слайд 16
2. Характер роста.
Доброкачественные опухоли имеют экспансивный рост: опухоль
медленно увеличивается и раздвигает окружающие ткани и органы.
Рост злокачественных
опухолей называется инфильтрирующим: опухоль растет быстро и при этом пронизывает (инфильтрирует) окружающие ткани, прорастая в кровеносные сосуды и нервы. Действия и вид опухоли на вскрытии похожи на клешни рака, отсюда и произошло название «рак».
Слайд 17
3. Метастазирование.
Метастазы – это очаги отсева опухоли, метастазирование

- сам процесс образования метастазов. В результате роста опухоли
ее отдельные клетки могут отрываться, попадать в кровь, лимфу и переноситься в другие ткани. Там они вызывают рост вторичной (дочерней) опухоли. По структуре метастазы обычно не отличаются от родительской опухоли.
Метастазируют только злокачественные опухоли. Доброкачественные опухоли метастазов не дают.
Основные пути метастазирования:
Лимфогенный (с лимфой по лимфатическим сосудам). Самый частый способ. Лимфоузлы являются барьером для всего чужеродного организму: инфекции, опухолевых (измененных) клеток, инородных частиц. Попадая в местные (регионарные) лимфоузлы, большинство опухолевых клеток там задерживается и постепенно уничтожается макрофагами (это разновидность лейкоцитов). Если же клеток очень много, лимфоузлы не справляются.
Гематогенный (с кровью). Опухолевые клетки попадают в капилляры и вены. Каждая опухоль имеет «склонность» распространяться тем или иным способом, но есть опухоли, для которых «все средства хороши». Например, злокачественные опухоли костей (саркомы костей) часто метастазируют в легкие; рак кишечника – в печень.
Имплантационный (по серозной оболочке). Злокачественные опухоли могут прорасти все стенки органа и попасть в брюшную или грудную полость, которые изнутри выстланы серозной оболочкой. По серозной облочке клетки опухоли могут мигрировать (перемещаться). Например, бывает имплантационный метастаз в Дугласово пространство (между прямой кишкой и маткой у женщин) при раке желудка.
Пути метастазирования опухолевых клеток
Слайд 18
4. Рецидивирование.
Рецидив опухоли – повторное развитие опухоли
в той же области тела после ее полного удаления
или уничтожения. Рецидивируют только злокачественные опухоли и те доброкачественные опухоли, у которых есть «ножка» (основание). Даже если хирург полностью удалил злокачественную опухоль, в области операции остаются отдельные опухолевые клетки, способные дать повторный рост новообразования. Если же опухоль была удалена не полностью, ее повторный рост не считается рецидивом. Это проявление прогрессирования патологическогог процесса.
Слайд 19
Общее влияние на больного. Доброкачественные опухоли проявляются местно:
причиняют неудобство, сдавливают нервы, сосуды и окружающие органы. От
доброкачественных опухолей умирают в исключительных случаях:
-Медленное сдавление головного мозга с жизненно важными центрами
-Опухоли эндокринных органов
Злокачественные опухоли вызывают раковую интоксикацию (интоксикация – отравление, от слова токсин – яд), вплоть до раковой кахексии (кахексия - истощение).
Клетки злокачественного новообразования быстро делятся и растут, они расходуют много питательных веществ (глюкоза, аминокислоты). Естественно, что нормальным тканям не хватает. Больной чувствует слабость, вялость, недомогание, он худеет.
Кроме этого, при быстром росте опухоли кровеносные сосуды в ней не успевают образовываться в нужном количестве. Поэтому из-за недостатка кислорода центр опухоли погибает (это называется некроз, или омертвение). Продукты распада клеток всасываются в кровь и отравляют организм (раковая интоксикация), происходит потеря аппетита, интереса к жизни, больной становится бледным.
Кроме этого, любое (!) повреждение и гибель (некроз) клеток вызывает воспалительную реакцию. Вокруг места некроза развивается воспаление. Из-за этого у тяжелых раковых больных может повышаться температура. C другой стороны, проводимое лечение угнетает иммунную систему, из-за чего онкобольные больше подвержены разным инфекциям.
Слайд 20
Клиническая классификация опухолей
Выделяют

4 стадии онкозаболевания:
1-я стадия: опухоль небольшая, занимает ограниченный
участок, не прорастает стенку органа, нет метастазов.
2-я стадия: опухоль больших размеров, не распространяется за пределы органа, возможны одиночные метастазы в регионарные лимфатические узлы.
3-я стадия: опухоль больших размеров, с распадом, прорастает всю стенку органа или опухоль меньших размеров со множественными метастазами в регионарные лимфатические узлы.
4-я стадия: прорастание опухоли в окружающие ткани, в том числе неудалимые (аорта, полая вена и др.) или любая опухоль с отдаленными метастазами.
От стадии зависит возможность излечения злокачественной опухоли: чем выше стадия, тем меньше шансов вылечиться. Вот поэтому надо выявлять злокачественную опухоль как можно раньше, а для этого не бояться идти обследоваться, особенно при наличии подозрений.
Относительная 10-летняя выживаемость больных раком
молочной железы в зависимости от стадии онкозаболевания.