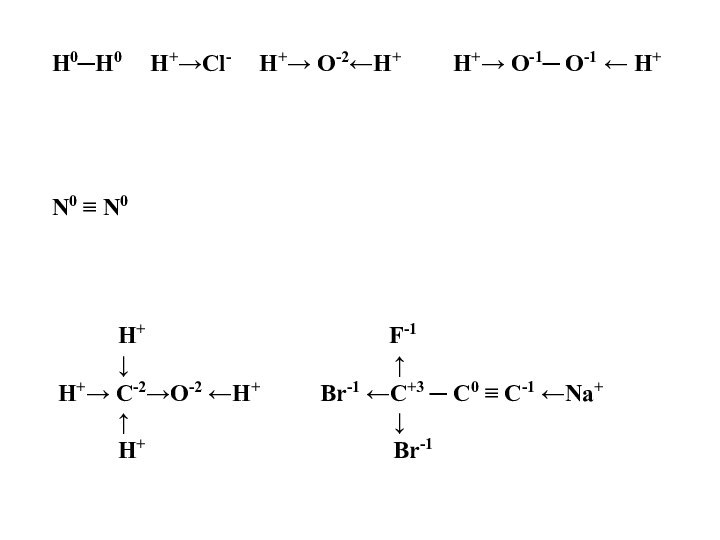
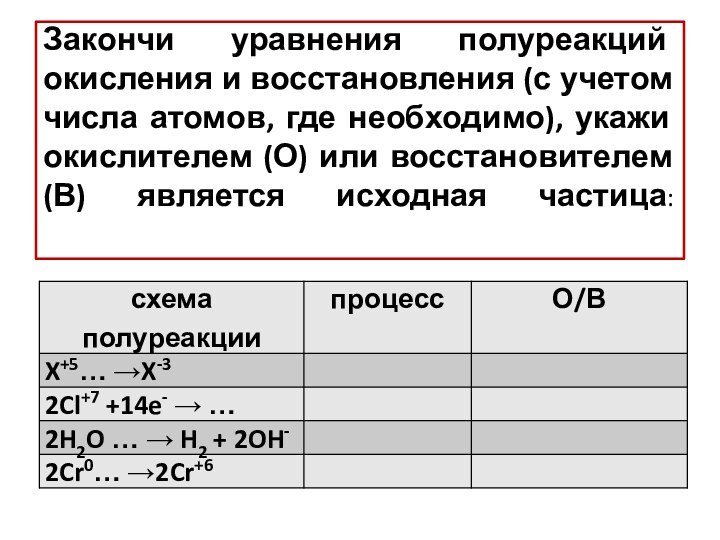
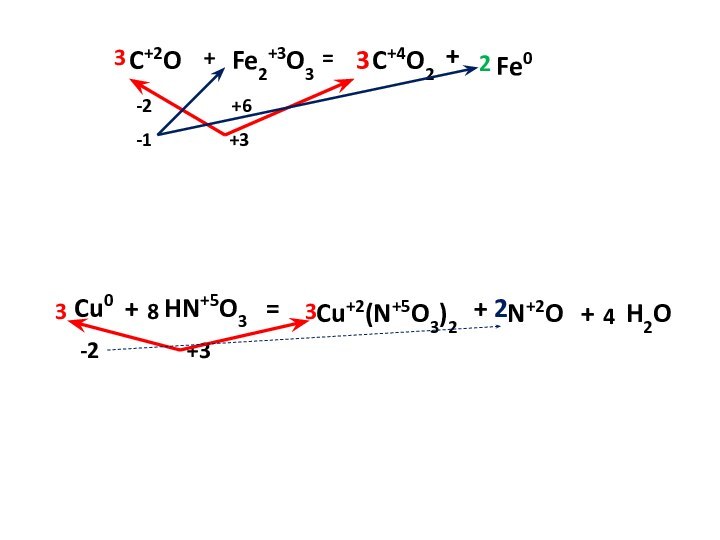
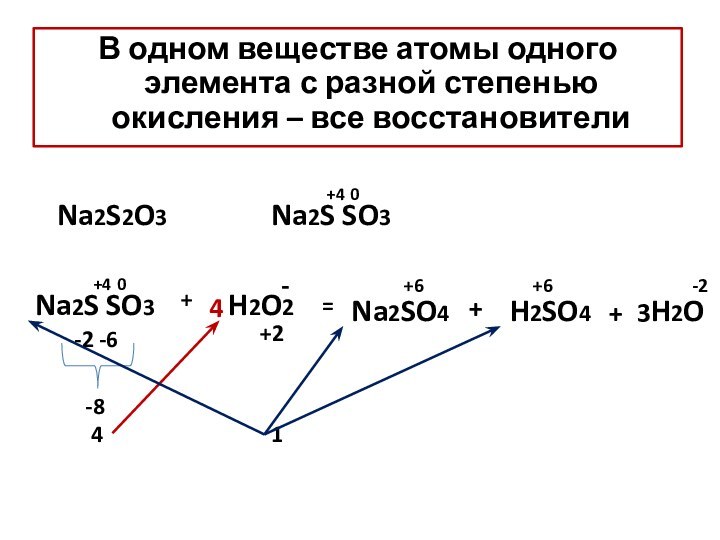
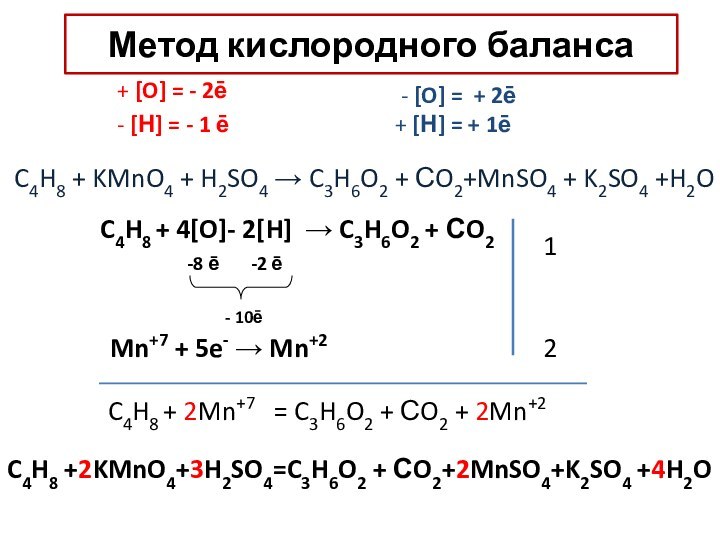
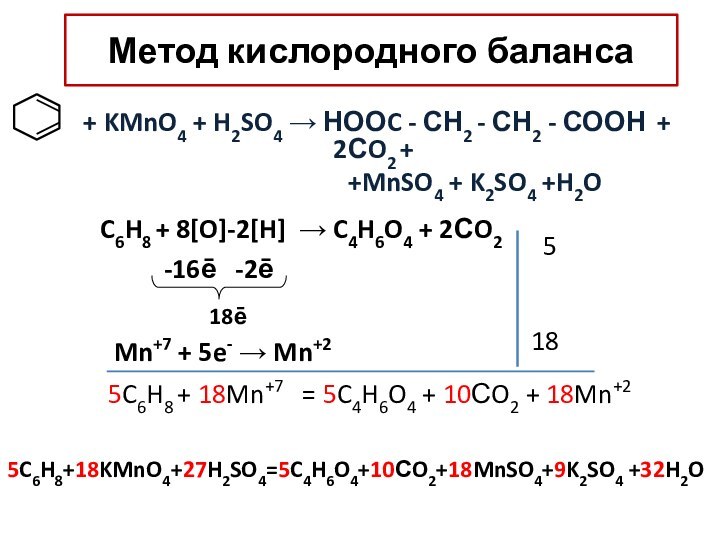
– условный заряд атома, вычисленный из предположения, что все
связи атома ионныеПользуясь значениями ЭО, обозначь стрелкой направление смещения электронной плотности и рассчитай степени окисления атомов:
H─H H ─ Cl H ─ O ─ H H ─ O─ O ─ H N ≡ N
H F
│ │
H ─ C ─ O ─ H Br ─ C ─ C ≡ C ─ Na
│ │
H Br