Слайд 2
Одна из основных задач формирования Национальной лекарственной политики
по рекомендациям ВООЗ – обеспечение населения качественными и эффективными
лекарственными средствами.
К достижению этой цели следует подходить комплексно путем :
совершенствования контроля за рациональным использованием ЛС;
создания национальных стандартов качества, гармонизированных с международными;
внедрения Надлежащей производственной практики (GMP);
разработки и соблюдения рекомендаций по стабильности ЛС, их регистрации, правилам международной торговли, борьбе с фальсифицированными ЛС.
Слайд 3
Система обеспечения качества – совокупность организационных мер, принимаемых
в целях обеспечения соответствия качества ЛС их назначению от
разработки, испытания к применению и включают осуществление этих действий в соответствии с Надлежащей лабораторной практикой, Надлежащей клинической практикой, Надлежащей производственной практикой и Надлежащей практикой дистрибуции.
Под Системой понимают сложный административный инструмент, который требует от каждого субъекта, процесса обеспечения фармацевтической помощью населения, соблюдения законодательно принятых норм и требований.
Слайд 4
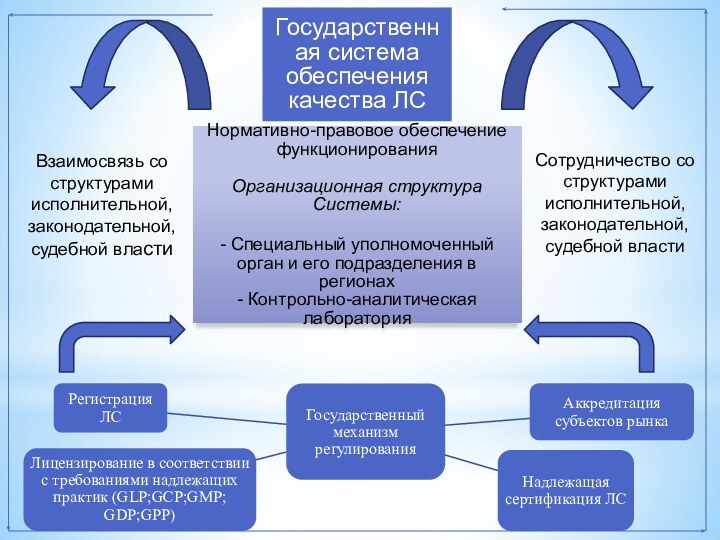
Взаимосвязь со структурами исполнительной, законодательной, судебной власти
Сотрудничество со
структурами исполнительной, законодательной, судебной власти
Слайд 5
Мировой опыт функционирования Систем свидетельствует, что наиболее эффективным
и экономически рациональным путем обеспечения качества ЛС является комплекс
регулярных инспекций и методов аналитического контроля в условиях строгого соблюдения производителями норм GMP.
Поэтому усилия Систем в таких странах, как США, Германия, Великобритания направлены преимущественно на инспектирование производства ЛС, причем большое внимание уделяется предприятиям, находящимся в странах-экспортерах. FDA США имеет около 7000 инспекторов и лишь около 300 сотрудников аналитических лабораторий.
В странах с переходной экономикой Системы находятся в стадии формирования и реорганизации. В частности, они работают в условиях законодательно-нормативной неопределенности, дублирования и несогласованности действий структур и органов, дефицита финансовых и кадровых ресурсов, отсутствия государственной политики в области обеспечения качества ЛС.
Слайд 6
Согласно международному опыту и требованиям ВОЗ национальные Системы
должны функционировать в условиях обеспечения качества ЛС на всех
этапах их жизненного цикла:
Обеспечение качества ЛС на указанных этапах должно обеспечиваться лицензированием в соответствии с правилами и нормами надлежащих практик
Дополнительно вводятся Надлежащая практика закупок (Good Pharmaceutical Procurement Practice – GPPP) и Надлежащая практика хранения (Good Storage Practice – GSP), которые носят рекомендательный характер.
Слайд 7
Центральное место в структуре национальных систем занимает орган,
уполномоченный на осуществление государственного контроля ЛС, который, как правило,
функционирует в структуре Министерства здравоохранения, находится в его непосредственной подчиненности и обладает широкими полномочиями.
Согласно рекомендациям ВОЗ специальный
уполномоченный орган должен иметь следующие составляющие:
административный аппарат с четко определенными правами и обязанностями сотрудников;
инспекторскую службу;
аналитические лаборатории с необходимым финансовым, кадровым, нормативным, техническим и информационным обеспечением
Слайд 8
Централизованная контрольно-разрешительная система в структуре Министерства здравоохранения
Слайд 9
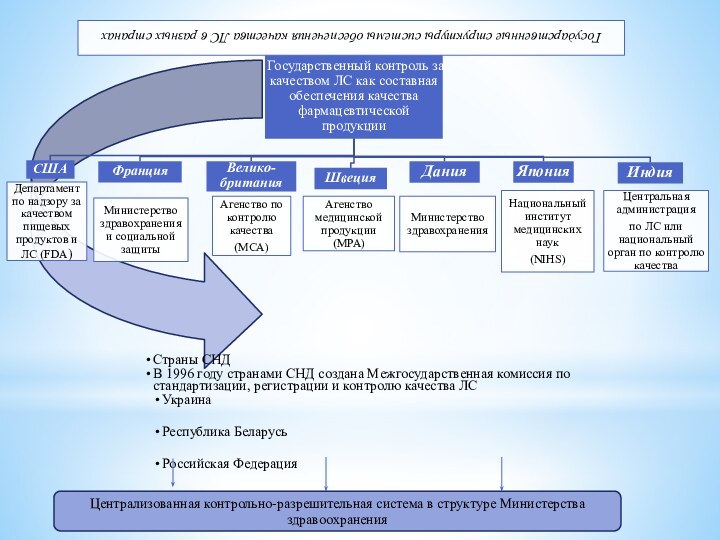
В США Департамент по надзору за качеством пищевых
продуктов и лекарственных средств осуществляет инспектирование фирм-производителей, имеет право
применять штрафные санкции и закрывать производство, не соответствующее установленным требованиям.
Французское Агентство лекарств занимается проблемами импорта-экспорта, сертификации, запретом реализации ЛС тому подобное.
Агентство по контролю качества ЛС в Великобритании осуществляет лицензирование производства, проводит постлицензионный мониторинг и аналитическое тестирование образцов ЛС, изъятых из обращения, а также несет ответственность за информацию о ЛС на фармацевтическом рынке.
Слайд 10
Важный механизм интегрирования национальных систем разных стран –
Европейская Фармакопея, содержащая соответствующие требования и монографии по активным
ингредиентам, вспомогательным средствам, вакцинам и препаратам.
В соответствии с Директивой Совета ЕС 75/318/ЕЕС – при наличии общих монографий по ЛС в Европейской Фармакопее ГЛС должны соответствовать ее требованиям, а при отсутствии этих положений – требованиям национальных фармакопей стран ЕС.
Значительное количество монографий Европейской Фармакопеи воспроизводится в национальных фармакопеях европейских стран, например, Немецкой Фармакопее, Французской Фармакопее, Британской Фармакопее и других. Европейская Фармакопея обязательна для использования в тех странах, которые подписали Конвенцию (Европейская фармакопейная конвенция) и имеет приоритеты в соответствии с национальными фармакопеями.
Слайд 11
Фармакопея – это правовой акт, который имеет законодательный
характер и содержит общие требования к ЛС, фармакопейные статьи
(монографии), а также методики контроля качества ЛС.
Украина также имеет национальную Фармакопею, набравшую силу 1 октября 2001 г. Требования Фармакопеи обязательны для всех предприятий и учреждений Украины независимо от их форм собственности, которые производят, хранят, контролируют и реализуют ЛС.
Государственная фармакопея Украины (ГФУ) – это правовой документ, содержащий общие требования к лекарствам, ФС (монографии), а также методики контроля их качества. ГФУ имеет законодательный характер и гармонизирована с Европейской Фармакопеей.
Слайд 12
Качество ЛС – совокупность свойств, которые придают ЛС
способность удовлетворять потребности потребителей в соответствии со своим назначением
и отвечают требованиям, установленным законодательством.
Оборот фальсифицированных, некачественных (субстандартных) ЛС, или препаратов, не прошедших процедуру государственной регистрации в национальных системах здравоохранения:
во-первых – представляет прямую угрозу здоровью населения, а иногда и жизни людей;
во-вторых, приводит к значительным финансовым убыткам легальных производителей ЛС. То есть, наличие на фармацевтическом рынке фальсифицированных, субстандартных и незарегистрированных ЛС является существенной социально-экономической и медико-фармацевтической проблемой.
Слайд 14
ВОЗ разработала программу помощи национальным системам здравоохранения по
предотвращению оборота фальсифицированных, субстандартных, незарегистрированных ЛС, которая включает:
•
всемирную информационную базу о случаях выявления указанных препаратов;
• практические рекомендации по методам выявления фальсифицированных, субстандартных, незарегистрированных ЛС;
• сеть квалифицированных сотрудников в 110 странах мира, которые работают в специальных органах по обеспечению контроля качества в национальных системах здравоохранения.
Несмотря на активное противодействие обращению фальсифицированных, некачественных, незарегистрированных препаратов со стороны международных организаций и национальных органов, случаи появления их на фармацевтическом рынке постоянно фиксируются.
Слайд 15
Факторы, способствующие обороту указанных препаратов:
отсутствие или несоответствие международным

нормам существующей законодательной базы, регулирующей ввоз, производство, реализацию ЛС;
недостаток
кадровых, финансовых и информационных ресурсов для организации борьбы с оборотом ЛС ненадлежащего качества;
отсутствие или неэффективная деятельность специального органа, который формирует и реализует государственную политику в сфере предотвращения оборота фальсифицированных, субстандартных, незарегистрированных ЛС;
недостаточные или отсутствующие санкции за противоправные действия в сфере фармацевтического обеспечения населения;
несогласованность между различными государственными органами, которые должны предотвращать обращение контрафактной, субстандартной продукции, а также незарегистрированных ЛС;
значительное количество посредников на фармацевтическом рынке, что способствует вмешательству в товаропроводящую цепь нелегальных каналов сбыта ЛС;
высокие цены соответственно к среднему уровню платежеспособности населения, а также большая разница цен на рынке стимулирует разработку более дешевых фальсифицированных ЛС.
Слайд 16
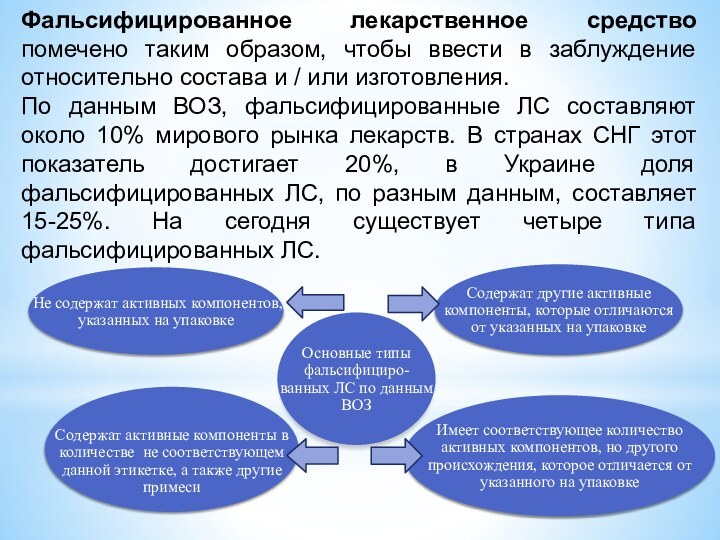
Фальсифицированное лекарственное средство помечено таким образом, чтобы ввести
в заблуждение относительно состава и / или изготовления.
По данным
ВОЗ, фальсифицированные ЛС составляют около 10% мирового рынка лекарств. В странах СНГ этот показатель достигает 20%, в Украине доля фальсифицированных ЛС, по разным данным, составляет 15-25%. На сегодня существует четыре типа фальсифицированных ЛС.
Слайд 17
По данным информационной базы ВОЗ наибольший удельный вес
в структуре фальсифицированных ЛС имеют препараты, не содержащие активного
компонента (I-й тип), далее – контрафактные ЛС, которые имели несоответствующее количество действующих компонентов и незадекларированные активные вещества.
Вред, наносимый пациентам фальсифицированными медикаментами:
риск для здоровья и жизни;
отсутствие лечебного эффекта при употреблении препаратов-подделок, которые не содержат действующих веществ.
Вред, наносимый производителю:
негативное влияние на репутацию;
материальные расходы.
Слайд 18
PIC / S – это международный инструмент взаимодействия
между странами и регуляторными органами в сфере контроля качества
ЛС (национальными фармацевтическими инспекторатами), которые обеспечивают вместе активное и конструктивное сотрудничество в сфере GMP, инспектирования и лицензирования.
К основным преимуществам членства в PIC / S следует отнести:
• укрепление сотрудничества между уполномоченными органами в сфере инспекций и содействие обеспечению их качества;
• обмен информацией и опытом между уполномоченными органами;
• совершенствование и гармонизация стандартов и процедур для инспекций производителей ЛС и контроля ЛС в уполномоченных лабораториях;
• содействие гармонизации требований национальных нормативных требований GMP;
Слайд 19
• расширение кооперации между регуляторными органами стран-членов PIC
/ S путем использования международных утвержденных стандартов и процедур;
•
координация подготовки инспекторов и технических экспертов;
• взаимное признание странами-членами PIC / S сертификатов соответствия производства ЛС требованиям GMP;
• обеспечение защиты потребителей от некачественной фармацевтической продукции;
• уменьшение количества дублирующих проверок на фармацевтических предприятиях;
• упрощение процедур по экспорту-импорту продукции на международных рынках.
Слайд 20
На очередном заседании PIC / S, которое состоялось
8.11.2010 г. в г. Куала-Лумпур (Малайзия), было принято решение
о присоединении Гослекслужбы МЗ к членам PIC / S, Украина стала 39-й страной, присоединившейся к этой организации.
Сертификация – комплекс мероприятий, при осуществлении которых третья (независимая сторона) дает письменную гарантию того, что продукция, процесс или услуга отвечает утвержденным требованиям. Всемирная ассамблея здравоохранения на 50-й сессии в 1996 г. призвала все страны использовать Систему сертификации качества фармацевтических препаратов в международной торговле ВОЗ.
Слайд 21
Составляющие Системы сертификации ВОЗ:
• эффективная национальная система лицензирования
не только ЛС, но и производителей и дистрибьюторов;
• соблюдение
производителями ЛС требований, надлежащей производственной практики GMP;
• эффективная система контроля качества ЛС, зарегистрированных или произведенных в стране с участием независимых лабораторий по контролю качества;
• национальная фармацевтическая инспекция по контролю за производством ЛС, которая действует как функциональная часть национального уполномоченного органа по регулированию ЛС.
Слайд 22
Система не предусматривает внешних инспекций, а базируется на
выдаче уполномоченными органами стран-участниц таких видов сертификатов: сертификат ЛС,
заявление о лицензионном статусе ЛС и сертификат серии ЛС:
Система сертификации для международной торговли ВОЗ
Слайд 23
Сертификат ЛС – документ, выданный страной-экспортером, предназначенный для
использования компетентным уполномоченным органом страны-импортера в случае получения лицензии
на импорт и продажи ЛС, или восстановления, расширения, изменения или просмотра такой лицензии.
Заявление о лицензионном статусе ЛС подтверждает, что указанный препарат разрешен к применению в стране-экспортере. Документ предназначен для использования представителями-импортерами, если проводится обсуждение предложенных цен в ответ на международный тендер; в этом случае его следует спрашивать как условие торговли. Заявление о лицензионном статусе предназначено только для облегчения отбора и подготовки информации. Решение об импорте любого препарата, который был предварительно отобран с помощью такой процедуры, должно быть принято на основании сертификата ЛС.
Слайд 24
Сертификат серии ЛС, как правило, выдается производителем и
только как исключение (для вакцин, сывороток и др.) –
компетентным уполномоченным органом страны-экспортера. Он подтверждает, что данная серия ЛС соответствует утвержденной спецификации, а также предназначен для сопровождения и подтверждения качества и срока годности определенной серии или партии ЛС, которое уже лицензировано в стране-импортере. Другими словами, сертификат о качестве производителя – документ, выданный производителем, о соответствии серии лекарственного средства требованиям, установленным при его регистрации в Украине.
Слайд 25
Перечень информации в сертификате производителя:
Регистрационный номер сертификата.
Реквизиты производителя:
название, адрес, телефон, факс, собственные логотипы.
Название лекарственного средства (лекарственная
форма, активный ингредиент и количество в единице дозы) – как в регистрационном удостоверении.
Номер регистрационного удостоверения и срок его действия.
Номер серии.
Количество продукции в серии.
Слайд 26
Дата производства (выпуска) ЛС, срок годности ЛС или
хранения (в годах).
Ссылка на АНД (спецификацию), согласно которой выполнялся
лабораторный анализ качества.
Таблица с перечнем показателей, требованиями АНД и результатами испытаний (наименование показателей, требования АНД, результаты испытаний).
Заключение (о соответствии образца требованиям АНД).
Дата оформления сертификата.
Должность, фамилия и подпись лица, которое визирует сертификат.
Слайд 27
Процедура сертификации включает следующие этапы:
подачу заявления в Гослекслужбу
о выдаче сертификата;
осуществление экспертизы сертификационного досье (комплекта документов на
ЛС, которые необходимы для выдачи сертификата);
осуществление лабораторной проверки качества его образцов (при необходимости);
принятие решения о выдаче сертификата;
оформление и выдачу сертификата.
Обычно фирма-производитель (страны ЕС, США, Япония) должна подать в Государственную службу ЛС комплект документов (сертификат GMP; досье производственного участка; последний отчет местной инспекции и др.), которые проходят дальнейшую экспертизу на предмет соответствия комплекса требований. В результате этого указанный отчет принимается как эквивалент, т.е. признается в одностороннем порядке. Далее выносится соответствующее решение о признании сертификата GMP с утверждением этого приказом Государственной службы. В Украине документом, который декларирует качество ЛС является сертификат качества производителя.
Слайд 28
Срок действия сертификатов:
для сертификата ЛС устанавливается на срок
действия регистрационного удостоверения, но не может превышать срок действия
лицензии предприятия на производство и / или реализацию ЛС в Украине;
для сертификата серии ЛС устанавливается на срок годности серии ЛС;
для сертификата лицензионного статуса ЛС устанавливается на срок действия его регистрационного свидетельства;
для сертификата другого вида по форме согласно требованиям, установленным страной-импортером, определяется Гослекслужбой в зависимости от информации, содержащейся в этом сертификате.
Слайд 29
Система выполняет следующие функции:
Контро-лирую-щая
Регули-рующая
Управленческо-координирующая
Инфор-мацион-ная
Научно-методи-ческая
Осуществление предварительного, дальнейшего и арбитражного

контроля качества ЛС. На уровне субъектов хозяйствования проводится согласно
действующим нормам предварительный и выборочный контроль, а все три формы контроля проводят специальные органы Системы как на макро-, так и микроэкономическом уровне
Заключается в создании определенного нормативно – правового поля деятельности, реализации механизмов лицензирования фармацевтической продукции и т.п.
Заключается в осуществлении управления всеми структурами Системы, формировании рациональных взаимодействий составляющих. Указанная функция удовлетворяет как внутренние проблемы системы в обеспечении эффективной работы, так внешние.
Формируется централизованная информационная база случаев выявления фальсифицированных, субстандартных и незарегистрированных ЛС
Сотрудники осуществляют разъяснительную работу при проведении проверок, регулярно проводятся совещания и тренинги по вопросам качества, распространяется научно-методическая литература, осуществляется информационная поддержка мероприятий, предотвращающих проникновение ЛС на отечественный рынок через нелегальные каналы, обеспечение качества сбыта и др.
Слайд 30
В основу построения существующей Системы положен принцип централизации
с административной подчиненностью составляющих. На данный момент отечественная Система
имеет три уровня:
Руководство Системой имеет три уровня и осуществляется в соответствующем нормативно-правовом поле специальными органами и структурами исполнительной власти.
Слайд 31
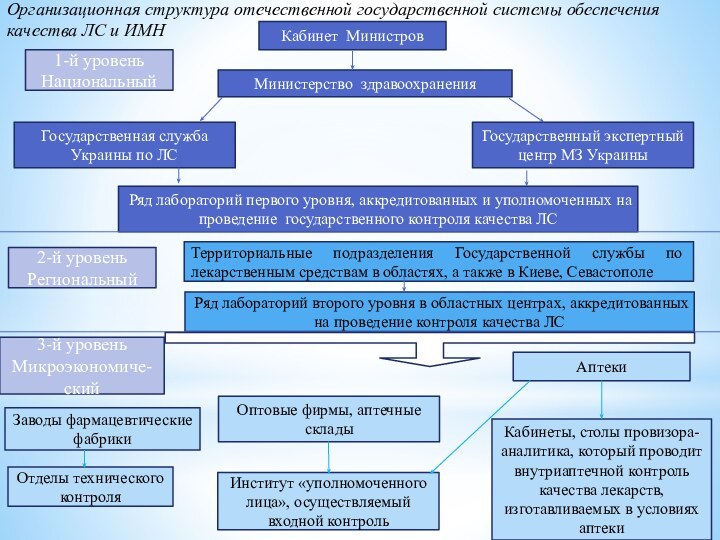
Организационная структура отечественной государственной системы обеспечения качества ЛС
и ИМН
Кабинет Министров
Министерство здравоохранения
Ряд лабораторий первого уровня, аккредитованных и
уполномоченных на проведение государственного контроля качества ЛС
Государственная служба Украины по ЛС
Государственный экспертный центр МЗ Украины
1-й уровень Национальный
2-й уровень Региональный
Территориальные подразделения Государственной службы по лекарственным средствам в областях, а также в Киеве, Севастополе
Ряд лабораторий второго уровня в областных центрах, аккредитованных на проведение контроля качества ЛС
3-й уровень Микроэкономиче-ский
Отделы технического контроля
Заводы фармацевтические фабрики
Институт «уполномоченного лица», осуществляемый входной контроль
Кабинеты, столы провизора-аналитика, который проводит внутриаптечной контроль качества лекарств, изготавливаемых в условиях аптеки
Оптовые фирмы, аптечные склады
Аптеки
Слайд 32
Главным специальным органом Системы является Государственная служба Украины
по лекарственным средствам МЗ (далее – Гослекслужба). В каждом
регионе Украины, а также в г. Киеве и г. Севастополе действуют 27 структурных подразделений Гослекслужбы, в подчинении которых находятся 29 лабораторий, способных провести проверку большого количества образцов для выявления фальсифицированных, некачественных ЛС.
Следующим государственным органом системы обеспечения качества ЛС является Государственный экспертный центр МЗ (далее – ГЭЦ), который выполняет следующие функции: экспертная; научная; консультативная; производственная; информационная.
Слайд 33
Для реализации функций ГЭЦ должен осуществлять:
экспертизу материалов по
созданию, доклиническому изучению, клиническим испытаниям, методам анализа качества, технологии
производства ЛС, включая инспекционные проверки условий производства ЛС, которые подаются для государственной регистрации;
разработку и представление в МЗ на утверждение проектов нормативных актов к материалам по разработке, доклиническому изучению и клиническому испытанию ЛС, порядку экспертизы этих материалов, фармакопейных статей или материалов относительно методов контроля качества ЛС, образцов ЛС и их упаковки, стандартов и требований относительно обращения ЛС т.д., исходя из требований к регистрационным документам, порядок адаптации указанных требований с международными стандартами;
Слайд 34
фармакологический надзор за ЛС, в том числе за
побочными реакциями / действиями зарегистрированных в Украине ЛС (организация
и осуществление фармаконадзора) и предоставление предложений МЗ о порядке осуществления этого надзора и полном или временном запрете применения ЛС;
научное обоснование приоритетных разработок новых ЛС в Украине;
анализ мирового опыта и подготовка проектов нормативных документов, подготовка и утверждение методических рекомендаций по вопросам создания, испытания, в том числе производства опытных образцов и регистрации ЛС, систем фармацевтического обеспечения населения;
совершенствование системы создания, экспертизы, клинической и доклинической апробации и регистрации ЛС.
Слайд 35
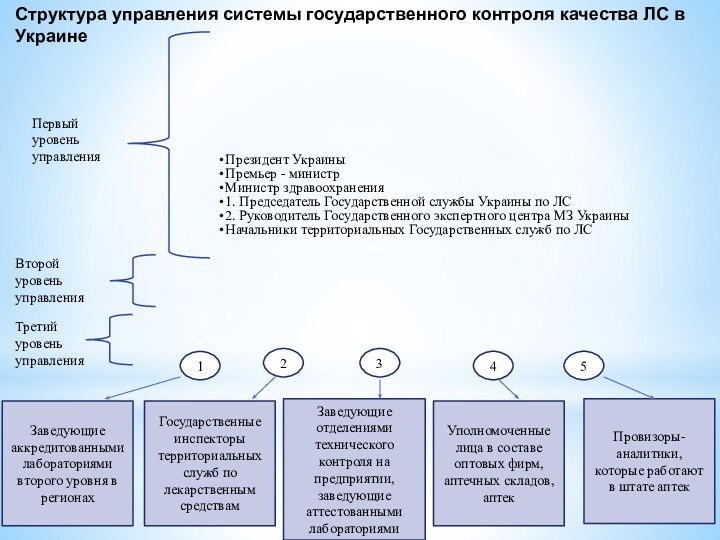
Структура управления системы государственного контроля качества ЛС в
Украине
1
2
3
4
5
Заведующие аккредитованными лабораториями второго уровня в регионах
Государственные инспекторы территориальных
служб по лекарственным средствам
Заведующие отделениями технического контроля на предприятии, заведующие аттестованными лабораториями
Уполномоченные лица в составе оптовых фирм, аптечных складов, аптек
Провизоры-аналитики, которые работают в штате аптек
Первый уровень управления
Второй уровень управления
Третий уровень управления
Слайд 36
Важным механизмом обеспечения защиты отечественного фармацевтического рынка от
опасной недоброкачественной продукции является государственная регистрация ЛС. ГЭЦ МЗ
Украины осуществляет вышеуказанные функции и создает научно-организационную и информационную базу (государственный реестр ЛС) к качественному применению исключительно эффективных и безопасных ЛС.
Государственный реестр ЛС – документ, содержащий перечень разрешенных к применению в Украине ЛС.
Порядок регистрации лекарств в Украине устанавливает механизм проведения государственной регистрации (перерегистрации) ЛС, определенных статьей 2 Закона Украины "О лекарственных средствах", применение которых в Украине допускается только после такой регистрации. Не подлежат государственной регистрации ЛС, изготавливаемые в аптеках по рецептам врачей и по заказу лечебно-профилактических учреждений из разрешенных к применению действующих и вспомогательных веществ.
Слайд 37
Государственную регистрацию (перерегистрацию) ЛС осуществляет МЗ на основании
результатов экспертизы регистрационных материалов на такое средство и контроля
его качества, проведенных ГЭЦ МЗ, в порядке, определенном МЗ.
В заявлении о государственной регистрации лекарственного средства, которое подает в Центр юридическое или физическое лицо, несущее ответственность за качество, безопасность и эффективность ЛС, указываются:
наименование и адрес заявителя, юридический адрес и адрес места осуществления деятельности производителя ЛС,
название ЛС, его торговое название, название действующего вещества, синонимы,
форма выпуска,
полный состав ЛС,
показания к применению и противопоказания,
дозирование,
условия отпуска,
способы применения,
срок и условия хранения,
информация об упаковке,
данные о регистрации ЛС в других странах.
Слайд 38
К заявлению прилагаются:
1) материалы доклинического изучения и клинического
испытания ЛС, а в случае регистрации генерических ЛС –
материалы, подтверждающие терапевтическую эквивалентность (взаимозаменяемость) с референтным препаратом, определенным МЗ согласно рекомендациям ВОЗ, и результаты экспертизы этих материалов;
2) фармакопейная статья или материалы относительно методов контроля качества ЛС;
3) проект технологического регламента или сведения о технологии производства ЛС;
4) образцы ЛС и его упаковки;
5) документ, подтверждающий уплату регистрационного сбора.
Слайд 39
Основные задачи Гослекслужбы Украины:
внесение предложений по формированию
государственной политики в сферах контроля качества и безопасности ЛС,
медицинских изделий, а также лицензирования предпринимательской деятельности по производству ЛС, оптовой и розничной торговле ЛС;
реализация государственной политики в сфере государственного контроля качества и безопасности лекарственных и медицинских изделий;
лицензирование хозяйственной деятельности по производству ЛС, оптовой и розничной торговле ЛС.
Контроль за соблюдением субъектами предпринимательства требований законодательства по обеспечению качества ЛС проводится путем плановых, последующих проверок и проверок по поручению, осуществляемых непосредственно по месту осуществления предпринимательской деятельности.
Слайд 40
Основанием для проверки является приказ (решение) территориальной службы
или Гослекслужбы, в котором указаны: название субъекта, его местонахождение,
состав рабочей группы инспекторов, срок проведения, характер проверки, в случае проверки по доверенности – ссылка на документ, на основании которого она организована.
Плановая проверка – всесторонняя проверка субъекта предпринимательства согласно утвержденному плану на соблюдение им требований законодательства относительно обеспечения качества ЛС во время их производства, оптовой и розничной торговли и медицинского применения. Проводится не чаще одного раза в год. План проверки субъектов предпринимательской деятельности составляется территориальной службой с учетом всех мест реализации ЛС (с указанием адресов) и подается на согласование в Гослекслужбу ежеквартально.
Слайд 41
Следующая проверка проводится с целью контроля выполнения мероприятий
по устранению нарушений и недостатков, выявленных по результатам предварительной
плановой проверки. В зависимости от характера выявленных нарушений и объема работы, которая должна быть выполнена для их устранения, срок ее проведения может быть определен в промежутке времени от 6 недель до 6 месяцев.
Проверка по поручению осуществляется:
• по распоряжению Гослекслужбы, на основании поступления к ней письменного заявления (сообщения) о нарушении субъектом требований законодательства по обеспечению качества ЛС;
• по поручению Верховной Рады, Президента, Кабинета Министров Украины, МЗ Украины или по обращению или по запросу других государственных контролирующих, правоохранительных органов и органов местной власти;
• в случае поступления заявления, письменной жалобы физического или юридического лица о нарушении требований законодательства относительно обеспечения качества ЛС.
Слайд 42
Проверку осуществляет сотрудник Гослекслужбы или территориальной службы –
государственный инспектор. При необходимости территориальная инспекция по согласию может
привлекать к проведению проверок представителей других государственных контролирующих органов или отдельных специалистов, которые обладают образованием, специальностью и опытом.
Основные этапы проведения
инспекционной проверки:
- анализ документов, связанных с конкретным видом деятельности субъекта (наличие оригиналов разрешительных документов: действующих лицензий, паспортов аптеки и структурных подразделений, свидетельств о праве собственности или договоров аренды на помещения, устава, регистрационного удостоверения, а также распорядительных документов – приказ о назначении уполномоченного лица, внутренний порядок обращения ЛС, план срочных действий);
Слайд 43
контроль ведения реестра ЛС, которые поступают или реализуются
предприятием, наличие выводов уполномоченного лица о результатах входного контроля,
учет информации о выявленных некачественных, фальсифицированных или незарегистрированных ЛС;
проверка надлежащего оформления договоров с поставщиками и / или покупателями, наличия заверенных копий лицензий, правильности заполнения сопроводительных документов на ЛС;
контроль личных дел для уточнения квалификации персонала;
проверка обеспеченности нормативными документами и справочной литературой;
обследование имеющихся у субъекта помещений, установление их состава и размера, соответствия упорядочения и оснащения требованиям нормативных документов и процессам, которые в них осуществляются;
Слайд 44
проверка соответствия требованиям и технического состояния оборудования, своевременности
метрологической проверки;
контроль соблюдения условий хранения и правил реализации ЛС,
ЛРС, парафармацевтических товаров;
проверка соблюдения правил технологии изготовления ЛС, организации внутриаптечного контроля, наличия всех необходимых регистрационных журналов и хронологичности записей в них, соответствия сроков годности;
проверка правильности обработки и хранения посуды, внешнего вида сотрудников, состояния рабочей одежды;
осуществление выборочного визуального контроля ЛС, при котором проверяется серия, срок годности, регистрационный статус, целостность, однородность, наличие повреждений, листок-вкладыш;
проверка наличия сопроводительных документов и сертификатов качества производителя.
Слайд 45
По окончании обследования инспектор окончательно анализирует полученные данные
и решает, какие из них не отвечают установленным требованиям
и должны быть представлены как несоответствия. Он обеспечивает их окончательное документирование в виде акта проверки.
Акт составляется в двух экземплярах и подписывается инспектором и лицом, в присутствии которого проводилась проверка. К акту прилагаются документы и материалы, полученные во время проверки и подтверждают объективность выложенных данных. В случае отказа субъекта от подписи, в акте делается соответствующая отметка с мотивированным объяснением причин. По согласованию с руководителем после составления акта проводится заключительное совещание. Инспектор оглашает присутствующим перечень недостатков и нарушений основных норм и делает вывод о состоянии обеспечения качества ЛС у субъекта.
Слайд 46
Две формы контроля в товаропроводящей сети:
входящий или
предыдущий, осуществляется уполномоченными лицами субъектов предпринимательства, которые имеют лицензии
на право оптовой и розничной торговли ЛС при приемке товара с помощью визуальных методов;
выборочный (дальнейший) государственный контроль качества ЛС, проводится во время оптовой и розничной реализации ЛС путем инспектирования территориальными инспекциями по контролю качества ЛС субъектов предпринимательства.
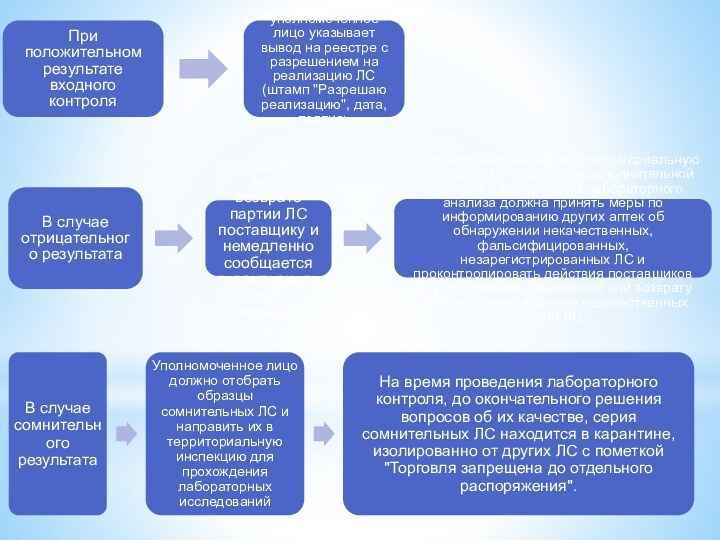
Для проведения входного контроля приказом руководителя организации должно быть назначено уполномоченное лицо, которое должно иметь высшее фармацевтическое образование и стаж не менее 2-х лет. В его компетенцию входит подготовка и оформление заключения по результатам входного контроля качества серий лекарств, поступивших в учреждение, с отметкой о возможности передачи их к реализации
Слайд 47
Обязанности уполномоченного лица:
1.Проведение входного контроля качества ЛС, в
т.ч. проверка:
внешнего вида ЛС и его визуальный осмотр;
документов-накладных, в
которых обязательно должны быть указаны наименование, дозировка, лекарственная форма, номер серии, количество, название производителя каждого ЛС;
сертификатов качества производителя, заверенных печатью последнего поставщика;
сведений о государственной регистрации ЛС.
2.Оформление вывода входящего контроля качества ЛС.
3.Ведение реестра лекарственных средств, поступивших к субъекту предпринимательской деятельности, что в дальнейшем дает возможность отследить источник получения каждой некачественной или фальсифицированной партии ЛС.
Слайд 48
4.Ведение реестра лекарственных средств, реализуемых субъектом предпринимательской деятельности,
что позволяет в случае необходимости отозвать обнаруженные партии фальсифицированных
или некачественных ЛС (только для оптовых организаций).
5.Проверка наличия некачественных и фальсифицированных серий ЛС согласно предоставленной информации Гослекслужбы и территориальной службы.
6.Предоставление территориальному органу государственной службы сведений о выявлении некачественных и фальсифицированных ЛС или в отношении которых есть сомнения относительно соответствия качества требованиям АНД.
7.Остановка торговли и размещение в карантинной зоне таких лекарств.
8. Согласование внутреннего порядка обращения ЛС.
Слайд 49
Дополнительно должны сопровождаться
заключением о качестве:
• субстанции, используемые в
аптеках для изготовления парентеральных лекарственных форм и лекарств, применяемых
в глазной практике (по всем показателям АНД);
• наркотические ЛС, психотропные вещества и прекурсоры;
• ЛС, используемые для наркоза, в том числе ингаляционного (за исключением кислорода и закиси азота);
• рентгеноконтрастные средства;
• противотуберкулезные средства (в т. ч. комбинированные), содержащие рифампицин, изониазид, этамбутол, пиразинамид.
Реестр лекарственных средств, поступивших к субъекту предпринимательской деятельности
Слайд 50
Заключение по качеству – это документ с информацией

о проверенном образце ЛС, с результатами лабораторного исследования и
заключением о соответствии требованиям действующей в Украине аналитически-нормативной документации. Этот документ выдается аккредитованной лабораторией по контролю качества ЛС, подчиненной территориальной службе или уполномоченной лаборатории. Субъект хозяйственной деятельности несет юридическую ответственность за соблюдение законодательства Украины относительно качества лекарственных средств.
Приказом МЗ Украины от 26.10.2001 г. № 428 утверждена «Инструкция по оформлению материалов об административных правонарушениях законодательства Украины относительно обеспечения качества лекарственных средств». Согласно этой Инструкции органы государственного контроля качества ЛС рассматривают дела об административных правонарушениях, связанных с несоблюдением требований стандартов, норм, правил и технических условий при производстве, хранении, транспортировке, реализации или использовании ЛС, предусмотренных статьями Кодекса Украины об административных правонарушениях.
Слайд 51
Алгоритм проведения входного контроля качества ЛС
1.1. Предприятие должно

закупать и получать ЛС и товары аптечного ассортимента только
у фирм, имеющих действующую лицензию на право производства и оптовой торговли. Копии лицензии прилагаются к соглашениям о поставках и хранятся у руководства аптеки со всем комплектом сопроводительных документов
1-й этап
Предварительная проверка
3-й этап
Результаты входного контроля и оформление документов
2.1.Уполномоченное лицо проверяет соответствие полученного товара сопроводительным документам (наименование, количество, дозировка, номер серии, срок годности, регистрационный статус, лекарственная форма, название производителя)
2.2.На каждую серию ЛС проверяется наличие сертификата качества производителя, который должен быть заверен печатью последнего поставщика
2.3.Проверяется групповая тара, целостность внешней и внутренней упаковки, маркировки, наличие листка-вкладыша. Внешний вид проверяется на целостность, однородность, наличие повреждений, качество упаковочных материалов.
2-й этап
Организация и проведение входного контроля
2.3.1.При возникновении подозрения относительно качества – ЛС проверяются с раскрытием упаковок относительно размеров, форм, цвета, однородности, наличия загрязнений
3.1.Получение результатов входного контроля и оформление документов
Положительный результат
4-й этап
Административное решение вопросов
Сомнительный результат
Отрицательный результат
4.1.Принятие соответствующих управленческих решений, распоряжений в соответствии с задачами по обеспечению качества ЛС и ИМН в товаропроводящей сети
Слайд 53
У субъектов хозяйственной деятельности должны быть разработаны внутренний
порядок оборота ЛС с определением мероприятий и ответственных лиц
за соблюдение надлежащих условий обращения ЛС и план срочных действий с определением мероприятий при выявлении фальсифицированных, незарегистрированных и некачественных ЛС.
После поступления уполномоченному лицу учреждения здравоохранения информации о запрете отдельных серий лекарственного препарата осуществляется проверка наличия этих серий в аптеке, а предписание подшивается к соответствующей папке (реестр). Территориальной службе предоставляется ответ: "Указанные серии медикаментов в аптеке отсутствуют". Предписания в реестре должны храниться минимум срока годности лекарственного средства. То есть в новых поставках лекарств в аптеку необходимо снова сверять серии, поступивших с полным реестром предписаний о запретах.
Слайд 54
Внутриаптечный контроль – это комплекс мер и видов
контроля, осуществляемых непосредственно в аптеке и охватывает все стадии
изготовления ЛС. Ответственность за его проведение возлагается на провизора-аналитика. Заведующий аптекой, его заместители, уполномоченное лицо также должны владеть всеми видами внутриаптечного контроля качества и в случае отсутствия провизора-аналитика обеспечить их выполнение.
Слайд 55
Провизор-аналитик обязан:
• осуществлять все виды внутриаптечного контроля качества

в соответствии с требованиями АНД, ГФУ, технологической инструкции и
т.д.;
• обеспечить наличие утвержденных технологических инструкций на ЛС, которые изготовляются аптекой серийно;
• проводить систематическое наблюдение за технологическим процессом изготовления ЛС;
• уточнять результаты уже проведенного уполномоченным лицом или проводить самостоятельно входной контроль качества субстанций, ЛРС и вспомогательных веществ;
• контролировать условия хранения и сроки годности субстанций, вспомогательных веществ, концентратов, полуфабрикатов, реактивов, титрованных растворов;
• обеспечить своевременное обновление титрованных растворов и реактивов, из-ленных на договорных началах аккредитованными или аттестованными лабораториями;
• надзор за соблюдением в аптеке санитарно-гигиенического режима;
• изымать в установленном порядке образцы ЛС для осуществления государственного контроля качества;
• систематически консультировать специалистов, участвующих в процессе изго-товления ЛС, по вопросам хранения, технологии и контроля качества лекарств;
• вести учетные формы, составлять отчетность по установленным требованиям.
Слайд 56
Провизор-аналитик имеет право:
запрещать (с одновременным уведомлением заведующего или
его заместителя) изготовление лекарственных форм в условиях, не обеспечивающих
их качества;
изымать из обращения изготовленные ЛС, субстанции, вспомогательные вещества, концентраты и реактивы в случае их несоответствия АНД, срока годности или потери регистрационного статуса;
запрещать применение неисправных, не поверенных приборов, средств измерения;
направлять образцы воды очищенной, воды для инъекций, внутривенных инфузионных, парентеральных инъекционных и других ЛС для проведения микробиологического контроля пирогенности в аккредитованные или аттестованные лаборатории;
вносить в установленном порядке предложения по вопросам организации аптечного дела по обеспечению качества при изготовлении ЛС.
Слайд 57
Рабочим местом провизора-аналитика может быть как отдельный кабинет,

так и должным образом оборудованное место в ассистентской комнате.
Кабинет
оснащают вытяжной системой, аналитическим столом, стулом со спинкой подъемно-поворотной конструкции, вспомогательным столом для размещения приборов и аппаратов, шкафом для хранения реактивов и лабораторной посуды, электроплитой для подогрева веществ при проведении анализов.
В кабинете должны быть горячая и холодная вода, электричество, раковина со сливом в канализацию.
Рабочее место оборудуется современными приборами (рефрактометр, фотоэлектроколориметр, рН-метр и т.п.), аппаратами, реактивами и другими средствами.
Необходимо наличие средств малой механизации и оргтехники: титровальной установки с микробюретками для экспресс-анализа; планшетов с углублениями для проведения реакций идентификации;
Необходимый набор реактивов и лабораторной посуды для испытаний на чистоту воды очищенной и для инъекций, набор стаканов для контроля раствора в бюретковой установке, пипетки Шутерса для индикаторов.
Следует оборудовать картотечные ящики-лотки для бумаг, канцтоваров.
Обязательно наличие ГФУ, нормативно-технической документации, внутренних технологических инструкций на ЛС серийного изготовления.
Слайд 58
Меры предосторожности – это совокупность мероприятий, обеспечивающих изготовление

и отпуск из аптеки лекарственных форм, качество которых удовлетворяет
требования Государственной Фармакопеи Украины, действующих приказов и инструкций:
1.1.Входной контроль при поступлении лекарственных средств от поставщиков;
1.2.Приемный контроль рецептов, поступивших в аптеку (тщательный просмотр всех рецептов, поступающих в аптеку, обращая внимание на правильность оформления, совместимость ингредиентов, соответствие доз прописанных веществ возраста больного);
1.3.Соблюдение всех требований санитарного режима и фармацевтического порядка;
1.4.Надлежащий метрологический контроль, то есть обеспечение исправности и точности аппаратов и весоизмерительных приборов, регулярность их государственной проверки;
1.5.Надлежащая организация хранения лекарственных средств как готовых, так и изготовленных в аптеке, в соответствии с требованиями Государственной Фармакопеи Украины, действующих приказов, инструкций и распоряжений;
1.6.Соблюдение технологии лекарственных форм аптечного изготовления.
Слайд 59
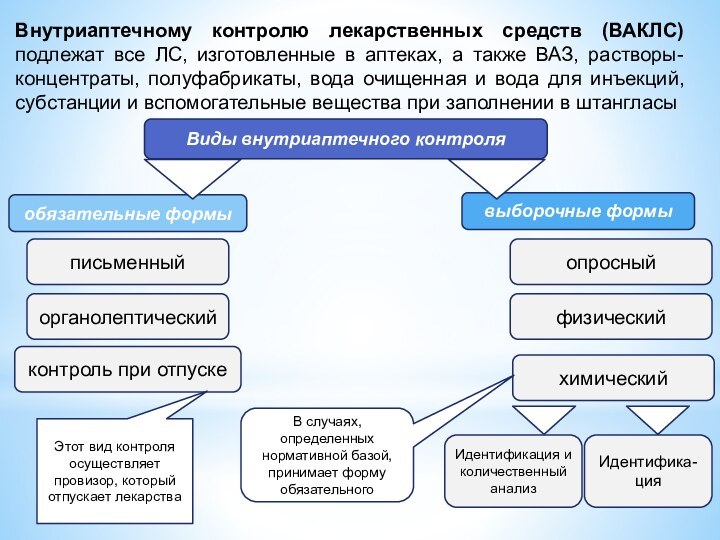
Внутриаптечному контролю лекарственных средств (ВАКЛС) подлежат все ЛС,
изготовленные в аптеках, а также ВАЗ, растворы-концентраты, полуфабрикаты, вода
очищенная и вода для инъекций, субстанции и вспомогательные вещества при заполнении в штангласы
Виды внутриаптечного контроля
письменный
обязательные формы
выборочные формы
органолептический
контроль при отпуске
химический
физический
опросный
Идентификация и количественный анализ
Идентифика-
ция
Этот вид контроля осуществляет провизор, который отпускает лекарства
В случаях, определенных нормативной базой, принимает форму обязательного
Слайд 60
Письменный контроль – состоит в проверке соблюдения правил
технологии (последовательности смешивания), соответствия записей в паспорте письменного контроля
прописи в рецепте, правильности произведенных расчетов. Осуществляется провизором-аналитиком после передачи ему изготовленного ЛС, рецепта на него и заполненного паспорта письменного контроля или соответствующего журнала.
Органолептический контроль – осуществляется в виде проверки внешнего вида ЛС, в том числе качества укупорки, цвета, запаха, однородности смешивания, отсутствия механических включений в жидких лекарственных формах. При этом по показателю однородность смешивания проверка осуществляется выборочно у каждого фармацевта или провизора в течение рабочего дня: для порошков – по содержанию действующего вещества в единице дозированного ЛС, для мазей и суппозиториев – по методике определения однородности в соответствии с требованиями ГФУ.
Слайд 61
Контроль при отпуске, целью которого является отпуск больному
именно его лекарств, предусматривает проверку соответствия:
упаковки лекарственного препарата –
физико-химическим свойствам ингредиентов, входящих в его состав;
оформления препарата – требованиям действующих нормативных документов;
указанных в рецепте доз (ядовитых и других ЛС) – возрасту больного;
номера на рецепте и номера на этикетке, фамилии больного на квитанции – фамилии на этикетке, в рецепте или его копии;
состава ЛС, указанного на этикетке, - прописи в рецепте.
Этот вид контроля осуществляет провизор аптеки, который отпускает лекарства. При удовлетворительном результате он проставляет свою подпись и дату на обратной стороне рецепта или требования в паспорте письменного контроля.
Слайд 62
Опросный контроль – осуществляется выборочно в течение дня
у каждого провизора или фармацевта. Проводится после изготовления ним
не более пяти лекарственных форм. Провизор-аналитик называет первый ингредиент, который входит в лекарственную форму, а в сложных прописях отмечает также и его количество, после чего фармацевт обязан по памяти назвать все взятые им ингредиенты и их количество. При использовании полуфабрикатов или концентратов фармацевт должен указать их состав и концентрацию.
Слайд 63
Физический контроль – осуществляется путем проверки общей массы
или объема лекарственной формы, количества и массы отдельных доз,
входящих в данную форму (но не менее трех доз). В течение рабочего дня провизор-аналитик выборочно проверяет изготовленные по индивидуальным рецептам или требованиям ЛС,
Кроме того, обязательной проверке подлежат:
• 3-5 единиц фасовки или внутриаптечной заготовки в каждой серии фасовки или ВАЗ;
• ЛС, требующие стерилизации, после расфасовки (до их стерилизации)
• ЛС для детей до 1 года;
• ядовитые, наркотические (психотропные) ЛС
Слайд 64
Химический контроль – заключается в идентификации (качественный химический
контроль) и идентификации и определении количественного содержания (полный химический
контроль) лекарственных веществ, входящих в состав ЛС.
Полный химический контроль принимает форму обязательного при изготовлении:
растворов для инъекций и внутривенных инфузионных ЛС;
до и после стерилизации – при серийном изготовлении;
до стерилизации – при индивидуальном изготовлении;
всех глазных капель при серийном изготовлении;
глазных капель и мазей по индивидуальным рецептам, содержащих наркотические и ядовитые вещества, причем в каплях содержание изотонирующих и стабилизирующих ингредиентов определяется до стерилизации;
лекарственных форм для новорожденных;
растворов кислоты хлористоводородной (для внутреннего применения), атропина сульфата и серебра нитрата;
вся внутриаптечная заготовка (каждая серия);
стабилизаторы, используемые при изготовлении растворов для инъекций, глазных капель и буферных растворов.
Слайд 65
Все лекарственные формы для новорожденных, глазные капли и
мази по индивидуальным прописям готовят в присутствии провизора-аналитика.
Он также
следит за введением стабилизаторов и антимикробных консервантов в случае невозможности определения их количества в глазных каплях при серийном изготовлении.
После проведения химического контроля лекарственного препарата в паспорте письменного контроля ставится номер анализа и подпись провизора-аналитика. Только идентификации (качественному химическому контролю) в обязательном порядке подлежат:
не менее 10% ЛС, изготовленных по индивидуальным рецептам и на заказ ЛПУ, избирательно у каждого провизора или фармацевта в течение рабочего дня;
лекарственные средства, концентраты и полуфабрикаты, поступающие из помещений хранения в ассистентской;
концентраты, полуфабрикаты, жидкие ЛС в бюретковой установке и в штангласах с пипеткой, находящиеся в ассистентской комнате, при заполнении.
Слайд 66
Важное место в обеспечении качества изготовленных в аптеке

ЛС отводится надлежащему документальному оформлению результатов внутриаптечного контроля. Полученные
результаты регистрируют в журналах по формам, рекомендованным МЗ Украины.
Все журналы должны быть с пронумерованными страницами, прошнурованы, скреплены печатью аптеки и заверены подписью руководителя / заведующего.
При изготовлении всех ЛС по индивидуальным рецептам или требованиям ЛПУ заполняются паспорта письменного контроля, в которых указываются:
дата, номер рецепта (требования);
взятые лекарственные вещества и их количество, число доз;
общая масса или объем;
проставляются подписи лиц, которые приготовили, расфасовали и проверили ЛС.
Если в состав лекарственной формы входят ядовитые, наркотические и психотропные вещества и вещества, подлежащие ПКУ, то паспорт письменного контроля заполняется только на обратной стороне рецепта. В случаях, когда провизор-аналитик проводит физический и химический контроль, в паспорте дополнительно проставляются номер анализа и подпись провизора-аналитика. Заверенные подписями паспорта письменного контроля сохраняются в аптеке в течение двух месяцев.
Слайд 67
Для ЛС, которые изготовляются сериями по заказу ЛПУ
и должны быть стерильными, наименование и количество исходных веществ
отмечается в Журнале регистрации отдельных стадий изготовления инъекционных, внутривенных инфузионных и глазных лекарственных средств.
Для концентратов, полуфабрикатов, ВАЗ и фасовки лекарственных средств – в журнале лабораторных и фасовочных работ. Результаты органолептического, физического и химического контроля заносятся в Журнал регистрации результатов контроля лекарственных средств, изготовленных в аптеке, внутриаптечной заготовки, этилового спирта.
При большом объеме работы по этой форме разрешается вести отдельные журналы с учетом специфики, например, отдельно для ВАЗ и для ЛС по индивидуальным рецептам или требованиям.
Слайд 68
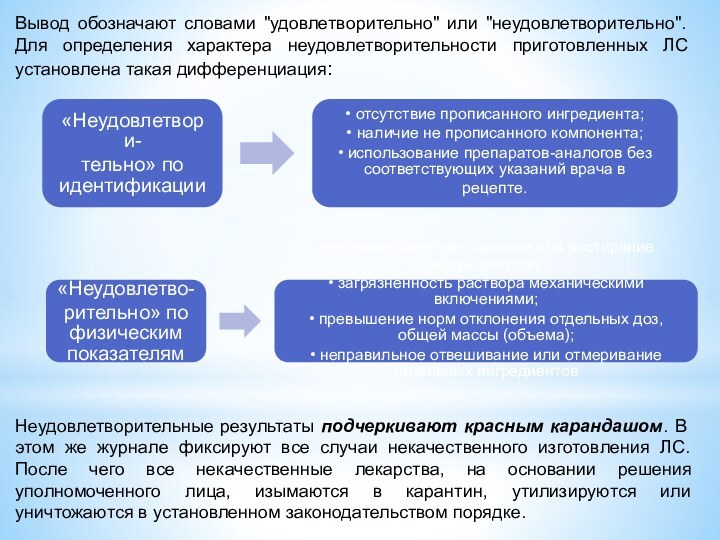
Вывод обозначают словами "удовлетворительно" или "неудовлетворительно". Для определения
характера неудовлетворительности приготовленных ЛС установлена такая дифференциация:
Неудовлетворительные результаты подчеркивают
красным карандашом. В этом же журнале фиксируют все случаи некачественного изготовления ЛС. После чего все некачественные лекарства, на основании решения уполномоченного лица, изымаются в карантин, утилизируются или уничтожаются в установленном законодательством порядке.
Слайд 69
Результаты химического контроля, а именно обязательной идентификации ЛС,

концентратов и полуфабрикатов, поступающих из помещений хранения в ассистентскую
при заполнении ими штангласов или бюретковых установок целесообразно оформлять в отдельном журнале регистрации идентификации лекарственных средств. При этом дата и подписи лиц, которые заполнили и проверили, проставляются как в журнале, так и на штангласах.
"Испытания на чистоту" воды, которая используется аптекой для изготовления ЛС, документально оформляются в двух разных журналах: Журнал регистрации результатов контроля воды очищенной и воды для инъекций "in bulk" и Журнал регистрации результатов контроля воды для инъекций стерильной.
Отсутствие примесей в соответствующих графах обозначают знаком "-", а допустимых примесей – "-" или «п/э", т.е. в пределах эталона. Особое внимание следует обратить на документирование посерийного изготовления лекарств в аптеке.
В таком случае серия ЛС – это определенное количество однородной продукции (ЛС), изготовленной в условиях аптеки из определенного количества сырья в едином технологическом процессе от одной загрузки в единице емкостного оборудования. Каждая серия ЛС производится в соответствии с технологической инструкцией.
.