Слайд 2
3.1. Краткое повторение
Мы уже знаем, что:
Все металлы и
металлические сплавы – тела кристаллические, в которых атомы (ионы)
расположены закономерно.
Все наиболее характерные свойства металлов – объясняются наличием в них легкоподвижных коллективизированных электронов проводимости.
Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки.
Металлы образуют одну из следующих высокосимметричных сложных решеток с плотной упаковкой атомов: КОЦ, КГЦ, ГЦ и гексагональную.
Размеры кристаллической решетки характеризуются величинами периодов и параметров: координационным числом, коэффициентом компактности.
Элементы, располагающиеся в периодической системе на границе металлов с неметаллами, а также неметаллы имеют более сложные кристаллические решетки с малым КЧ.
Кристалл – тело анизотропное.
В реальном кристалле всегда имеются дефекты строения.
Слайд 3
3.1.Краткое повторение
Переход металла из жидкого состояния в твердое
называется кристаллизацией.
Процесс кристаллизации может протекать только при переохлаждении
Ме.
Процесс кристаллизации происходит в три этапа: образования ЦК, рост кристаллов и размеров.
Кристаллы, образующиеся в процессе затвердевания могут иметь различную форму в зависимости от скорости охлаждения, характера и количества примесей.
В слитке Ме различают три зоны с разной структурой: мелкие равноосные кристаллы , зона удлиненных дендритных кристаллов, зона, состоящая из равноосных различно ориентированных дендритных кристаллов.
Многие Ме в зависимости от температуры могут существовать в разных кристаллических формах – полиморфных модификациях.
Слайд 4
3.2.Фазы в сплавах
Под сплавом понимают вещество, полученное из
двух и более химических элементов.
Сплавы обладают характерными свойствами, присущими
металлическому состоянию.
Сплавы, состоящие из двух элементов называются
- двойными (бинарными): алюминий-кремний, золото-серебро, медь-цинк, свинец-сурьма.
из трех и более - многокомпонентными– чугун, сталь, дюралиминий.
Большинство сплавов получают совместным плавлением их компонентов.
Другие возможные технологии: порошковая металлургия, электролиз, конденсация из парообразного состояния.
Слайд 5
3.2.Фазы в сплавах
В металловедении широко используются понятия:
Система –
совокупность фаз, находящихся в состоянии равновесия;
Фаза – однородные (гомогенные)
составные части системы, имеющие одинаковый химический состав, агрегатное состояние, строение и свойства, и отделенные от остальных частей поверхностями раздела.
Под Структурой понимают форму, размеры и характер взаимного расположения соответствующих фаз в металлах.
Структурными составляющими сплава называют обособленные части сплава, имеющие одинаковое строение с присущими им характерными особенностями.
В сплавах в зависимости от физико-химического взаимодействия компонентов могут образовываться следующие фазы: жидкие растворы, механические смеси, твердые растворы, химические соединения, электронные соединения.
Механическая смесь двух компонентов А и В образуется тогда, когда эти компоненты не растворяются в твердом состоянии и не образуют химическое соединение. В МС фазы не меняют своих кристаллических решеток.
Слайд 6
Фазы в сплавах
Твердыми растворами называют фазы, в которых

один из компонентов сплава сохраняет свою кристаллическую решетку, а
атомы других (или другого) компонентов располагаются в решетке первого компонента (растворитель), изменяя ее размеры (периоды).
Различают:
Твердые растворы замещения Твердые растворы внедрения
Атомы растворенного компонента Атомы растворенного компонента
замещают часть атомов растворителя располагаются в междоузельях (пустотах)
в его КР КР растворителя
При образовании твердого раствора кристаллическая решетка всегда искажается (может увеличиваться или уменьшаться), так как и электронное строение, и размеры атомов растворителя и растворенного компонента различны.
Упорядоченные твердые растворы (сверхструктуры) – твердые растворы, устойчивые при сравнительно низких температурах. Например, медь-золото, железо-кремний, никель-марганец и др.) образование сверхструктуры сопровождается изменением свойств. Например, сплав пермаллой (железо и 78,5% никеля) СС резко ухудшает магнитную проницаемость, одновременно повышается твердость, снижается пластичность, изменяется электросопротивление.
Слайд 7
Структура сплава выявляется ми к р о а
н а л и з о м
Структура сплава –
форма, размеры и характер расположения фаз
Строение металлических
сплавов зависит от того,
в какие взаимодействия
вступают компоненты, их
образующие
В зависимости от физико-механического взаимодействия компонентов в сплавах могут образовываться следующие фазы
ФАЗЫ
Слайд 8
Фазы в сплавах
Химические соединения – чаще всего образуются

между элементами, расположенными далеко друг от друга в таблице
ХЭ .
Примеры: соединения магния с элементами IV - VI групп периодической системы, так называемые интерметаллоиды; соединения металла с неметаллом – нитриды, карбиды, гидриды и т.д. (фазы внедрения)
Характерные особенности ХС, образованных по закону нормальной валентности:
Кристаллическая решетка отличается от решеток компонентов, образующих соединение. Атомы в решетке химического соединения располагаются упорядоченно, т.е. атомы каждого компонента расположены закономерно и по определенным узлам. Большинство ХС имеют сложную кристаллическую решетку.
В соединении всегда сохраняется простое кратное соотношение компонентов, выражаемое формулой Аn Вm, где А и В – соответствующие элементы; n и m – простые числа.
Свойства соединения резко отличаются от свойств образующих его компонентов.
Температура плавления (диссоциации) постоянная.
Образование химического соединения сопровождается значительным тепловым эффектом.
Слайд 9
3.3. Диаграммы состояния двойных сплавов и их характеристика
Диаграмма
состояний сплава представляет собой графическое изображение фазового состояния сплавов
в зависимости от температуры и концентрации в условиях равновесия.
Равновесное состояние соответствует минимальному значению свободной энергии, которое может быть достигнуто при очень малых скоростях охлаждения или длительном нагреве.
Состояние сплава в равновесных условиях характеризуется числом и концентрацией образовавшихся фаз.
Правило фаз устанавливает зависимость между числом степеней свободы, числом компонентов и числом фаз и выражается уравнением:
С= К + 2 – Ф, где С – число степеней свободы системы (вариантость);
К – число компонентов, образующих систему;
2 – число внешних факторов (температура и давление);
Ф – число фаз, находящихся в равновесии.
Слайд 10
3.3. Диаграммы состояния двойных сплавов и их характеристика
Под
числом степеней свободы понимают возможность изменения температуры, давления и
концентрации без изменения числа фаз, находящихся в условиях равновесия.
Число фаз в сплаве, находящемся в равновесном состоянии, не может быть больше, чем число компонентов плюс единица.
В двойной системе в равновесии может находиться не больше трех фаз, в тройной – не больше ……. и т.д.
Металловеды изучили практически все известные двойные металлические сплавы и сгруппировали их в виде диаграмм состояния 4-х типов:
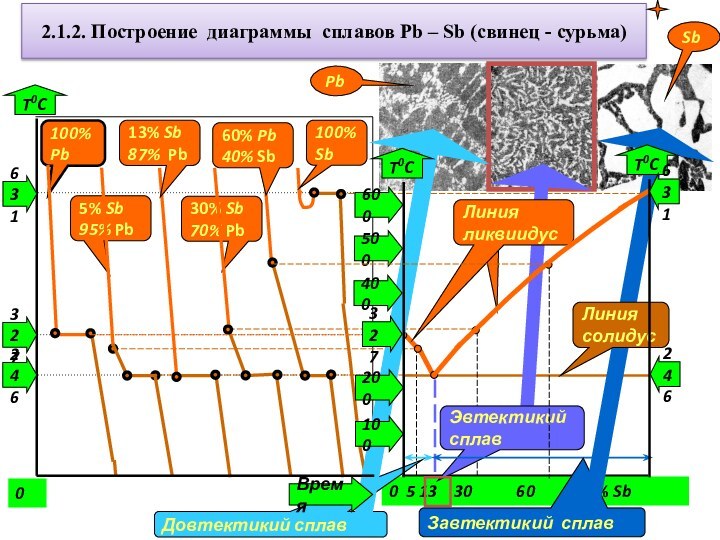
1 тип - неограниченная растворимость компонентов в ЖС и ограниченная в ТС (например, свинец-сурьма)
2 тип - неограниченная растворимость компонентов (Т и ЖС) (медь-никель)
3 тип - ограниченная растворимость компонентов (ТС) (медь-серебро)
4 тип - образование компонентами химического соединения (железо-углерод,
магний-кальций, магний – олово)
Слайд 11
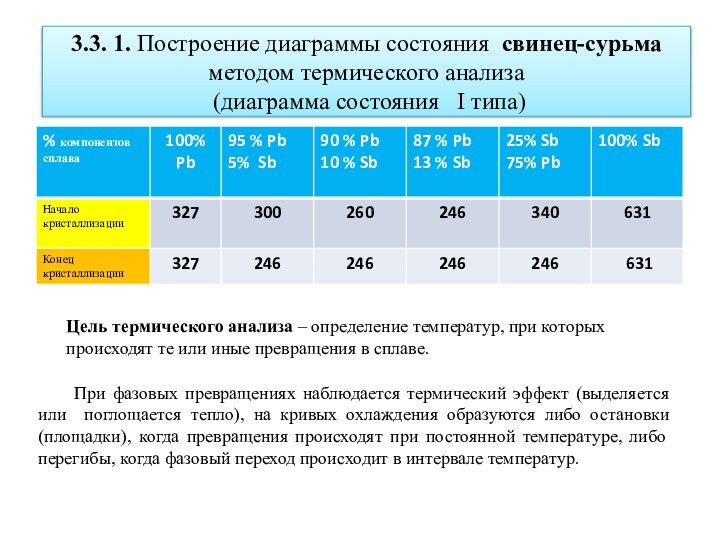
3.3. 1. Построение диаграммы состояния свинец-сурьма методом термического
анализа
(диаграмма состояния I типа)
Цель термического анализа –
определение температур, при которых происходят те или иные превращения в сплаве.
При фазовых превращениях наблюдается термический эффект (выделяется или поглощается тепло), на кривых охлаждения образуются либо остановки (площадки), когда превращения происходят при постоянной температуре, либо перегибы, когда фазовый переход происходит в интервале температур.
Слайд 12
3.4. Основные понятия и определения
Линия ликвидус - линия
первичной кристаллизации
Линия солидус – линия вторичного процесса кристаллизации
Эвтектика
Доэвтиктический сплав
Заэвтектический
сплав
Механические смеси
Твердые растворы
Химические соединения
Фаза
Система
Компонент
Правило фаз
Диаграмма состояния 4-х типов
Слайд 13
2.1.1. Построение кривых охлаждения сплава
Слайд 14
2.1.2. Построение диаграммы сплавов Pb – Sb (свинец
- сурьма)
Pb
Sb
Линия солидус
327
Слайд 15
Виды диаграмм состояния сплавов и зависимость их свойств
от вида диаграммы
Слайд 16
Виды диаграмм состояния сплавов и зависимость их свойств
от вида диаграммы
Между составом и структурой сплава, определяемой
типом диаграммы состояния и свойствами сплава, как показал Н.С.Курнаков, существует определенная зависимость.
При образовании непрерывного ряда твердых растворов свойства (твердость, электропроводность и др.) изменяются по криволинейной зависимости.
Образование твердых растворов всегда сопровождается значительным увеличением электрического сопротивления и уменьшением температурного коэффициента
электросопротивления.
В сплавах с ограниченной растворимостью свойства при концентрациях, отвечающих однофазному раствору, изменяются по криволинейной зависимости, в двухфазной области – по прямой.
При образовании механической смеси некоторые свойства (твердость, прочность, электропроводность и др.) представляют собой средние из свойств, образующих смесь.
Слайд 17
Виды диаграмм состояния сплавов и зависимость их свойств
от вида диаграммы
При концентрации, соответствующей химическому соединению, отмечается перелом
на кривой свойств (сингулярная точка). Это объясняется тем, что ХС обладают индивидуальными свойствами, обычно резко отличающимися от свойств образующих компонентов.
А.А.Бочвар показал, что существует определенная с вязь между диаграммой состояния и литейными свойствами.
Например, сплавы – твердые растворы, имеют низкие литейные свойства (плохая жидкотекучесть, склонны к образованию рассеянной
пористости и трещинам).
Эвтектические сплавы обладают хорошей жидкотоекчестью.
Слайд 18
Задание на дом
1.Ознакомиться с диаграммой состояния «Железо- Углерод».
Вывести ее и наклеить в тетрадь.
2. Провести самооценку успешности
обучения по предложенным критериям.
3. Самостоятельно построить в тетради для лабораторных работ диаграмму состояния второго типа.
4. Дополнить пункт 3.4. лекции «Основные понятия и определения»
Слайд 19
Самооценка успешности и результативности обучения
Показатели (критерии)
1. Посещаемость занятий
2.
«Прозрачность» учебной информации
3. Постоянство интереса к учебной информации
4. Практическая
полезность учебной информации
5. Личные достижения, академические успехи
6. Познавательная активность
7. Расширение кругозора
8. Степень и частота удивления
9. Стремление совершать дополнительные познавательные усилия
10. «Поумнение»
Сумма баллов /10