Слайд 2
1. Дисоціація води
2. Водневе число
3. Водневий показник
4. Загальна й активна кислотність
5. Індикатори
6. Зона віражу індикаторів
7. Колориметричний і електрометричний методи визначення рН
План
Слайд 3
8. Буферні розчини
9. Властивості буферних розчинів
10. Визначення рН буферним методом
11. Значення рН
і буферних розчинів
Ключові слова: гідрокарбонатний білковий, фосфатний, ацетатний буфер, водневий показник, водневе число.
Слайд 6
Вода – універсальний розчинник для більшості мінеральних і
органічних речовин.
Слайд 7
Організм тварини в середньому містить 65,9 % води,
жива клітина — 85, кора головного мозку — 83,3,
біологічні рідини — до 99,5 %. Вода — слабкий електроліт. Вона диссоциирует на іони водню і гідроксилу:
Н2О Н++ ОН-
Іон водню являє собою ядро атома водню без електрона — протон, діаметр якого в 105 разів менше діаметра інших іонів. Іон водню володіє вираженим електричним полем, легко гидратируєтся й утворить гидрооксид:
Н+ + Н2О Нз0+.
Гидроксоыий для зручності записують як Н+. Він міститься в багатьох природних рідинах, наприклад таких, як метанол (СНзОН+) і оцтова кислота (CH3COOH+2).
Слайд 8
Величина константи дисоціації води при 25 °С дорівнює
1,8•10-16. Методом електропровідності встановлено, що концентрація іонів водню в
1 л води при 22 °С дорівнює 10-7 міль. Це значить, що в 10 млн. л води в дисоційованому виді знаходиться лише 1 моль води (18 г), чи з 555 млн. молекул води 1 молекула дисоційована.
У зв'язку з тим, що у воді знаходиться мізерно мала кількість дисоційованих молекул, концентрацію недисоційованих молекул води приймають за константу. Якщо це виразити в молях, то на 1 л води одержують наступну кількість:
[Н2О] = 1000/18 = 55,56 моль.
Слайд 9
Концентрації іонів Н+ і ОН- — величини сполучені.
Щоб визначити реакцію середовища розчину, необхідно знати концентрацію одних
яких-небудь іонів — Н+ чи OH-1. Реакція середовища найчастіше визначається концентрацією іонів водню.
Водневе число
Слайд 10
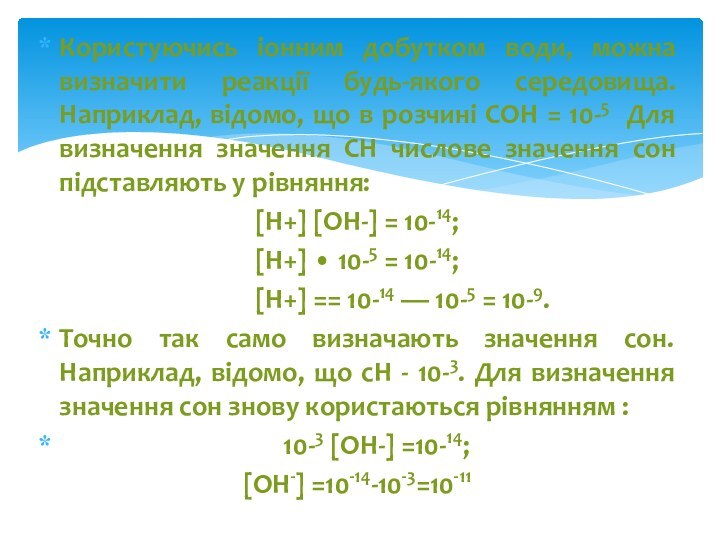
Користуючись іонним добутком води, можна визначити реакції будь-якого
середовища. Наприклад, відомо, що в розчині СОН = 10-5
Для визначення значення СН числове значення сон підставляють у рівняння:
[Н+] [ОН-] = 10-14;
[Н+] • 10-5 = 10-14;
[Н+] == 10-14 — 10-5 = 10-9.
Точно так само визначають значення сон. Наприклад, відомо, що сН - 10-3. Для визначення значення сон знову користаються рівнянням :
10-3 [ОН-] =10-14;
[ОН-] =10-14-10-3=10-11
Слайд 11
Визначення СН за допомогою лакмусового папірця дозволяє виділити
три середовища: кислу (від 10° до 10-7),- нейтральну (10-7)
і лужну (від 107 до 10-14). За числовим значенням СН у розчині реакції бувають наступні: сильнокислі (10° — 10-2), кислі
(10-2 — 10-5), слабкокислі (10-5 — 10-7), нейтральні (10-7), слабкощілочні (10-7 — 10-9), лужні
(10-9—10-12) і сильнощілочні (10-12 — 10-14).
Слайд 12
Водневий показник рн — величина, що характеризує концентрацію
(активність) іонів водню в розчинах. Він чисельно, дорівнює негативному
десятковому логарифму концентрації (активності) іонів Н+, вираженої в моль/л:
p=-lgc.
Водяні розчини можуть мати величину рН від 0 до 14. У чистій воді і нейтральних розчинах рН = 7, у кислих рН < 7 у лужних рН > 7.
Концентрація іонів Н+ і ОН" залежить від температури. Зі збільшенням температури ступінь дисоціації води зростає.
Водневий показник
Слайд 13
У різних розчинах міститься неоднакова кількість іонів Н+
і ОН-. При нейтралізації кислоти лугом іони Н+ і
ОН— з'єднуються в молекулу води. При титруванні кислоти лугом в остаточному підсумку беруть участь всі атоми кислотного водню. Вони і визначають загальну (аналітичну, чи титруєму) кислотність. Таким чином, загальною кислотністю називають кислотність, що визначається загальною кількістю кислотного водню, укладеного в одиницю об'єму..
Загальна активність і кислотність
Слайд 14
Загальна кислотність нормальних розчинів усіх кислот однакова, Вона
дорівнює 1 моль кислотного водню в 1 л 1
н. розчину, у децинормальних розчинах вона дорівнює 0,1 г/л, у сантинормальних—0,01 г/л і т.д.
Поняття загальної й активної кислотностей можна проілюструвати на двох кислотах — соляної й оцтової.
Активність кислот різна. Вона залежить від концентрації вільних іонів Н+ у розчинах обох кислот. Концентрація вільних іонів водню Н+ визначається загальною концентрацією кислотного водню, помноженої на ступінь дисоціації. Ступінь дисоціації в цих кислотах різна.
Слайд 15
Концентрація іонів кислотного водню дорівнює загальної концентрації кислоти
в 1 л, помноженої на ступінь дисоціації. Для соляної
кислоти:
З = 1 • 0,79 = 0,79 г/л,
а для оцтової кислоти:
З = 1 - 0,0034 г/л = 0,0034,
Обидва розчини -— однонормальні. Існує поняття «потенційна кислотність». Вона являє собою «запас» недисоційованих молекул кислоти і є різницею між загальною й активною кислотностями. Прикладом може бути та ж оцтова кислота:
[Сн3COOH] =. [CH3COO-] + [Н+].
Слайд 16
Розчини основ відрізняються один від іншого концентрацією іонів
ВІН-. Як і в розчинах кислот, розрізняють загальну, активну
і потенційну лужність.
Загальна лужність - показник, що характеризує властивість води, зумовлену наявністю у ній аніонів слабких кислот, головним чином вугільної кислоти (карбонатів, гідрокарбонатів).
Активна лужність – це концентрація гідроксид – аніонів.
Потенційна лужність – це концентрація недисоційованих молекул основи.
Слайд 17
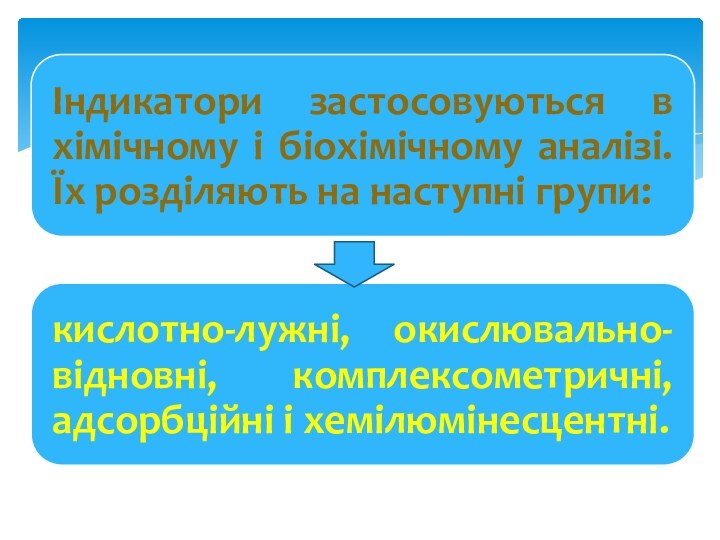
Індикатори (від лат. indico — указую) — речовини
за допомогою яких визначають рн середовища, установлюють крапку при
чи титруванні величину окислювально-відновного потенціалу.
По хімічних властивостях індикатори .є слабкими чи кислотами підставами. Застосовуються в невеликих кількостях — у виді декількох крапель. При дисоціації молекул індикатора виникає фарбування, по інтенсивності якої, визначається кількісне значення реакції середовища.
Індикатори
Слайд 19
З цих груп найбільший інтерес представляють кислотно-лужні індикатори.
Вони застосовуються для колориметричного методу визначення рн і в
хімічному аналізі (ацидометрія, алкаліметрія). Такі індикатори найчастіше є похідними трифепилметана чи інших циклічних органічних сполук. Їхньої молекули в залежності від сн можуть бути в дисоціюючому чи недисоціюючому стані. Реакція середовища прямо впливає і на ступінь дисоціації.
Слайд 20
За допомогою індикатора можна визначити значення рН. Область
значення рН, у межах якої відбувається помітне неозброєним оком
зміна кольору індикатора, називається зоною віражу, чи областю переходу фарбування індикатора. Для кожного індикатора існують нижня і верхня границі рн.
Зона віражу індикаторів
Слайд 21
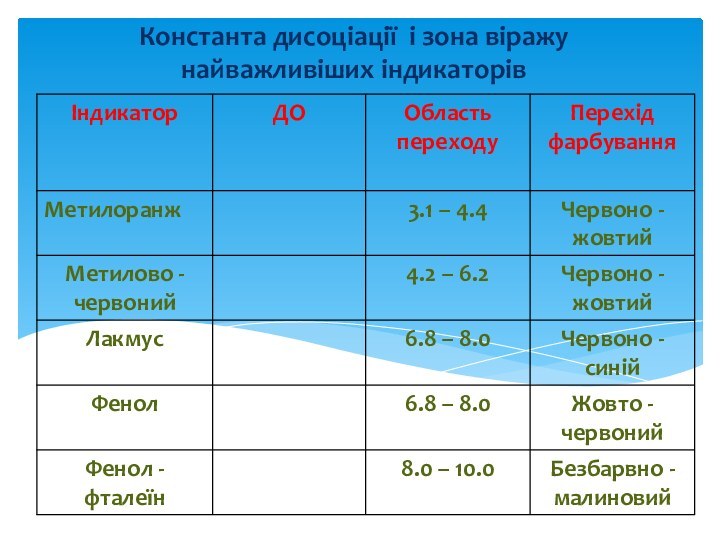
Константа дисоціації і зона віражу найважливіших індикаторів
Слайд 22
Водневий показник, дорівнює показнику константи дисоціації індикатора, називається
крапкою переходу. Індикатор у крапці переходу приймає проміжне фарбування.
Для
грубого визначення реакції середовища застосовуються універсальні індикатори, що представляють собою суміш.
Слайд 23
Колориметричний (від лат. color — колір і греч.
metric — вимірюю, визначаю) метод визначення рН заснований на
вимірі концентрації іонів Н+ у пофарбованому индикатором досліджуваному розчині в порівнянні з пофарбованим тим же індикатором розчином з відомою концентрацією тих же іонів (стандартним розчином).
Теоретичною основою застосування колориметричного методу є закон Ламберта — Бера (1760):
Колометричний і електрометричний методи визначення рН
Слайд 25
З даного закону випливає, що при рівному
поглинанні світла двома розчинами 'з який концентрація одного відома
(стандартного), концентрація іншого розчину буде така ж.
Одже колориметричний метод визначення рн має недоліки, які варто враховувати при проведенні точних досліджень рн (з точністю 0,01, 0,001 і т.д.).
По-перше, метод недостатньо точний — з його допомогою визначається рн із точністю ±0,1—0,2.
По-друге, ивдикатор сам є слабкою • чи кислотою слабкою підставою.
Слайд 26
Електрометричний метод визначення рн заснований на вимірі електрорушійної
сили
(э.д. с.), що виникає в результаті різниці потенціалів
двох електродів — електрода визначення й електрода порівняння. Потенціал електрода визначення залежить від концентрації іонів Н+ у досліджуваному розчині.
Для цих цілей застосовуються потенціометри і рН-метрі різних моделей.
Слайд 27
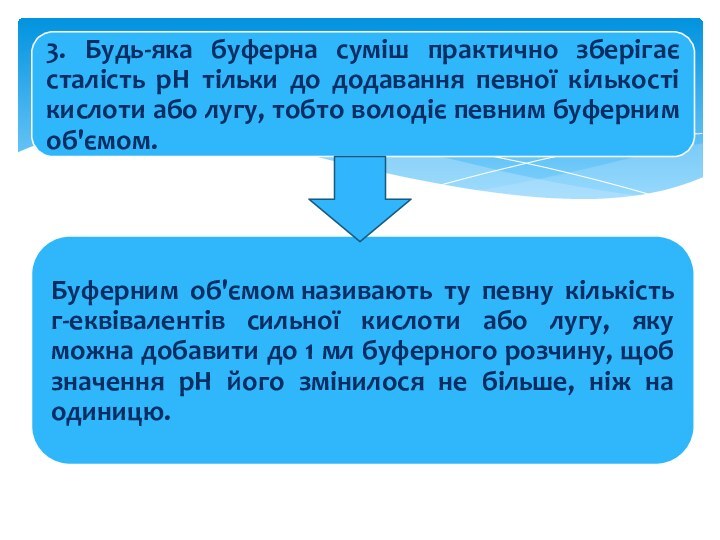
Буферні розчини — це розчини, що містять буферні
системи.
Буферними системами називаються суміші, у складі яких містяться
у визначеному кількісному співвідношенні слабкі кислоти і їхні солі із сильними чи підставами слабкі підстави і їх солі із сильними кислотами.
Буферні розчини
Слайд 28
Буферні розчини знаходяться у водах світового океану,
ґрунтових розчинах і живих організмах. Буферні розчини виконують таку
функцію:
Буферні розчини класифікуються:
кислотні основні
регуляторів, підтримуючих активну реакцію середовища при визначеному значенні, необхідному для успішного протікання реакцій обміну речовин.
Слайд 29
Також розрізняють природні і штучні буферні розчини:
Природним буферним
розчином є кров, що містить гідрокарбонатну, фосфатну, білкову, гемоглобиновую
і кислотну буферні системи.
Штучним буферним розчином може бути ацетатний буфер, що складається з:
СН3СООН
CH 3COONa
Особливості внутрішнього складу .і механізму дії буферних систем розглянемо на прикладі ацетатної буферної системи:
СН3СООН
СНзСООNа.
Слайд 33
Буферні розчини застосовуються для визначення рн. По таблицях
готують ряд стандартних буферних розчинів з поступово зростаючим значенням
рн. У пробірки з такими розчинами додають по трохи капель розчину чи індикатора індикаторів. Виникає кольорова шкала.
Для визначення рН невідомого розчину беруть пробірку, наливають така ж кількість розчину, як і в стандартній пробірці, і додають трохи крапля індикатора. З'являється фарбування. Пробірку поміщають у компаратор і підбирають відповідний еталон рН, приготовлений раніш. Збіг фарбування досліджуваного розчину з фарбуванням еталона свідчить про однакову концентрацію іонів Н+
Визначення рН буферним методом
Слайд 34
Концентрація іонів Н+ має важливе значення для плину
багатьох біохімічних процесів в організмах тваринах і рослинах. При
ацидозі збільшується зміст аніонів в організмі і величина рн може знижуватися на 0,2—0,5. Він приведе до коматозного стану і загибелі тварини. При алкалозі в крові зростає концентрація катіонів і підвищується числове значення рн. Алкалоз приведе до правцевого стану і загибелі тварини. Ці два патологічні стани часто носять аліментарний характер.
Значення рН і буферних розчинів
Слайд 35
Дані про оптимум рН для розвитку хвороботворних мікробів
варто враховувати при розробці мір боротьби з різними хворобами
людини і тварин. Так, оптимум рН для дифтерійного мікроба складає 7,3—7,6, кишкової палички — 6—7, пневмококів — 7,8.
Буферні розчини широко застосовуються при постановці гісто і цитохімічних реакцій на мікроскопічних чи зрізах відбитках органів і тканин рослин, тварин і людини. Вони необхідні для проведення біохімічного аналізу біологічних рідин, гомогенів і інших середовищ. Їх застосовують у бактеріології і вірусології, у біотехнології (для одержання в чистому виді кормових білків, амінокислот, антибіотиків, вітамінів, ферментів мікробного походження), при визначенні рн колориметричним (індикаторним) методом і ін.