- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Предельные углеводородыАлканы
Содержание
- 2. План.Определение. Общая формула класса углеводородов.Строение алканов.Гомологический ряд.Виды изомерии.Физические свойства.Способы получения.Химические свойства.Применение.
- 3. ОпределениеАлка́ны (также насыщенные углеводороды, парафины, алифатические соединения)
- 4. МетанДлина С-С – связи = 0,154 нм
- 5. Строение алкановАлканы являются насыщенными углеводородами и содержат
- 6. этанпентанМолекулы алканов имеют зигзагообразное пространственное строение, в
- 7. Гомологический ряд метана Предельные углеводороды образуют гомологический
- 8. сн 4 метансн3 – сн3 этансн3 –
- 9. ГОМОЛОГИЧЕСКИЙ РЯД МЕТАНАРадикал – это частица, имеющая не спаренные электроны.
- 10. Остановка «Разминка» При сгорании алкана массой 4,4г.
- 11. ПРОВЕРЬ13,2/44 =х/12Х=3,6М(С) = 3,6г.М(Н) = 4,4-3,6=0,8г.П(С) =
- 12. Радикалы в ряду алкановЕсли от молекулы алкана
- 13. Номенклатура международная ИЮПАК За
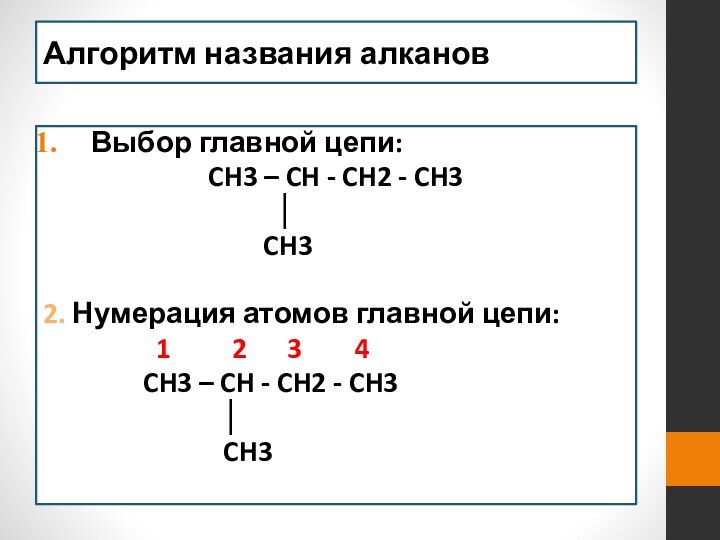
- 14. Алгоритм названия алканов Выбор главной цепи:CH3
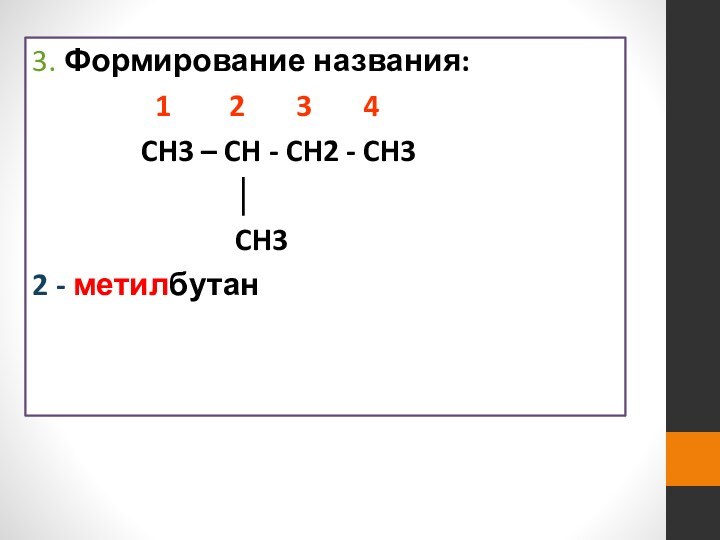
- 15. 3. Формирование названия:
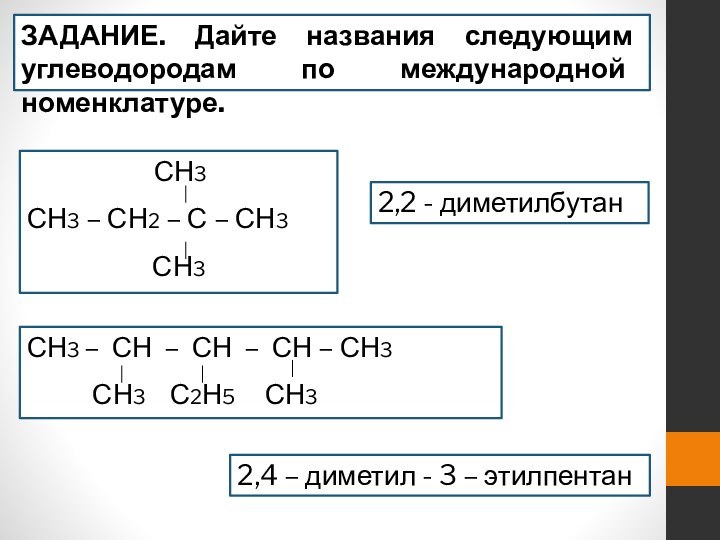
- 16. ЗАДАНИЕ. Дайте названия следующим углеводородам по международной
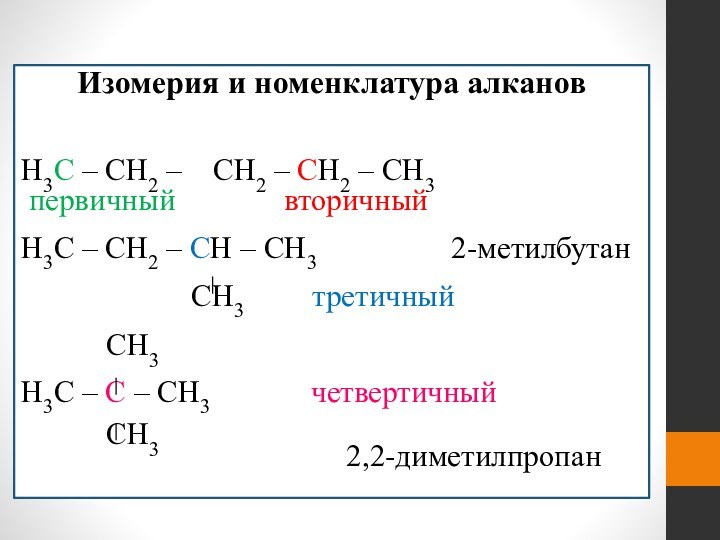
- 17. Изомерия и номенклатура алканов H3C – CH2
- 18. Изомерия Изомерия – явление, при котором
- 19. Структурная изомерия углеродного скелета Многочисленность углеводородов
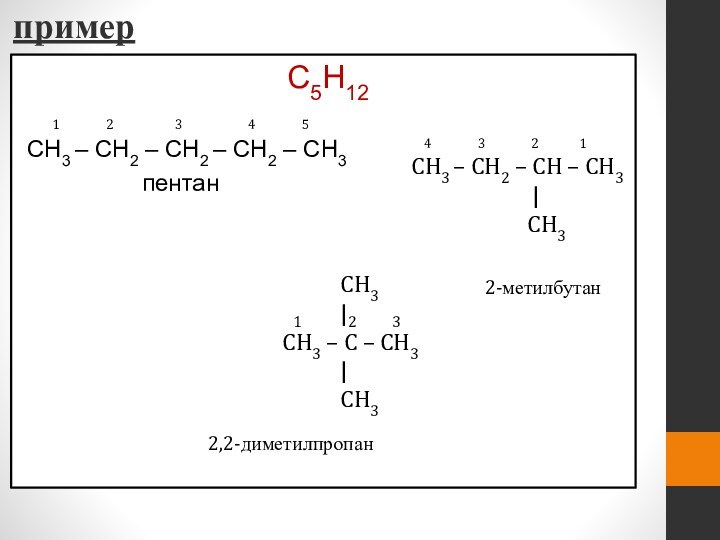
- 20. примерC5H12 CH3 – CH2 – CH2 – CH2
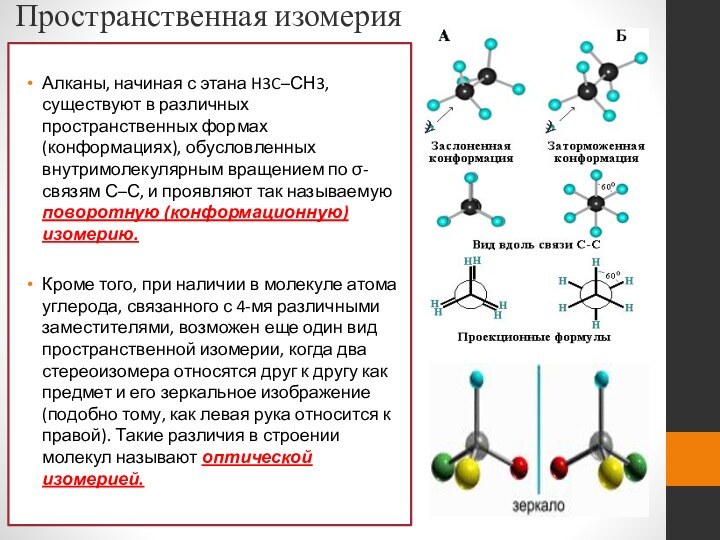
- 21. Пространственная изомерияАлканы, начиная с этана H3C–СН3, существуют
- 22. Физические свойства С увеличением относительных
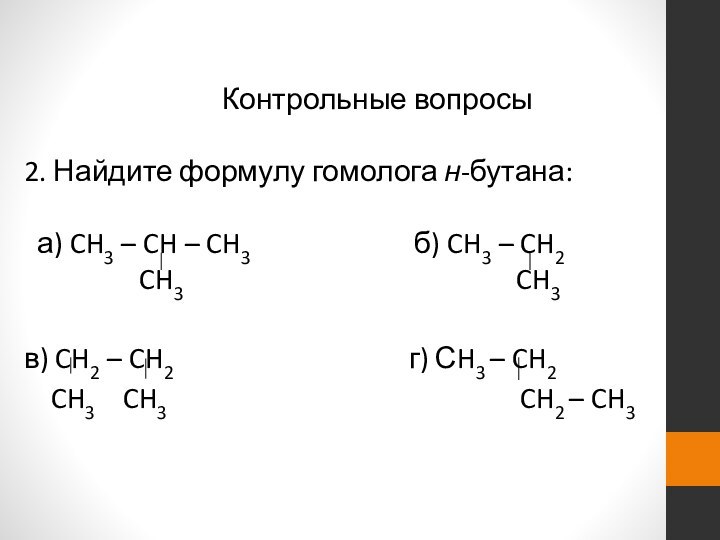
- 23. Контрольные вопросы2. Найдите формулу гомолога н-бутана: а)
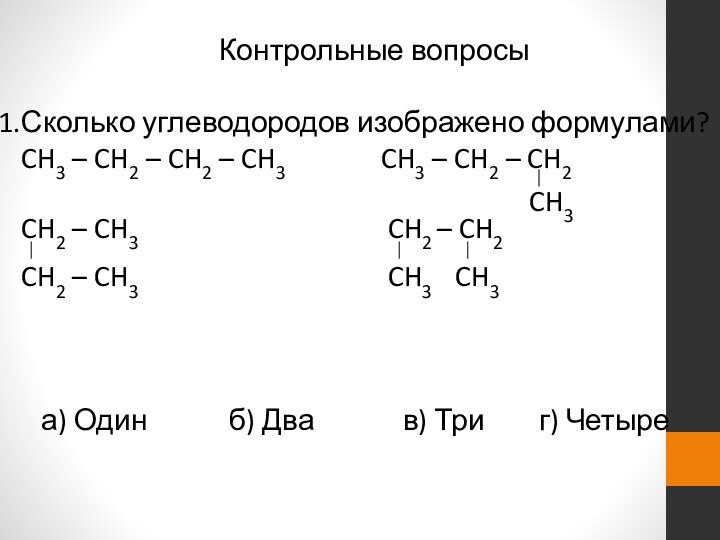
- 24. Контрольные вопросыСколько углеводородов изображено формулами?CH3 – CH2
- 25. 3. Вставьте в текст пропущенные термины и
- 26. Формула 2, 4-диметилгексана: а) CH3 – CH
- 27. Название углеводорода с формулой CH3
- 28. Получение алкановАлканы выделяют из природных источников (природный и попутный газы, нефть, каменный уголь).
- 29. Получение лабораторный способ Без изменения углеродного
- 30. Получение 2.С увеличением углеродного скелета.
- 31. б) взаимодействие галогеналканов с
- 32. в) Реакция Вюрца – Гриньяра CH3-Cl +
- 33. 3.С уменьшением углеродной цепи д) реакция декарбоксилирования
- 34. Получение метана1. Метан можно получить гидролизом карбида
- 35. Запомните! Алканы получают:1. Крекингом
- 36. C2H5ClC2H6
- 37. Химические свойстваПредельные углеводороды в обычных условияхне взаимодействуют
- 38. Химические свойства H
- 39. Химические свойства алкановРадикальное замещениеотщиплениеокислениеРазрушение цепиГалогенированиеНитрованиесульфированиеДегидрированиеАроматизацияГорениеКаталитическое окислениеПиролизКрекингизомеризация
- 40. Реакции замещения (по свободнорадикальному механизму) разрыв связей
- 41. +Механизм (реакция осуществляется в три стадии)Первая
- 42. Механизм Каждый последующий атом
- 43. Механизм Cl
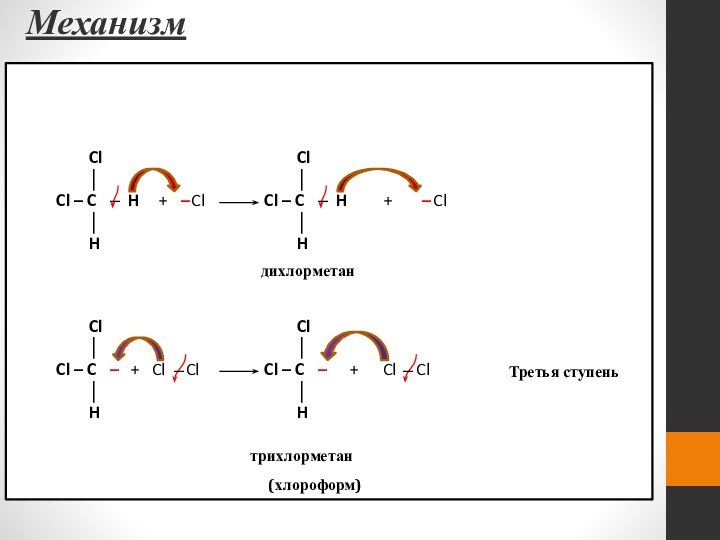
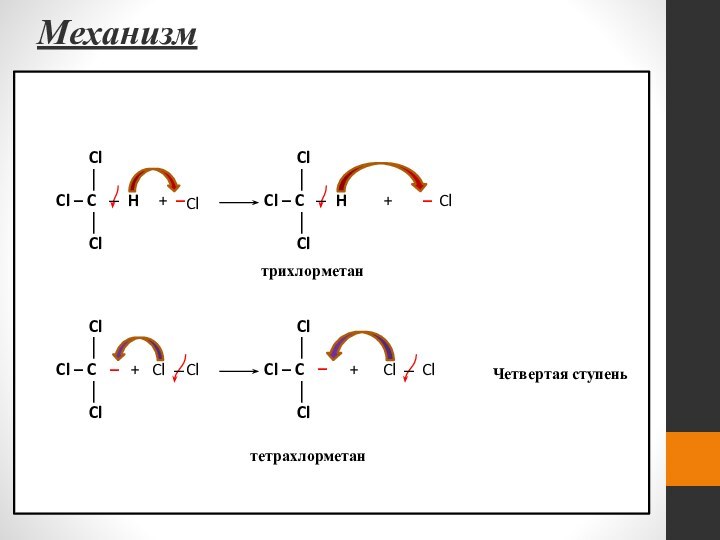
- 44. Механизм Cl
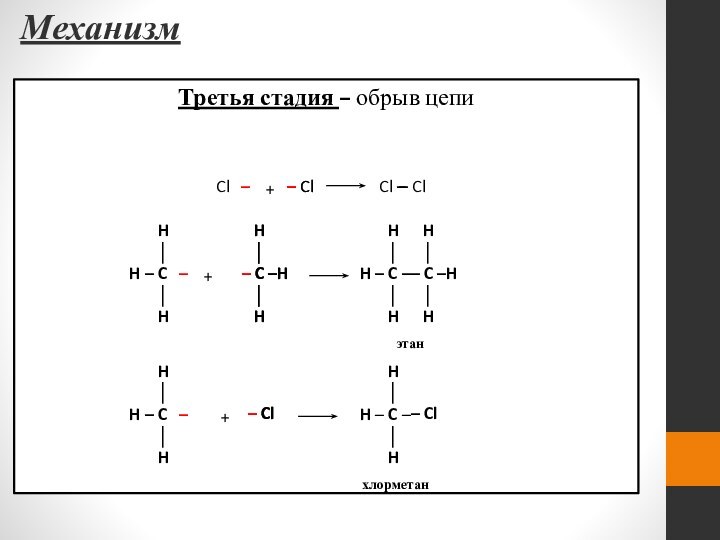
- 45. Механизм Третья стадия – обрыв цепи
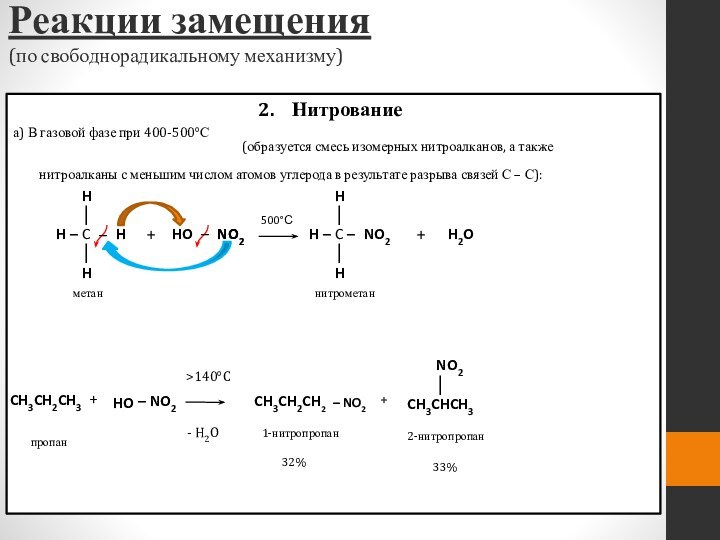
- 46. Нитрованиеа) В газовой фазе при 400-500°С
- 47. б) Реакция Коновалова М.
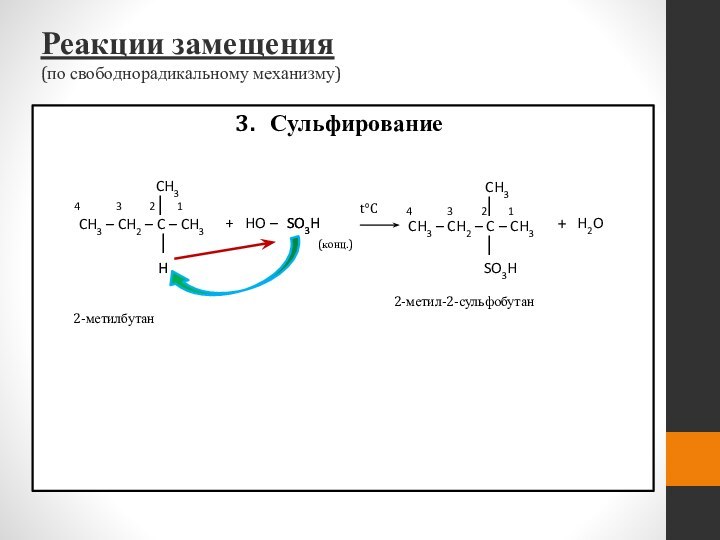
- 48. Сульфирование
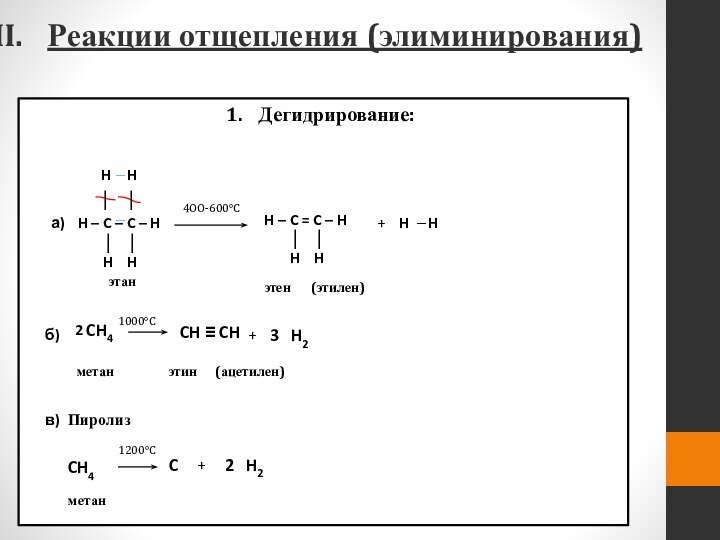
- 49. Реакции отщепления (элиминирования) Дегидрирование:
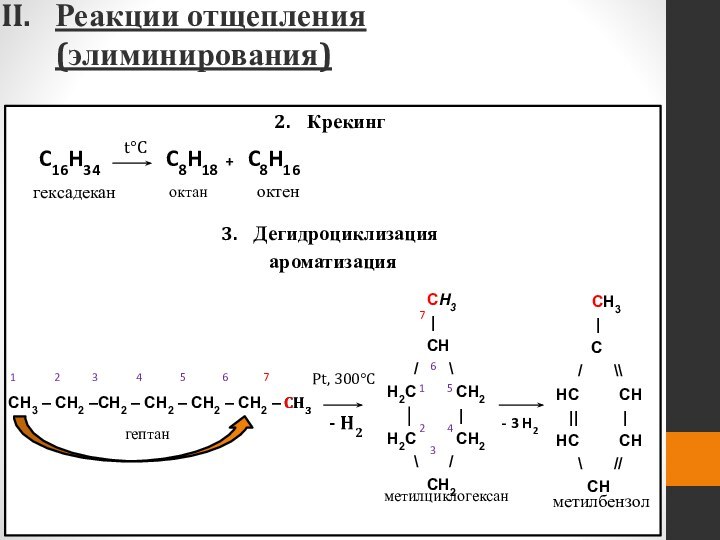
- 50. Реакции отщепления (элиминирования) Крекинг
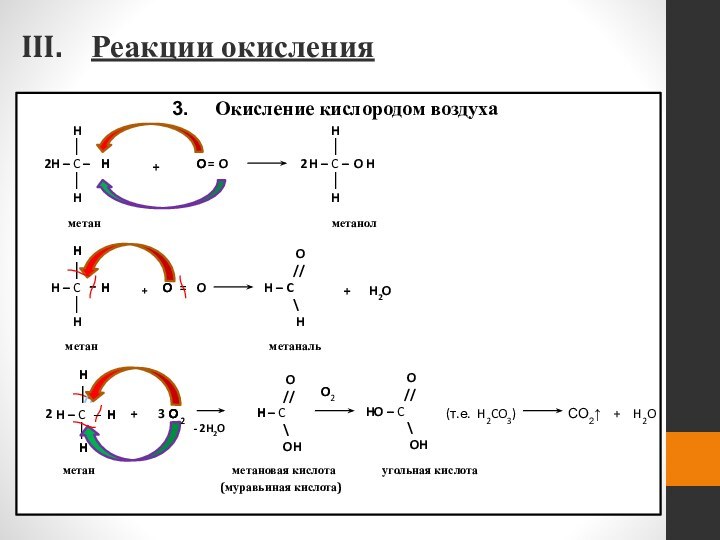
- 51. Реакции окисления Горение При обычных условиях устойчивы к действию окислителей (KMnO4, K2Cr2O7)
- 52. Окисление кислородом воздуха–Реакции окисления
- 53. Реакции изомеризации
- 54. Запомните! Для алканов характерны реакции замещения
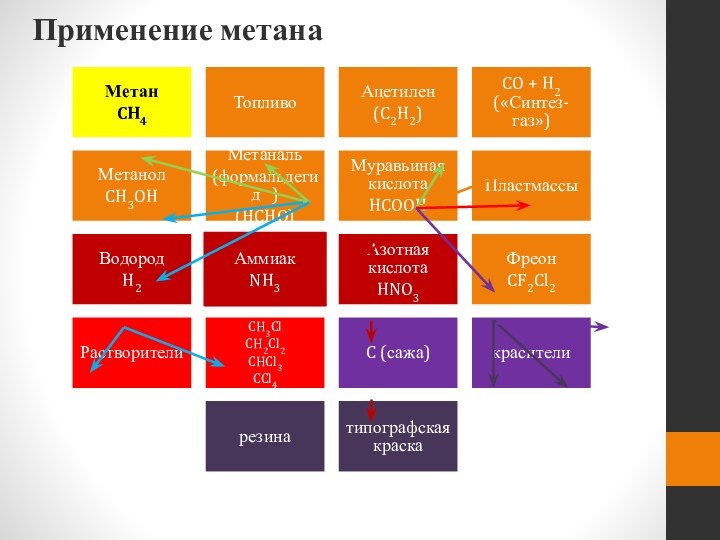
- 55. Применение метана
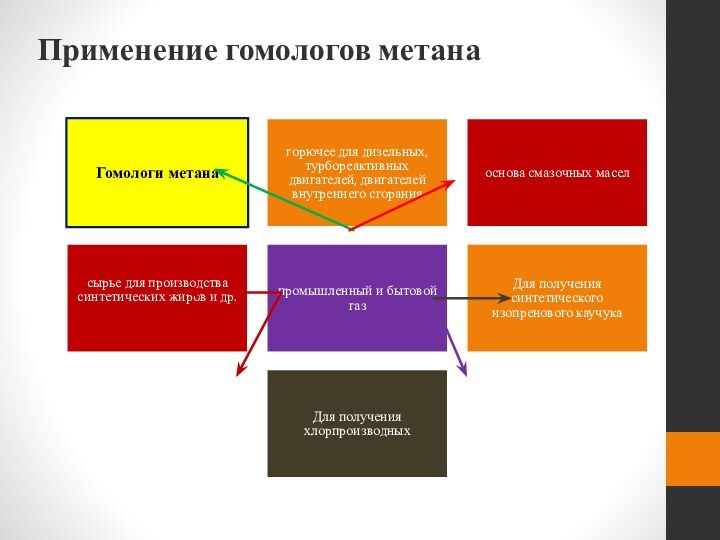
- 56. Применение гомологов метана
- 57. Применение алканов1-3 – производство сажи(1 – картрижи;2
- 58. смертельный враг шахтераС незапамятных времен горняки научились
- 59. Во льдах Антарктиды скрыт метан Под толщей
- 60. Палеоклиматологи установили, что причиной триасово-юрского вымирания, произошедшего
- 61. Во время ялтинского землетрясения 11 сентября 1927
- 62. Выбросы метанаОбразование в воде огромных пузырей, насыщенных
- 63. Кенгуру самые экологичные животные Австралийские учёные четыре
- 64. Газогидрат – это лед с высоким содержанием
- 65. Япония нашла источник энергетической независимостиЯпонское агентство природных
- 66. Смертельный враг шахтераМетан, или "гремучий газ",
- 67. Признаки отравления метаном Как правило, при
- 68. Проверка знанийКакие углеводороды относят к алканам?Запишите формулы
- 69. Скачать презентацию
- 70. Похожие презентации












































Слайд 2
План.
Определение. Общая формула класса углеводородов.
Строение алканов.
Гомологический ряд.
Виды изомерии.
Физические
свойства.
Слайд 3
Определение
Алка́ны (также насыщенные углеводороды, парафины, алифатические соединения) —
ациклические углеводороды линейного или разветвлённого строения, содержащие только простые
связи и образующие гомологический ряд с общей формулойCnH2n+2
Алканы – название предельных углеводородов по международной номенклатуре. Парафины– исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis –малоактивный). Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода.
Слайд 4
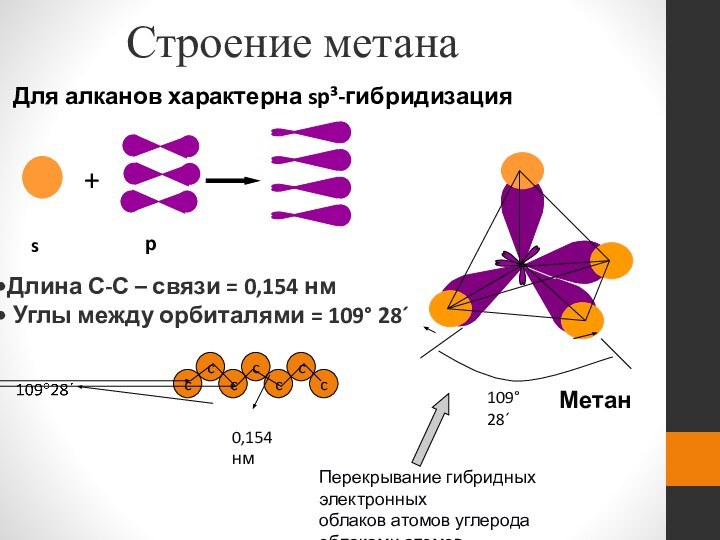
Метан
Длина С-С – связи = 0,154 нм
Углы
между орбиталями = 109° 28´
Перекрывание гибридных электронных
облаков атомов
углерода облаками атомовводорода (молекула метана).
109°28´
Строение метана
р
0,154 нм
Для алканов характерна sp³-гибридизация
Слайд 5
Строение алканов
Алканы являются насыщенными углеводородами и содержат максимально
возможное число атомов водорода.
Каждый атом углерода находится в
состоянии sp3-гибридизации — все 4 гибридные орбитали равны по форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28'. За счёт одинарных связей между атомами С возможно свободное вращение вокруг углеродной связи.
Тип углеродной связи — σ-связи, связи малополярны и плохо поляризуемы.
Длина углеродной связи — 0,154 нм.
Энергия связи С-С 348 кДж
Простейшим представителем
класса является метан (CH4).
Слайд 6
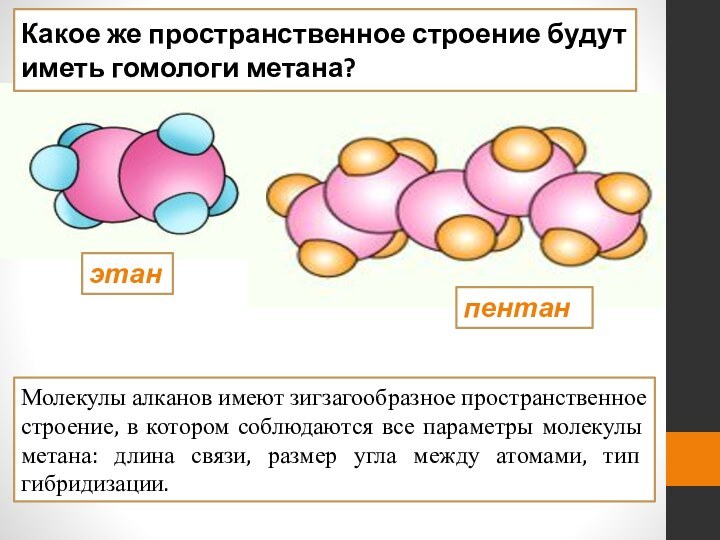
этан
пентан
Молекулы алканов имеют зигзагообразное пространственное строение, в котором
соблюдаются все параметры молекулы метана: длина связи, размер угла
между атомами, тип гибридизации.Какое же пространственное строение будут иметь гомологи метана?
Слайд 7
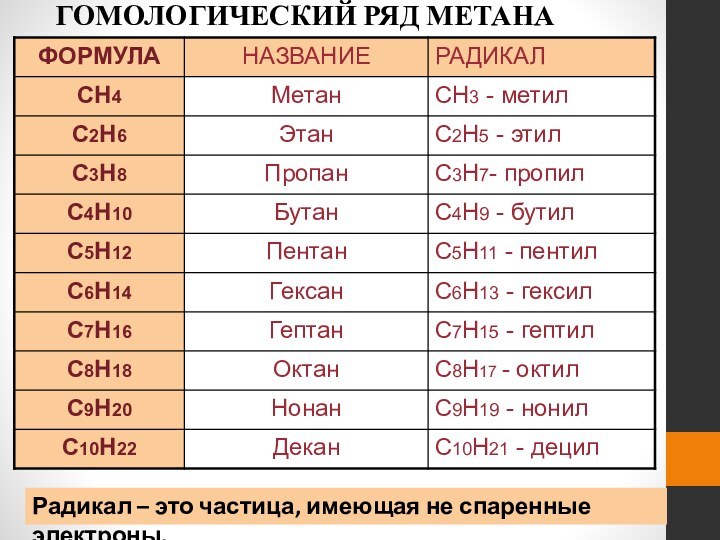
Гомологический ряд метана
Предельные углеводороды образуют
гомологический ряд с
общей формулой
CnH2n+2. Родоначальником этого ряда является метан.
Гомологи – это соединения, сходные по
строению и химическим
свойствам, и
отличающиеся
друг от друга на одну
или несколько метильных
групп CH2,
Слайд 8
сн 4 метан
сн3 – сн3 этан
сн3 – сн2
– сн3 пропан
сн3 – сн2 – сн2 – сн3
бутансн3 – сн2 – сн2 – сн2 – сн3 пентан
сн3 – сн2 – сн2 – сн2 – сн2 – сн3
сн3 – сн2 – сн2 – сн2 – сн2 – сн2 – сн3 гептан
гексан
Слайд 10
Остановка «Разминка»
При сгорании алкана массой 4,4г. образуется
оксид углерода (4) получили 13,2г. Определите молекулярную формулу вещества.
Слайд 11
ПРОВЕРЬ
13,2/44 =х/12
Х=3,6
М(С) = 3,6г.
М(Н) = 4,4-3,6=0,8г.
П(С) = 3,6/12
= 0,3моль
П(Н) = 0,8/1 = 0,8моль
0,3 : 0,8 =
3 : 8С3Н8
Слайд 12
Радикалы в ряду алканов
Если от молекулы алкана "отнять"
один атом водоpода, то обpазуется одновалентный "остаток" – углеводоpодный
pадикал (R).Общее название одновалентных радикалов алканов – алкилы – обpазовано заменой суффикса -ан на -ил:
метан – метил, этан – этил, пpопан – пpопил и т.д.
Слайд 13
Номенклатура международная ИЮПАК
За основу принимают название углеводорода, которому
соответствует в рассмотренном соединении самая длинная цепь.
Эта цепь нумеруется,
начиная с того конца, к которому ближе радикал-заместитель.В названии вещества цифрой показывают место радикала-заместителя и называют заместитель.
Затем называют углеводород, которому отвечает главная цепь.
Слайд 14
Алгоритм названия алканов
Выбор главной цепи:
CH3 – CH -
CH2 - CH3
│CH3
2. Нумерация атомов главной цепи:
1 2 3 4
CH3 – CH - CH2 - CH3
│
CH3
Слайд 16
ЗАДАНИЕ. Дайте названия следующим углеводородам по международной номенклатуре.
СН3
СН3 – СН2 – С – СН3
СН3
2,2 - диметилбутан
СН3 – СН – СН – СН – СН3
СН3 С2Н5 СН3
2,4 – диметил - 3 – этилпентан
Слайд 17
Изомерия и номенклатура алканов
H3C – CH2 –
CH2 – CH2 – CH3
первичный
вторичныйH3C – CH2 – CH – CH3 2-метилбутан
CH3 третичный
CH3
H3C – C – CH3 четвертичный
CH3
2,2-диметилпропан
Слайд 18
Изомерия
Изомерия – явление, при котором вещества,
имеющие один и
тот же качественный и
количественный состав, отличаются по своим
свойствам.
Изомеры
– химические соединения, имеющие одинаковый состав и молекулярную массу,
но отличающиеся строением молекул,
физическими и химическими свойствами.
Слайд 19
Структурная изомерия углеродного скелета
Многочисленность углеводородов объясняется явлением
изомерии.
С
возрастанием числа атомов углерода в молекуле число изомеров резко
увеличивается.В ряду алканов структурная изомерия проявляется начиная с бутана С4Н10
у бутана – 2,
у пентана -3,
у гексана – 5,
у декана – 75.
CH3-CH2-CH2-CH3 CH3 – CH – CH3
н-бутан |
CH3
2-метилпропан
Слайд 20
пример
C5H12
CH3 – CH2 – CH2 – CH2 –
CH3
пентан 4 3 2 1
CH3 – CH2 – CH – CH3
|
CH3
2-метилбутан
CH3
|
CH3 – C – CH3
|
CH3
1 2 3
2,2-диметилпропан
1 2 3 4 5
Слайд 21
Пространственная изомерия
Алканы, начиная с этана H3C–СН3, существуют в
различных пространственных формах (конформациях), обусловленных внутримолекулярным вращением по σ-связям
С–С, и проявляют так называемую поворотную (конформационную) изомерию.Кроме того, при наличии в молекуле атома углерода, связанного с 4-мя различными заместителями, возможен еще один вид пространственной изомерии, когда два стереоизомера относятся друг к другу как предмет и его зеркальное изображение (подобно тому, как левая рука относится к правой). Такие различия в строении молекул называют оптической изомерией.
Слайд 22
Физические свойства
С увеличением относительных молекулярных
масс предельных углеводородов закономерно повышаются их температуры кипения и
плавления.Все алканы бесцветные вещества, легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями.
СН4…C4Н10 – газы
T кипения:
-161,6…-0,5 °C
С16Н34…и далее– твёрдые вещества
T кипения:
287,5 °C
С5Н12…C15Н32 – жидкости
T кипения:
36,1…270,5 °C
Слайд 23
Контрольные вопросы
2. Найдите формулу гомолога н-бутана:
а) CH3
– CH – CH3
б) CH3 – CH2CH3 CH3
в) CH2 – CH2 г) СH3 – CH2
CH3 CH3 CH2 – CH3
Слайд 24
Контрольные вопросы
Сколько углеводородов изображено формулами?
CH3 – CH2 –
CH2 – CH3
CH3 – CH2 – CH2CH3
CH2 – CH3 CH2 – CH2
CH2 – CH3 CH3 CH3
а) Один б) Два в) Три г) Четыре
Слайд 25
3. Вставьте в текст пропущенные термины и символы.
Алканами
называются углеводороды, в молекулах которых все атомы связаны…связями. Их
общая формула…. Все атомы углерода в алканах находятся в состоянии… – гибридизации. Оси гибридных орбиталей направлены по вершинам правильного…, угол между ними составляет…. Относительно одинарных С – С связей…свободное вращение.4. Исключите лишнее вещество:
а) C3H8, б) C6H12, в) C4H10, г) CH4.
Для алканов характерна изомерия:
а) углеводородного скелета, б) положение кратной связи,
в) положение функциональной группы,
г) геометрическая.
Слайд 26
Формула 2, 4-диметилгексана:
а) CH3 – CH –
CH2 – CH – CH2 – CH2 – CH3
CH3 CH3б) CH3 – CH2 – CH – CH – CH2 – CH3
CH3 CH3
в) CH3 – CH – CH2 – CH – CH3
CH3 CH3
г) CH3 – CH2 – CH2 – CH – CH2– CH3
CH3 CH3
Слайд 27
Название углеводорода с формулой
CH3
– CH2 – CH2 – CH – CH3:
CH3а) 4-метилпентан, б) 2-метилпропан,
в) 3-метилпентан, г) 2-метилпентан.
Углеводороды с формулами C6 H12 и C6H14 являются:
а) изомерами,
б) гомологами,
в) верного ответа в перечисленных нет.
Слайд 28
Получение алканов
Алканы выделяют из природных источников (природный и
попутный газы, нефть, каменный уголь).
Слайд 29
Получение лабораторный способ
Без изменения углеродного скелета.
а) гидрирование непредельных или циклических углеводородов в присутствии катализаторов
(платины, палладия, никеля).kat
CH3 –CH=CH–CH3 + H2 → CH3–CH2–CH2–CH3
C3H6 + H2 → CH3 –CH2 –CH3
Слайд 30
Получение
2.С увеличением углеродного скелета.
б) Реакция
Вюрца, заключающаяся в действии металлического натрия на моногалогенопроизводные углеводородов.
2CH3–CH2Br
+ 2Na → CH3–CH2–CH2–CH3 +2NaBrЕсли в реакцию вступают разные галогенпроизводные алканов, то в результате реакции получается смесь органических веществ.
Слайд 31 б) взаимодействие галогеналканов с активными
металлами (реакция А. Вюрца):
происходит димеризация углеродной
цепи исходного галогеналкана с образованием алкана с четным числом атомов углерода в цепи:
Механизм реакции Вюрца
– Br
Na
R
– Br
Na
R
│
+
+
Na
– Br
R
R
– Br
Na
2
+
CH3
CH3
–
2
Na
+
– Br
2
CH3
– Br
Na
6
+
R′
–
R′
+
R′
–
R
+
R
–
R
Na
6
+
– Br
R′
3
+
– Br
R
3
–
–
– Br
– Br
– Br
Na
Na
Na
Если в реакции участвуют разные галогеналканы, то образуется смесь алканов:
3
CH3
– Br
+
3
C2H5
– Br
+
6
Na
CH3
CH3
–
+
CH3
–
C2H5
+
C2H5
C2H5
–
+
6
Na
– Br
этан
пропан
бутан
бромметан
бромэтан
│
Слайд 32
в) Реакция Вюрца – Гриньяра
CH3-Cl + Mg
– эфир → CH3-Mg-Cl
CH3-Mg-Cl + Cl-CH2-CH3 → CH3-CH2-CH3 +
MgCl2 г) Электролиз по Кольбе
э.ток на аноде на катоде
2CH3-COONa + 2H2O → CH3-CH3 + 2CO2 + H2 +2NaOH
Слайд 33
3.С уменьшением углеродной цепи
д) реакция декарбоксилирования (р.
Дюма)
В лабораторной практике алканы получают при сплавлении солей карбоновых
кислот со щелочами. t°
CH3COONa (тв) + NaOH (тв) → CH4 + Na2CO3
Е) Крекинг нефти (промышленный способ)
C4H10 → C2H4 + C2H6 t° 450 - 700
алкен алкан
Слайд 34
Получение метана
1. Метан можно получить гидролизом карбида алюминия.
Al4C3
+ 12H2O → 3CH4 + 4Al(OH)3
2. Газификация твердого топлива
(при повышенной температуре и давлении, катализатор Ni): C + H2 = CH4
3. В промышленности из синтез-газа (СО + Н2) получают смесь алканов:
CO + H2 = СnH2n+2 + H2O преимущественно метан
Слайд 35
Запомните!
Алканы получают:
1. Крекингом нефти;
2. Из природного
и попутного газа;
3. Из солей карбоновых кислот (реакция Дюма);
4.
Из галогеналканов (синтезы Вюрца);5. Электролизом по Кольбе.
Слайд 36
C2H5Cl
C2H6
CH3Cl
CH4
C
9. Метан в промышленности получают главным образом:
а) из
реакции Вюрца, б) из природного газа,в) коксованием каменного угля, г) гидролизом карбида алюминия.
10. Для алканов характерны реакции:
а) присоединение, б) замещение, в) полимеризации
11. Какая из реакций алканов протекает при облучении смеси исходных веществ светом?
а) крекинг, б) дегидрирование, в) хлорирование,
г) горение.
12. Составьте уравнение реакции, при помощи которых можно осуществить следующие превращения:
Слайд 37
Химические свойства
Предельные углеводороды в обычных условиях
не взаимодействуют ни
с концентрированными
кислотами, ни со щелочами, ни даже с
такимактивным реагентом как перманганат калия.
Для них свойственны реакции замещения
водородных атомов и расщепления.
Эти реакции вследствие прочности связей
C–C и C–H
протекают или при нагревании, или на свету, или
с применением катализаторов.
Слайд 38
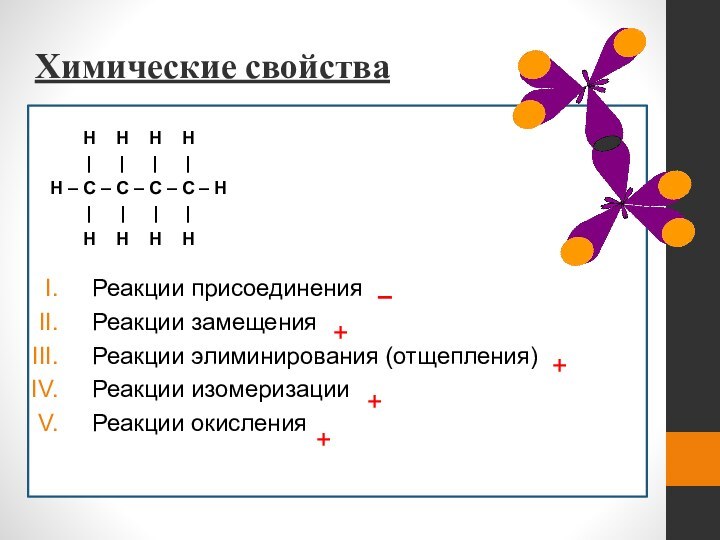
Химические свойства
H H
H H
|
| | |H – C – C – C – C – H
| | | |
H H H H
Реакции присоединения
Реакции замещения
Реакции элиминирования (отщепления)
Реакции изомеризации
Реакции окисления
–
+
+
+
+
Слайд 39
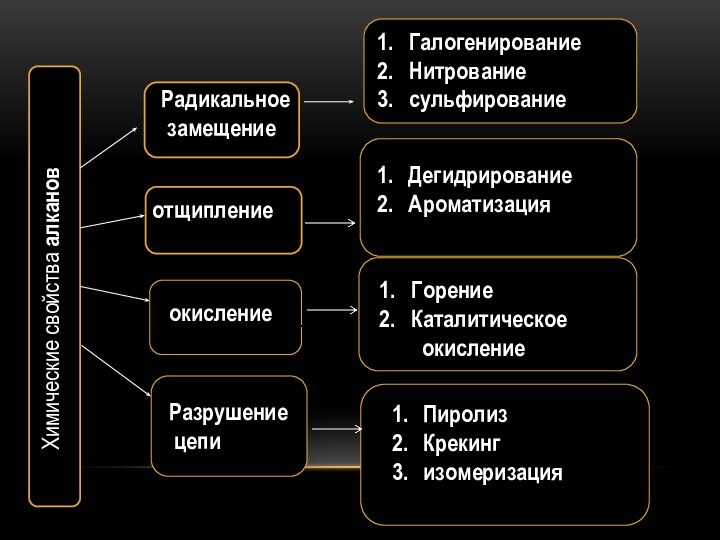
Химические свойства алканов
Радикальное
замещение
отщипление
окисление
Разрушение
цепи
Галогенирование
Нитрование
сульфирование
Дегидрирование
Ароматизация
Горение
Каталитическое
окисление
Пиролиз
Крекинг
изомеризация
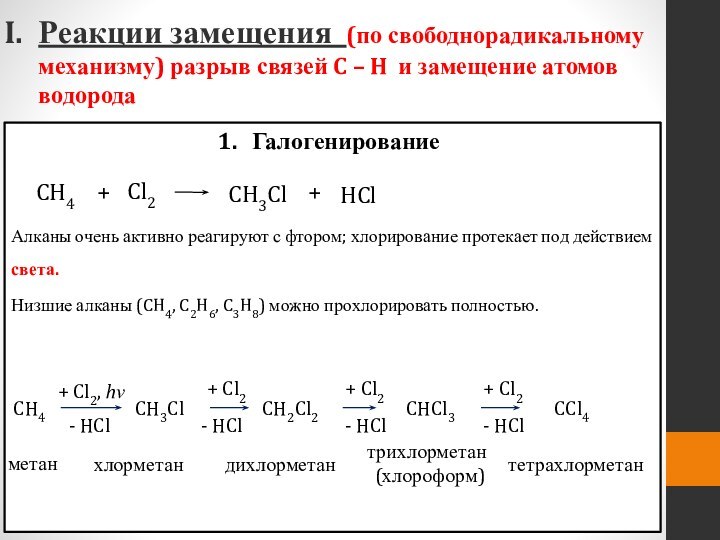
Слайд 40 Реакции замещения (по свободнорадикальному механизму) разрыв связей C
– H и замещение атомов водорода
Галогенирование
Алканы очень активно реагируют
с фтором; хлорирование протекает под действием света.Низшие алканы (CH4, C2H6, C3H8) можно прохлорировать полностью.
CH3Cl
+
HCl
Cl2
+
CH4
Слайд 41
+
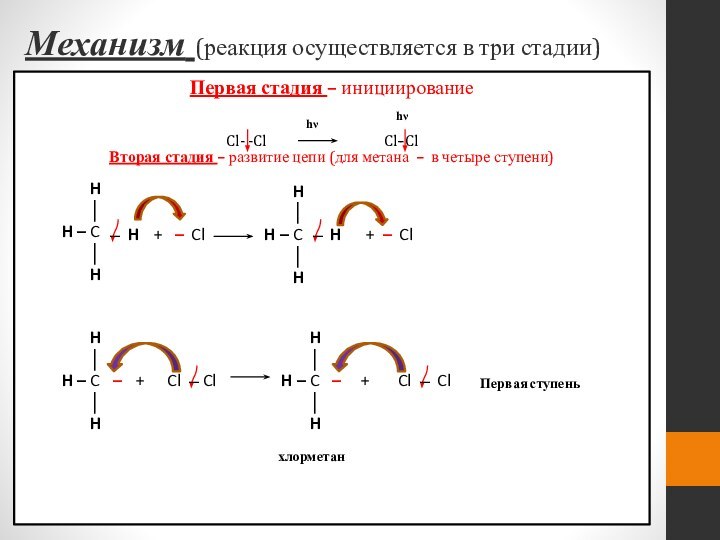
Механизм (реакция осуществляется в три стадии)
Первая стадия
– инициирование
Вторая стадия – развитие цепи (для метана –
в четыре ступени)hν
H
│
H – C
│
H
H
+
H
│
H – C
│
H
+
Cl
H
│
H – C
│
H
+
H
│
H – C
│
H
Cl
Cl
+
Первая ступень
хлорметан
Cl-
-Cl
Cl-
-Cl
hν
Cl
H
Cl
Cl
–
–
–
–
–
–
–
–
Слайд 42
Механизм
Каждый последующий атом водорода
в молекуле алкана замещается легче, чем предыдущий
Cl│
H – C
│
H
Cl
H
+
Cl
Cl
│
H – C
│
H
H
+
Cl
дихлорметан
Вторая ступень
Cl
│
H – C
│
H
+
Cl
Cl
│
H – C
│
H
+
Cl
Cl
хлорметан
–
–
–
–
–
–
–
–
Слайд 43
Механизм
Cl
│
Cl – C
│H
Cl
H
+
Cl
Cl
│
Cl – C
│
H
H
+
Cl
трихлорметан
Третья ступень
Cl
│
Cl – C
│
H
+
Cl
Cl
│
Cl – C
│
H
+
Cl
Cl
дихлорметан
(хлороформ)
–
–
–
–
–
–
–
–
Слайд 44
Механизм
Cl
│
Cl – C
│Cl
Cl
H
+
Cl
Cl
│
Cl – C
│
Cl
H
+
Cl
тетрахлорметан
Четвертая ступень
Cl
│
Cl – C
│
Cl
+
Cl
Cl
│
Cl – C
│
Cl
+
Cl
Cl
трихлорметан
–
–
–
–
–
–
–
–
Слайд 45
Механизм
Третья стадия – обрыв цепи
Cl
–
Cl
+
Cl –
– Cl
H
│ H – C
│
H
H
│
– C –H
│
H
+
H
│
H – C –
│
H
H
│
– C –H
│
H
этан
H
│
H – C
│
H
– Cl
+
H
│
H – C –
│
H
– Cl
хлорметан
–
– Cl
–
H
│
– C –H
│
H
–
– Cl
Слайд 46
Нитрование
а) В газовой фазе при 400-500°С
HO
Реакции замещения
(по свободнорадикальному механизму)
H
│
H – C
│
H
H
+
NO2
H
│
H – C –
│
H
NO2
+
H2O
500°С
H
NO2
CH3CH2CH3
+
NO2
│
CH3CHCH3
>140°C
1-нитропропан
+
32%
2-нитропропан
33%
- H2O
пропан
метан
нитрометан
–
–
(образуется смесь изомерных нитроалканов, а также
нитроалканы с меньшим числом атомов углерода в результате разрыва связей С – С):
Слайд 47 б) Реакция Коновалова М. И.:
взаимодействие с разбавленной азотной кислотой при 140°С и при
повышенном или нормальном давлении – образуется смесь изомерных нитросоединений (легче всего замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного).H
+
Реакции замещения
(по свободнорадикальному механизму)
H2O
+
2-метил-2-нитробутан
2-метилбутан
CH3
│
CH3 – CH2 – C – CH3
│
140°C
NO2
(разб.)
NO2
–
HO
4 3 2 1
CH3
│
CH3 – CH2 – C – CH3
H
4 3 2 1
NO2
│
Слайд 48
Сульфирование
Реакции замещения
(по свободнорадикальному механизму)
2-метилбутан
SO3H
2-метил-2-сульфобутан
CH3
│
CH3 – CH2 – C – CH3
│
+
H2O
t°C
+
HO –
CH3
│
CH3 – CH2 – C – CH3
│
SO3H
H
H
(конц.)
SO3H
4 3 2 1
4 3 2 1
Слайд 49
Реакции отщепления (элиминирования)
Дегидрирование:
H – C – C – H
│ │
H H
H
H
│
│
4OO-600°C
а)
этан
этен
(этилен)
б)
в)
H – C = C – H
│ │
H H
+
H
H
CH4
этин
(ацетилен)
метан
1000°C
CH ≡ CH
+
H2
3
H2
CH4
Пиролиз
1200°C
C
2
+
2
метан
–
–
–
Слайд 50
Реакции отщепления (элиминирования)
Крекинг
Дегидроциклизация
(ароматизация)
C16H34
t°C
гексадекан
C8H16
C8H18
+
октан
октен
Pt, 300°C
гептан
метилбензол
CH3
|
C
/ \\
HC CH
|| |
HC CH
\ //
CH
- 3 H2
- H2
метилциклогексан
Слайд 51
Реакции окисления
Горение
При обычных
условиях устойчивы к действию окислителей (KMnO4, K2Cr2O7)
Слайд 52
Окисление кислородом воздуха
–
Реакции окисления
H
│
H – C –
│H
H
O
+
+
2
H
│
H – C –
│
H
O
H
H – C
│
H
H
O
O
//
H – C
\
H
+
H2O
+
3
2
O
//
– C
\
OH
метан
метанол
метаналь
метан
метан
метановая кислота
(муравьиная кислота)
H
- H2O
O
//
HO – C
\
OH
угольная кислота
(т.е. H2CO3)
CO2↑
+
H2O
=
O
H
O
2
│
H
O
=
//
O
H
H
│
H – C
│
│
H
H
H
H
O
O2
O
//
H
H
H
O
│
2
2
O
2
–
Слайд 53
Реакции изомеризации
Образование
синтез-газа
CH4
+
+
H2O
t°C, Kt
CO
H2
3
CH3
|
CH3 – CH – CH3
CH3 – CH2 – CH2 – CH3
метилпропан
бутан
Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации – перестройке углеродного скелета с образованием алканов разветвленного строения.
Слайд 54
Запомните!
Для алканов характерны реакции замещения атомов водорода
на другие атомы или группы атомов.
В этих реакциях водород
никогда не выделяется, а образуется галогеноводород.Замещение у алканов идет в первую очередь по менее гидрогенизированному атому углерода.
Слайд 57
Применение алканов
1-3 – производство сажи
(1 – картрижи;
2 –
резина;
3 – типографическая краска)
4-7 – получение
органических веществ
(4 –
растворителей;5 – хладогентов,
используемых
в холодильных установках;
6 – метанол;
7 - ацетилен)
Слайд 58
смертельный враг шахтера
С незапамятных времен горняки научились отслеживать
своего врага. Сто лет назад они брали под землю
клетку с канарейкой, и пока слышалось пение птицы можно было работать спокойно: в шахте нет гремучего газа. Если же канарейка замолкала на долгое время, а еще хуже — навсегда, значит — рядом смерть.В наши дни канарейку заменили головные светильники, совмещенные с метаноискателями.
Слайд 59
Во льдах Антарктиды скрыт метан
Под толщей льда
Антарктиды
находится несколько миллиардов
тонн метана, который при
глобальном
потеплении можетвысвободиться и погубить все
живое на Земле.
Колоссальные запасы были созданы на большой глубине микроорганизмами, которые питаются остатками
древних деревьев.
Метан, согласно расчетам специалистов, находятся на глубине более 3 км, поэтому бурить лед для проверки теории оказалось дорогостоящей затеей. Вместо этого ученые отпилили небольшие части с краев ледника, в которых были обнаружены способные к выработке метана микробы. После этого микроорганизмы на два года были помещены в холодную среду без света и кислорода.
Слайд 60 Палеоклиматологи установили, что причиной триасово-юрского вымирания, произошедшего 200
миллионов лет назад, мог стать колоссальный выброс метана в
атмосферу.Считается, что причиной вымирания стало резкое изменение климата. В качестве основной причины этого изменения называются выбросы углекислого газа в атмосферу, связанные с высокой вулканической активностью. Новые результаты показывают, что причина была не в углекислом газе, а в метане, который хранился в виде гидратов в вечной мерзлоте и на дне океанов.
В результате ученые установили, что в изучаемый период в атмосферу было выброшено около 12 триллионов тонн метана,
при этом парниковый эффект
от этого газа в десятки раз
сильнее эффекта от CO2.
Слайд 61 Во время ялтинского землетрясения 11 сентября 1927 года
загорелось Черное море… Очевидцы трагедии рассказывают, что огонь простирался
на десятки километров в море. По стечению обстоятельств во время землетрясения была гроза, молнии били в море, поджигая поднятый землетрясением к поверхности метан (им очень богато дно Черного моря) и из воды вырывались огромные языки пламени в сотни метров высотой, даже вдали от моря ощущался сильный запах тухлых яиц (запах сероводорода) и на морском горизонте вспыхивали громовыезарницы,
уходящие
горящими
столбами
в небеса.
Слайд 62
Выбросы метана
Образование в воде огромных пузырей, насыщенных метаном,
является следствием распада гидрата метана на морском дне. Плотность
внутри образовавшегося пузыря настолько мала, что корабли не могут удержатьсяна поверхности и, попадая в эту
область, тонут мгновенно.
Гибель самолётов объясняют
следующим образом.
Плотность воздуха в столбе
поднявшегося в воздух метана
столь низка, что происходит резкое
снижение подъёмной силы, а также
считается, что метан способен
привести в остановке двигателя.
Резкие выбросы метана происходят
в момент раскрытия разлома
в земной коре.
Слайд 63
Кенгуру самые экологичные животные
Австралийские учёные четыре года исследовали
эту особенность кенгуру: их кишечные газы, в отличие от
абсолютного большинства других животных, не содержат метана. Метан, который вырабатывает их организм, пищеварительная система кенгуру отправляет на вторичную переработку.Метан в земной атмосфере — это серьёзная проблема. Он является сильным парниковым газом, одна тонна этого газа в атмосфере равна двадцати пяти тоннам углекислого газа, так что метан — один из главных виновников парникового эффекта. Коровы в Австралии выделяют столько метана, что считаются вторым после электростанций источником загрязнения окружающей
среды.
Кенгуру заставили учёных по-новому взглянуть на проблему:
раз уж избавиться ото всех коров на Земле мы не можем, то,
по крайней мере, можем попробовать заставить их быть более
экологичными. Сейчас идёт работа над созданием добавки в
коровий корм с содержанием элементов микрофлоры кенгуру.
Слайд 64 Газогидрат – это лед с высоким содержанием газа.
Эти соединения образуются при низкой температуре и высоком давлении
в условиях, которые чаще всего возникают в морях на глубинах свыше 400 м. Они существуют только благодаря низкой температуре и огромному давлению, «разрушить» их на месте залегания весьма нелегко. Даже при нормальном атмосферном давлении они начинают плавиться только при 10-20 градусах.
Слайд 65
Япония нашла источник энергетической независимости
Японское агентство природных ресурсов
и энергии сообщило, что государственная Корпорация нефти, газа и
металлов (JOGMEC) смогла добыть газ из гидрата метана, залегающего на дне океана. Существующие на сегодня технологии позволяют добывать газ из газогидратов, залегающих на суше, но они требуют больших энергозатрат и часто нерентабельны.По имеющейся информации, промышленная разработка газогидратных залежей может начаться в 2018 году. Ученые считают, что запасы этого вида сырья в Японии составляют около 7 трлн куб. м.
Слайд 66
Смертельный
враг шахтера
Метан, или "гремучий газ",
природный газ
без цвета и
без запаха, считается
смертельным врагом шахтера,
так
как значительные его массы содержатся в
каменноугольных копях, где происходит разложение органических остатков. В шахтах он скапливается в пустотах среди пород.
Когда еще не было электричества, виноват был обычно открытый огонь — масляные лампы, свечи, факелы. Но бывало и так, что и без взрывов из шахт выносили мертвых горняков, отравившихся рудничным газом.
Слайд 67
Признаки отравления метаном
Как правило, при отравлении метаном возникает
ощущение тяжести в голове, человек испытывает головокружение, наблюдается шум
в ушах. Также симптомами отравления газом являются рвота, покраснение кожи, резкая мышечная слабость, частое сердцебиение, сонливость.При тяжелом отравлении — потеря сознания, побледнение или посинение кожи, поверхностное дыхание, судороги.
Первая помощь при отравлении
1. Пострадавшего необходимо вынести на свежий воздух.
2. Расстегнуть на пострадавшем одежду, восстановить проходимость дыхательных путей, следя за тем, чтобы не западал язык.
3. Уложить пострадавшего (ноги должны быть выше тела). Приложить холодный компресс к голове.
4. Растереть тело и грудь, укрыть потеплее и дать понюхать нашатырный спирт. Если началась рвота, пострадавшего необходимо перевернуть на бок.
5. При остановке или замедлении дыхания (до 8 вздохов в минуту) нужно начинать делать искусственную вентиляцию легких. Вдох необходимо делать через мокрую марлевую повязку (носовой платок), а при выдохе пострадавшего отклоняться в сторону, чтобы не отравиться самому.
6. При улучшении состояния пострадавшего ему необходимо обильное питье (чай, молоко, кефир).
Слайд 68
Проверка знаний
Какие углеводороды относят к алканам?
Запишите формулы возможных
изомеров гексана и назовите их по систематической номенклатуре.
Напишите формулы
возможных продуктов крекинга октана4. В каком объёмном соотношении смесь метана с воздухом становится взрывоопасной?
5. Каковы природные источники получения алканов?
6. Назовите области применения алканов