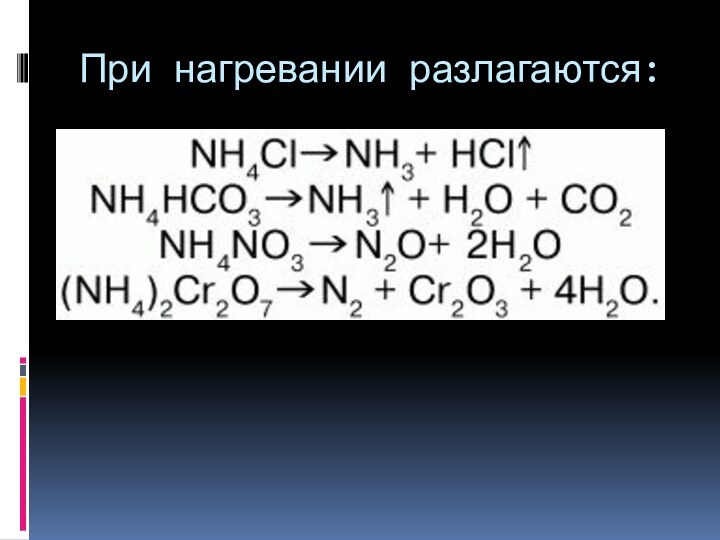
и ионы металлов, он образует свои соли (NH4+К.О.)
Все соли
аммония растворимы в воде.Без азота нет белка, без белка нет жизни.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть