- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Технологии урановых добывающих и перерабатывающих предприятий
Содержание
- 2. МАТЕРИАЛЬНЫЕ РАСЧЕТЫ ОСНОВНЫХ ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВк.т.н., доцент кафедры ХТРЭНиколай Степанович Тураев
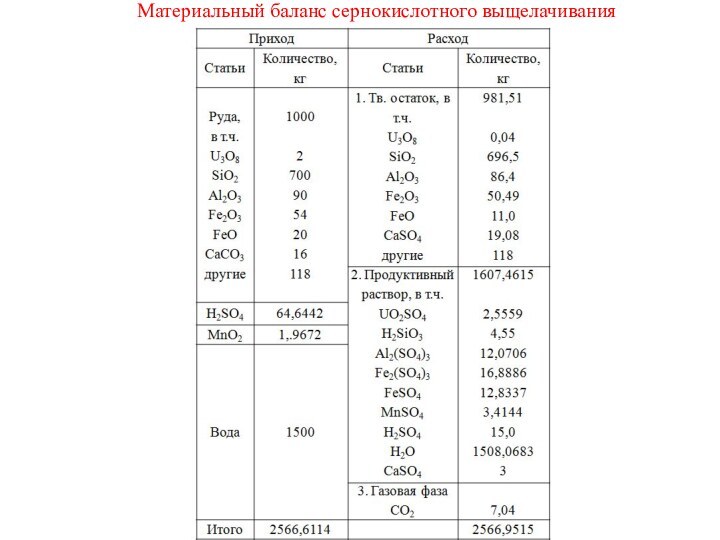
- 3. МАТЕРИАЛЬНЫЕ РАСЧЕТЫ ОСНОВНЫХ ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ.Материальный баланс выщелачивания.Хотелось
- 4. Считаем расход реагентов на реакцию с U3O8
- 5. SiO2 + H2O → H2SiO3Принимаем, что в
- 6. Степень вскрытия Fe2O3 5-8%, принимаем 6,5%Fe2O3 +
- 7. В 8,775 кг Fe2(SO4)3 содержится 8,775×2×56/400=2,457 кг
- 8. CaCO3 реагирует на 100%CaCO3 + H2SO4
- 9. Суммарный расход MnO2X2+t2=0,2025+1,7647=1,9672 кгСуммарное количество полученного Fe2(SO4)3Z2+t3=8,775+8,1136=16,8886
- 10. Скачать презентацию
- 11. Похожие презентации
МАТЕРИАЛЬНЫЕ РАСЧЕТЫ ОСНОВНЫХ ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВк.т.н., доцент кафедры ХТРЭНиколай Степанович Тураев









Слайд 2
МАТЕРИАЛЬНЫЕ РАСЧЕТЫ ОСНОВНЫХ
ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
к.т.н., доцент кафедры ХТРЭ
Николай
Степанович Тураев
Слайд 3
МАТЕРИАЛЬНЫЕ РАСЧЕТЫ ОСНОВНЫХ
ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ.
Материальный баланс выщелачивания.
Хотелось бы
выполнить материальный баланс подземного выщелачивания. Но в данном случае
можно отметить ряд затруднений .Во-первых, длительность процесса, во-вторых, большая масса рудного пласта, в третьих, переменная концентрация продуктивного раствора.
Поэтому остановимся на материальном расчете выщелачивания, производимом на ГМЗ для руды, добытой в карьере.
Примем следующий состав исходной руды (% масс.)
U3O8 – 0,2%, SiO2-70%; Al2O3 – 9%, Fe2O3 – 5,4%, FeO – 2%, CaCO3 – 1,6%, другие 11,8%. Содержание твердой фазы в пульпе 40%. Остаточная кислотность 10 г/л.
Выщелачивание производим серной кислотой в присутствии окислителя – пиролюзита (считаем расход на MnO2). Расчет ведем на 1 т руды.
Слайд 4 Считаем расход реагентов на реакцию с U3O8 (степень
вскрытия 98%).
U3O8 + 4H2SO4 + MnO2
→ 3UO2SO4 + MnSO4 + 4H2O842 4×98 87 3×366 151 4×16
1000×0,002×0,98 X1 X2 X3 X4 X5
Расход H2SO4
X1=1,96×392/842=0,9125 кг
Расход MnO2
X2=1,96×87/842=0,2025 кг
Приход UO2SO4
X3=1,96×1098/842=2,5559 кг, в том числе 2,5559×3×238/1,662 кг U
Приход MnSO4
X4=1,96×151/842=0,3515 кг
Приход H2O
X4=1,96×4×18/842=0,1676 кг
Слайд 5
SiO2 + H2O → H2SiO3
Принимаем, что в коллоидный
раствор перешло 0,5 % SiO2.
Количество H2SiO3: 700×0,005×78/60=4,55 кг.
Расход H2O
3,5×18/60=1,05
Степень
вскрытия Al2O3 3-5%, принимаем 4%Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
102 3×98 342 3×18
1000×0,09×0,04 y1 y2 y3
Расход H2SO4
y1=3,6×3×98/102=10,3765 кг
Приход Al2(SO4)3
y2=3,6×342/102=12,0706 кг
Приход H2O
y3=3,6×54/102=1,9059 кг
Слайд 6
Степень вскрытия Fe2O3 5-8%, принимаем 6,5%
Fe2O3 +
3H2SO4 → Fe2(SO4)3 + 3H2O
160
3×98 400 3×181000×0,054×0,065 z1 z2 z3
Расход H2SO4
z1=3,51×294/160=6,4496 кг
Приход Fe2(SO4)3
Z2=3,51×400/160=8,775 кг
Приход H2O
Z3=3,51×54/160=1,1846 кг
Степень вскрытия FeO 40-50%, принимаем 45%
FeO + H2SO4 → FeSO4 + H2O
72 98 152 18
1000×0,45×0,02 u1 u2 u3
Расход H2SO4
U1=9×98/72=12,25 кг
Приход Fe2(SO4)3
U2=9×152/72=19 кг
Приход H2O
U3=9×18/72=2,75 кг
Слайд 7
В 8,775 кг Fe2(SO4)3 содержится 8,775×2×56/400=2,457 кг Fe3+
В
19 кг FeSO4 содержится 19×56/152=7 кг Fe2+
Сумма Fe3+ и
Fe2+ = 2,457+ 7=9,457 кгДля полного окисления U(IV) до U(VI) требуется выровнить количества Fe3+ и Fe2+,т.е. до 9,457/2=4,7285 кг.
Для этого нужно окислить 4,7288-2,457=2,2718 кг Fe2+
2FeSO4 + MnO2 + 2H2SO4 → Fe2(SO4)3 + MnSO4 + 2H2O
2×56 87 2×98 400 151 2×18
2,2718 t2 t1 t3 t4 t5
Расход H2SO4
t1=2,2718×196/112=3,9756 кг
Расход MnO2
t2=2,2718×87/112=1,7647 кг
Приход Fe2(SO4)3
t3=2,2718×400/112=8,1136 кг
Приход MnSO4
t4=2,2718×151/112=3,0629 кг
Приход H2O
t5=2,2718×36/112=0,7302 кг
Слайд 8
CaCO3 реагирует на 100%
CaCO3 + H2SO4 →
СaSO4 + 2H2O+CO2
100 98
138 18 441000×0,16 c1 c2 c3 c4
Расход H2SO4
C1=16×98/100=15,68 кг
Приход CaSO4
C2=16×138/100=22,08 кг
Приход H2O
C3=16×18/100=2,88 кг
Приход CO2
C4=16×44/100=7,04 кг
Суммарный расход H2SO4 составляет
X1+Y1+Z1+U1+t1+C1, т.е.
0,9125+10,3765+6,4496+12,25+3,9756+15,68=49,6442 кг
Дополнительно для создания избыточной кислотности 10г/л требуется
10г/л-1500 л = 15000 г=15 кг.
(1500=1000кг×60/40=1500 ж.фазы, т.е. ~1500 л)
Следовательно общий расход H2SO4 составит
49,6442+15=64,6442 кг
Слайд 9
Суммарный расход MnO2
X2+t2=0,2025+1,7647=1,9672 кг
Суммарное количество полученного Fe2(SO4)3
Z2+t3=8,775+8,1136=16,8886 кг
Количество
оставшегося FeSO4
19-2,2718×152/56=19-6,1663=12,8337 кг
Количество воды, полученной по реакциям
X5+y3+z3+u3+t5+c3=0,1676+1,9059+1,1846+2,25+0,7302+2,88=
9,1183 кг
Количество MnSO4
X4+t4=0,3515+3,0629=3,4144
кгТеперь составляем таблицу материального баланса. В твердом остатке остается начальное количество, умноженное на (1-ε), где ε– степень вскрытия.