Слайд 2
История открытия металлов
Каменный век
Медный век (IV – III
тысячелетия
до н.э.)
Бронзовый век (конец IV – начало I
тысячелетия до н.э.)
Железный век (I тысячелетие до н.э.)
Слайд 3
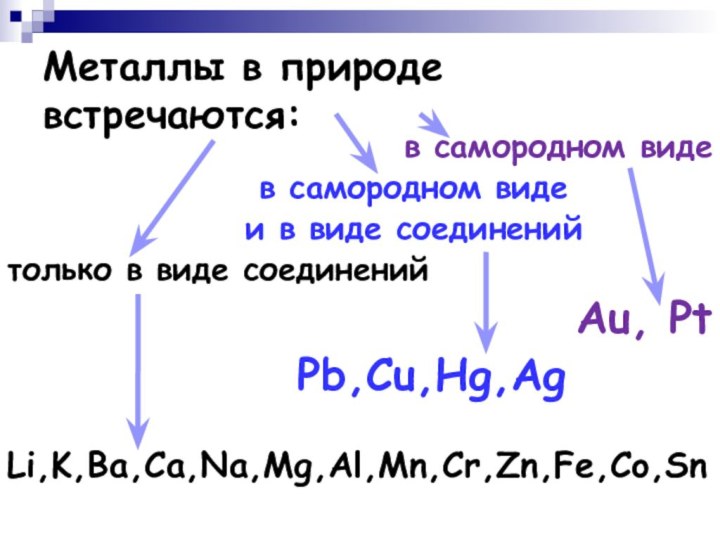
Металлы в природе встречаются:
в самородном виде
в самородном виде
и
в виде соединений
только в виде соединений
Au, Pt
Pb,Cu,Hg,Ag
Li,K,Ba,Ca,Na,Mg,Al,Mn,Cr,Zn,Fe,Co,Sn
Слайд 4
Только некоторые металлы (золото, платина) находятся в природе
в свободном (самородном) состоянии.
Металлы, расположенные в ряду напряжений металлов
между оловом и золотом, встречаются как в свободном состоянии, так и в виде соединений.
Большинство же металлов находятся в природе в виде соединений (оксиды, сульфиды, карбонаты и т.д.)
Слайд 5
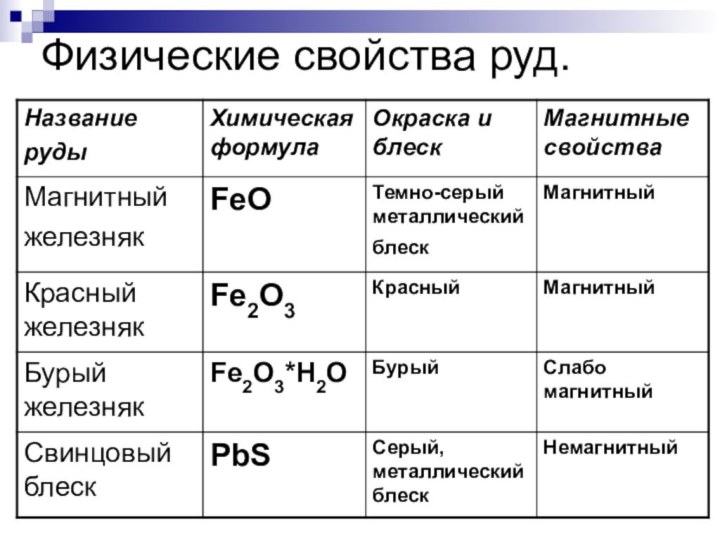
Руды
- минералы и горные породы, содержащие металлы
или их соединения и пригодные для промышленного получения металлов.
Слайд 6
Руды
Черные (содержащие железо)
Цветные (содержащие все остальные металлы)
Слайд 8
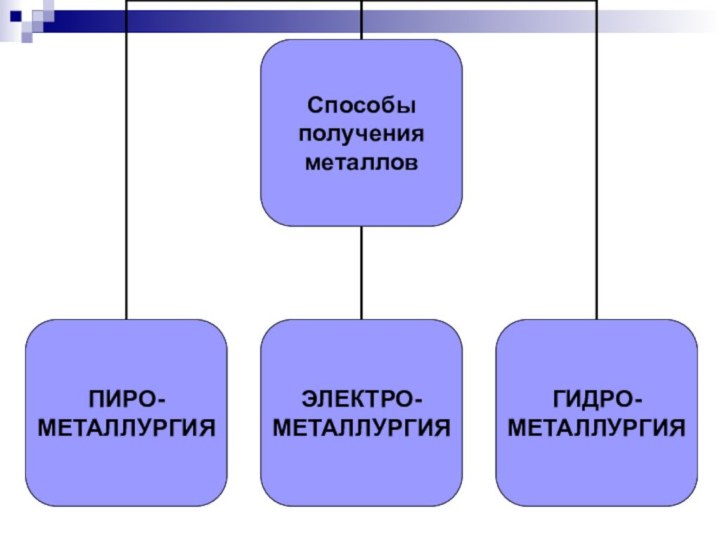
МЕТАЛЛУРГИЯ- промышленный способ получения металлов.
Металлургия делится:
Черная металлургия –
производство железа и его сплавов (чугуна и стали)
Цветная металлургия
– производство остальных металлов и их сплавов.
Слайд 9
Задача металлургии – получение металлов из их соединений.
Любой
металлургический процесс является процессом восстановления ионов металла различными восстановителями.
Me+n +nē = Me0
В зависимости от метода проведения процесса восстановления различают несколько способов получения металлов.
Слайд 11
ПИРОМЕТАЛЛУРГИЯ - восстановление безводных соединений при высоких температурах.
Восстановители:
углерод и оксид углерода (II) (карботермия);
алюминий, магний
и др.
металлы (металлотермия);
водород (водородотермия).
Слайд 12
ПИРОМЕТАЛЛУРГИЯ
Карботермия.
Восстановители: C и CO.
Например:
Fe2O3 + 3CO = 2Fe + 3CO2
Если
руда является сульфидом металла, её предварительно переводят в оксид путём окислительного обжига (обжиг с доступом воздуха). Например: 2ZnS + 3O2 = 2ZnO + 2SO2
Затем оксид металла восстанавливают углём.
Например: ZnO + C = Zn + 2CO↑
Так получают: Fe, Cu, Pb, Sn, Cd, Zn
Слайд 13
ПИРОМЕТАЛЛУРГИЯ
Металлотермия.
В качестве восстановителей используют химически более активные металлы:
Al, Mg, Ca, Na.
Например: Cr2O3
+ 3Al =2Cr + Al2O3
TiCl4 + 2Mg = Ti + 2MgCl2
Обычно получают те металлы (и их сплавы), которые при восстановлении их углём образуют карбиды.
Так получают: Mn, Cr, Ti, Mo, W, V и др.
Слайд 14
ПИРОМЕТАЛЛУРГИЯ
Водородотермия.
Восстанавливают металлы из их оксидов H2.
Например:
MoO3 + 3H2 = Mo +
3H2O
Оксиды активных металлов (MgO, CaO, Al2O3 и др.) водородом не восстанавливаются.
Получают металлы большей чистоты: Cu, Ni, W, Fe, Mo, Cd, Pb
Слайд 15
ЭЛЕКТРОМЕТАЛЛУРГИЯ – восстановление
электрическим током.
Получают главным образом лёгкие металлы – Al, Na и др. – из их расплавленных оксидов или хлоридов.
Используют также для очистки некоторых металлов.
Cu, Ag, Fe, Ni, Pb и многие другие.
Слайд 16
ЭЛЕКТРОМЕТАЛЛУРГИЯ
Электролиз расплавов.
Например:
NaCl = Na+ + Cl-
расплав
K Na+ + ē = Na0 │2
A 2Cl- - 2ē = Cl2↑ │1
2NaСl эл-лиз → 2Na + Cl2↑
Получаемые металлы: Be, Mg, Ca (из расплавленных хлоридов), Al (из расплавленного оксида)
Слайд 17
ЭЛЕКТРОМЕТАЛЛУРГИЯ
Электролиз растворов.
Например:
NiSO4 = Ni2+ + SO42-
раствор
K Ni2+ +2ē = Ni0 │ 2
A 2H2O - 4ē = O2↑ + 4H+ │1
2NiSO4 + 2H2O эл-лиз→ 2Ni + O2↑ + 2H2SO4
Получаемые металлы: Zn, Cd, Co, Mn, Fe
Слайд 18
ГИДРОМЕТАЛЛУРГИЯ – восстановление из растворов солей.
Металлы, входящие в состав руды, переводят в раствор,
а затем восстанавливают более активным металлом.
Руда → р-р соли → Ме
CuO → CuSO4 → Cu
Слайд 19
ГИДРОМЕТАЛЛУРГИЯ
Восстановление металлов из руд с помощью
серной кислоты – один из основных процессов гидрометаллургии.
Например:
CuO + H2SO4 = CuSO4+ H2O
CuSO4 + Fe = FeSO4 + Cu
Получаемые металлы: Cd, Ag, Au, Cu, Zn, Mo и др.
Слайд 20
CaO + C ->
Al2O3 + CO
->
CuO + H2 ->
TiO2 + Al ->
Cr2O3 + Ca ->
Допишите реакции, уравняйте и покажите переход электронов
Слайд 21
Допишите реакции, уравняйте и покажите переход электронов
ZnS
+ O2 ->
ZnO + C ->
FeS2 + O2
->
Fe2O3 + CO ->
Слайд 22
CuO + H2SO4 ->
CuSO4 + Fe ->
Sc2O3 + HF ->
ScF3 + Ca ->
либо Sc2O3
+ Ca ->
Допишите реакции, уравняйте и покажите переход электронов