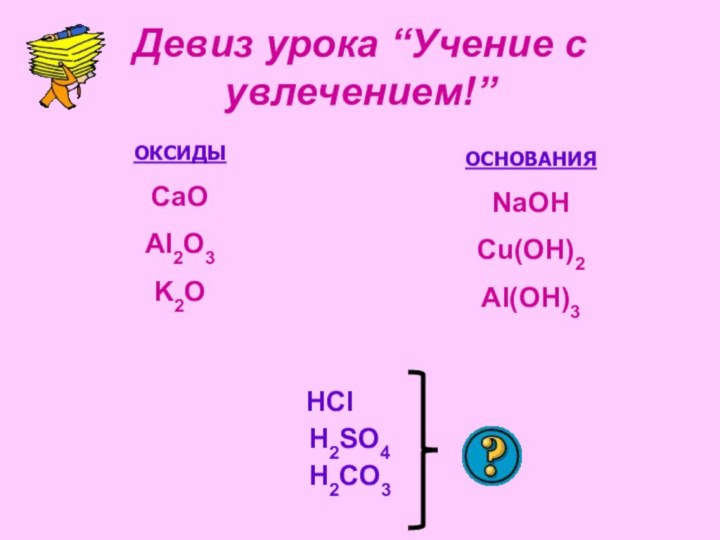
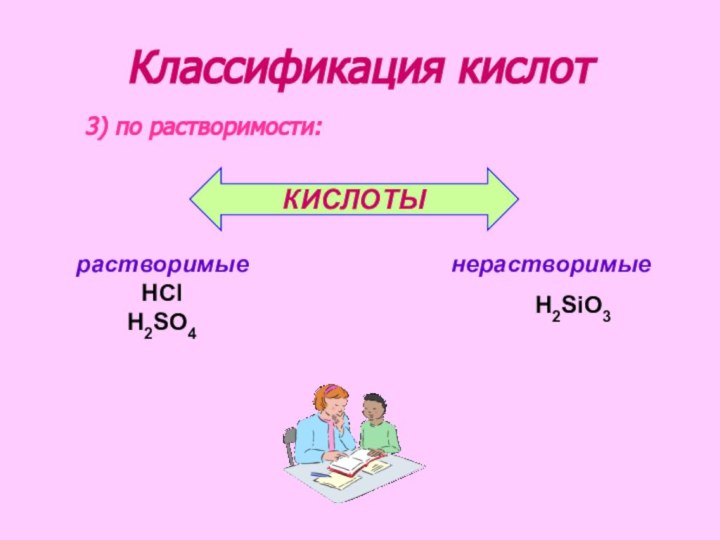
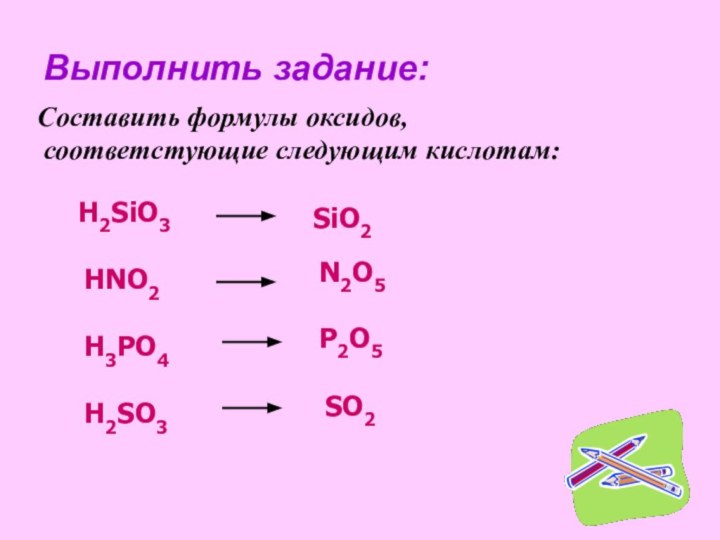
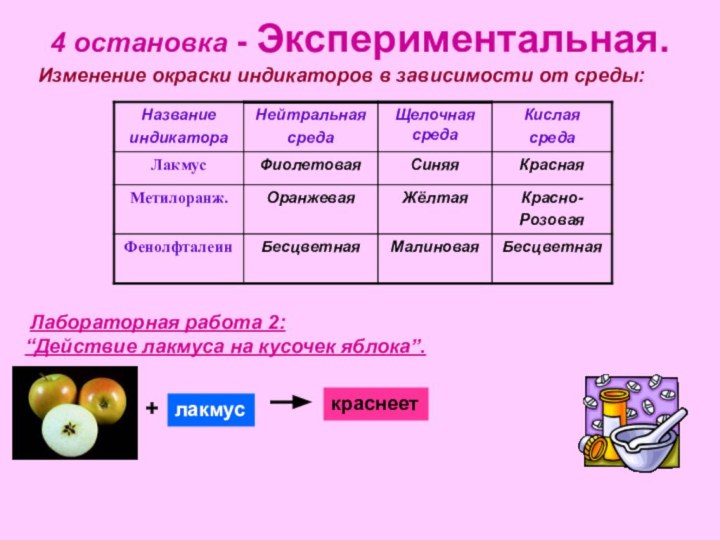
рассмотреть состав и классификацию кислот
физические свойства
кислотнаучиться определять степени окисления элементов и зарядов ионов кислот
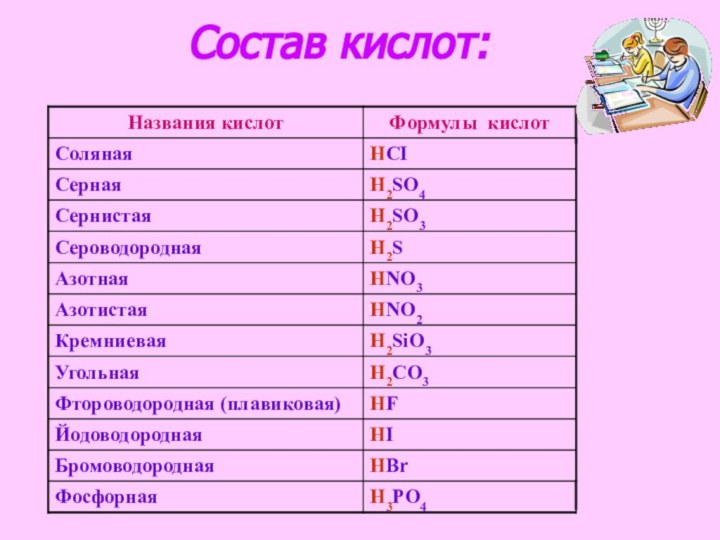
ознакомиться с формулами и названиями основных неорганических кислот.