- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Галогены. Общая характеристика галогенов
Содержание
- 2. Цель урока:Повторить свойства металлов и неметаллов Изучить строениеатомов, свойства галогенов на основании их сравнительной характеристики.
- 4. Ответы теста
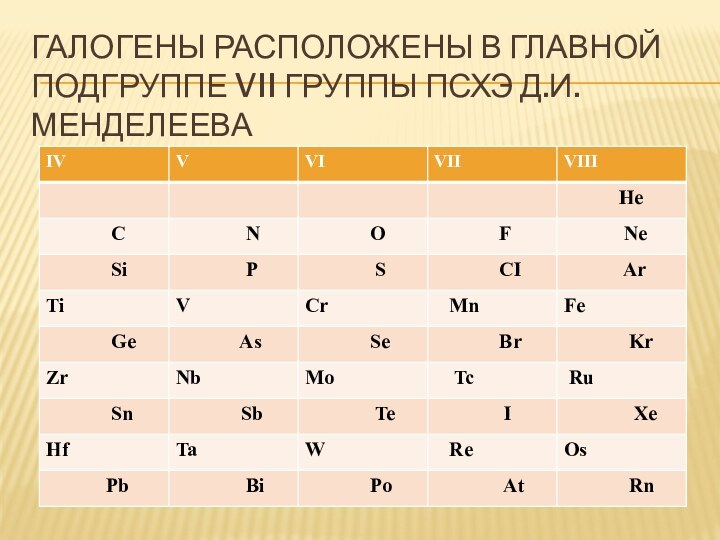
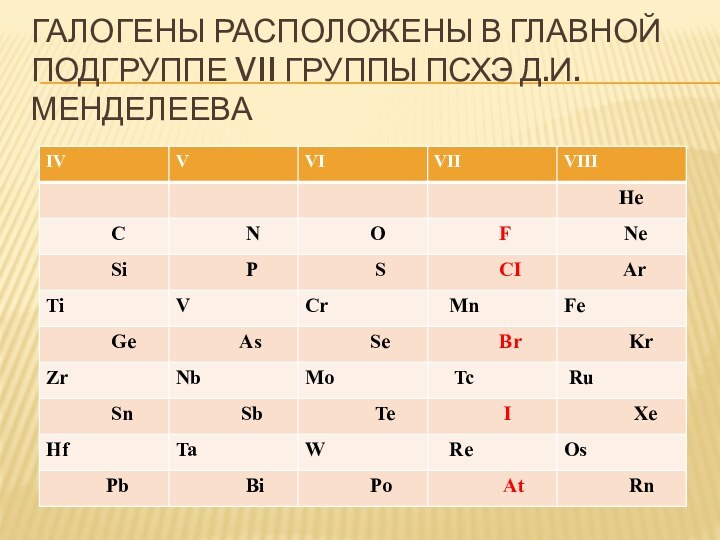
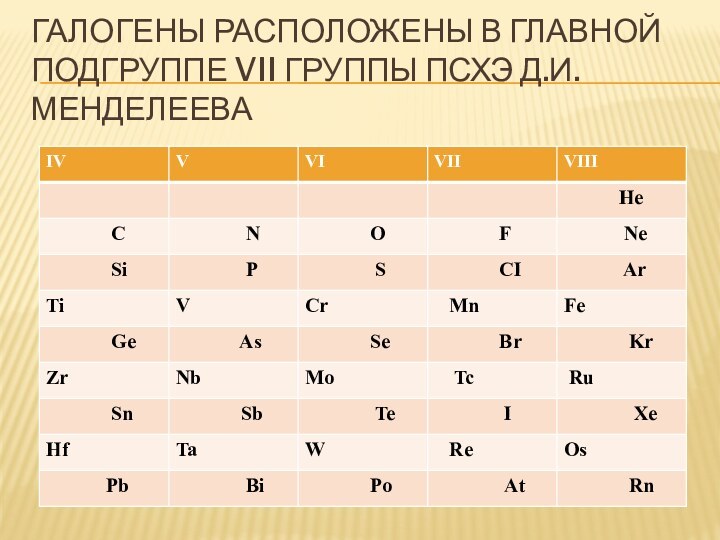
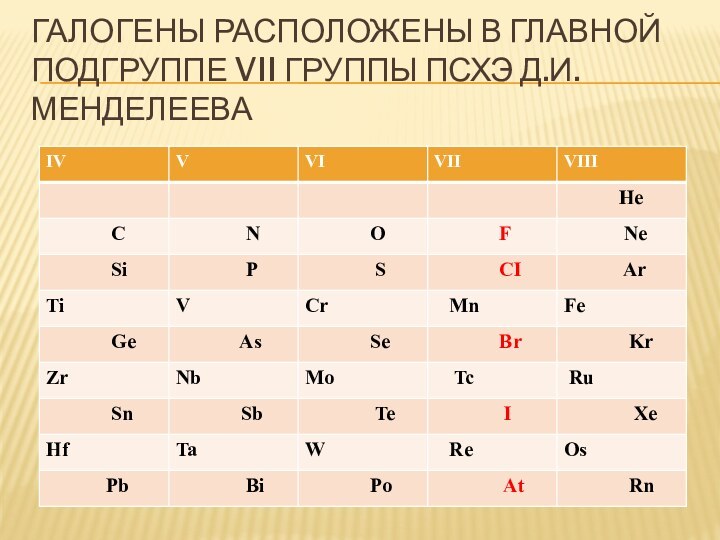
- 5. Галогены расположены в главной подгруппе VII группы ПСХЭ Д.И. Менделеева
- 6. Галогены расположены в главной подгруппе VII группы ПСХЭ Д.И. Менделеева
- 7. Галогены расположены в главной подгруппе VII группы ПСХЭ Д.И. Менделеева
- 8. Галогены расположены в главной подгруппе VII группы ПСХЭ Д.И. Менделеева
- 9. Галогены «рождающие соли»FCIBrIAt
- 10. Распространенность галогенов в природе
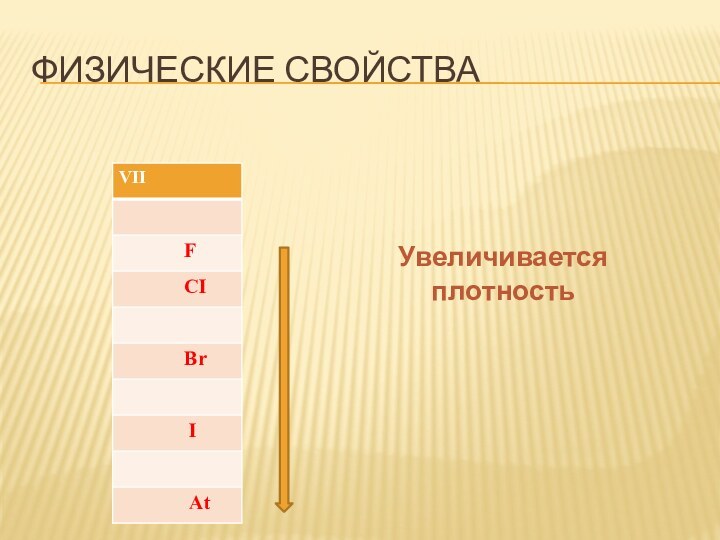
- 11. Физические свойстваУвеличивается плотность
- 12. Физические свойстваУвеличивается плотностьПовышаются температурыкипения и плавления
- 13. Физические свойстваУвеличивается плотностьПовышаются температурыкипения и плавленияУсиливается интенсивность окраски
- 16. БромBr2Токсичнаятяжёлаяжидкостькрасно- бурого цвета
- 18. Ответьте на вопросы.Число электронов на внешнем энергетическом
- 19. Проверка:На внешнем энергетическом уровне галогены содержат 7
- 20. Химические свойстваF) ) 2 7Г°+1е = Г¯-Галогены-окислители
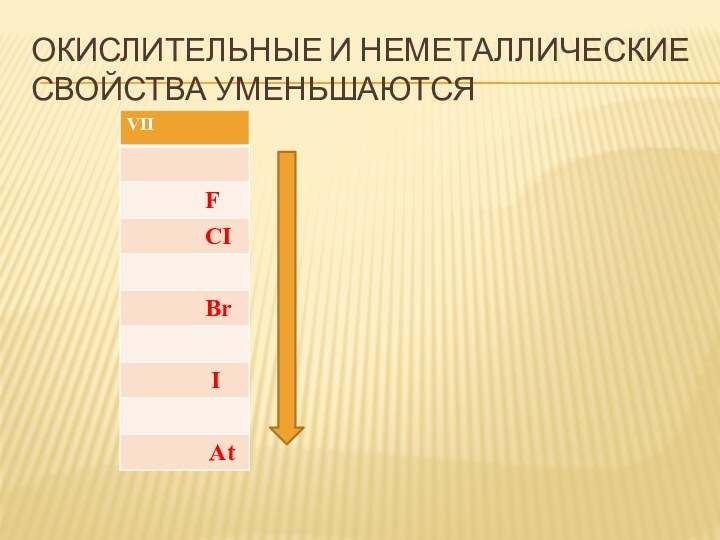
- 21. Окислительные и неметаллические свойства уменьшаются
- 22. Более активный галоген вытесняет менее активный
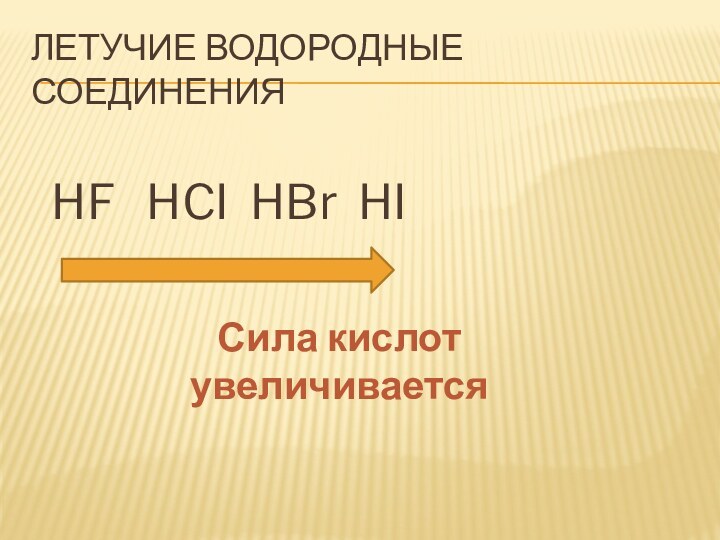
- 23. Летучие водородные соединения HF HCI HBr HIСила кислот увеличивается
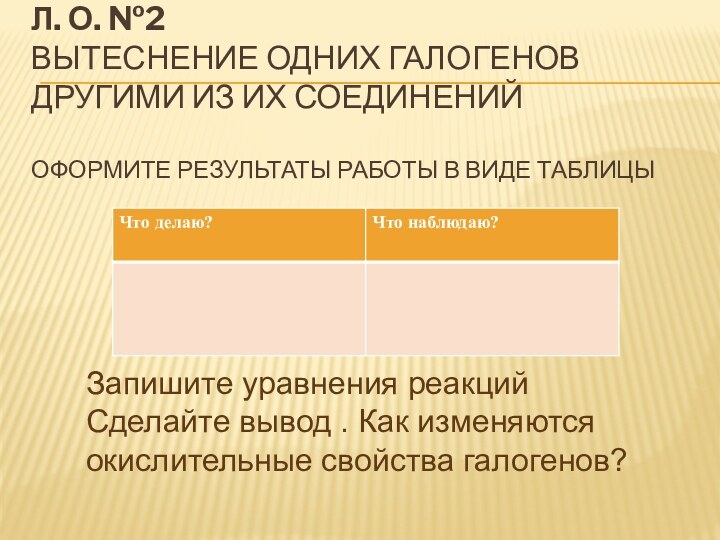
- 24. Л. О. №2 Вытеснение одних галогенов другими
- 25. Л. О. №3 Растворимость йода в органических
- 26. Вопросы и заданияПеречислите галогены.Фтор, хлор, бром, йод,
- 27. Вопросы и задания Сопоставьте :Хлор
- 28. Вопросы и заданияДополните:Самый сильный неметалл –
- 29. Домашнее задание § 13 , упражнения 1- 4 стр. 61.
- 30. Скачать презентацию
- 31. Похожие презентации
Цель урока:Повторить свойства металлов и неметаллов Изучить строениеатомов, свойства галогенов на основании их сравнительной характеристики.






















Слайд 2
Цель урока:
Повторить свойства металлов и неметаллов
Изучить строениеатомов,
свойства галогенов на основании их сравнительной характеристики.
Слайд 4
Ответы теста
1 вариант – неметаллы
2, 4, 5, 7, 10, 11, 13, 152 вариант – металлы
1, 2, 3, 6, 8, 9, 12, 14
Слайд 13
Физические свойства
Увеличивается плотность
Повышаются температуры
кипения и плавления
Усиливается
интенсивность окраски
Слайд 17
йод
I2 –
Твёрдое кристаллическое
вещество
с металлическим
блеском
При нагревании образует пары фиолетового цвета
Слайд 18
Ответьте на вопросы.
Число электронов на внешнем энергетическом уровне
атома;
Изменение радиуса атомов и окислительно-восстановительных свойств галогенов в
подгруппе; Возможные степени окисления.
Тип химической связи
Тип кристаллической решетки
Слайд 19
Проверка:
На внешнем энергетическом уровне галогены содержат 7 электронов.
В
главной подгруппе с увеличением зарядов ядер, увеличиваются радиусы атомов,
нарастают восстановительные свойства.Возможные степени окисления: -1, +7.
Ковалентная неполярная связь
Молекулярная кристаллическая решетка.
Слайд 22 Более активный галоген вытесняет менее активный из его
соединений с металлами и водородом
2KI + Br2 = 2
KBr + I2 ,но KBr + I2
Фтор – самый
сильный неметалл
Слайд 24 Л. О. №2 Вытеснение одних галогенов другими из их
соединений
Оформите результаты работы в виде таблицы
Запишите уравнения реакций
Сделайте вывод
. Как изменяются окислительные свойства галогенов?Слайд 25 Л. О. №3 Растворимость йода в органических растворителях Оформите
результаты работы в виде таблицы
Запишите уравнения реакций.
Сделайте вывод о
растворимости галогенов.
Слайд 26
Вопросы и задания
Перечислите галогены.
Фтор, хлор, бром, йод, астат.
Где
в ПСХЭ располагаются галогены?
в VII группе, главной подгруппе.
Чему равно число валентных электронов в атомах галогенов ?Число валентных электронов равно семи.
Слайд 27
Вопросы и задания
Сопоставьте :
Хлор
красно
– бурая жидкостьБром светло – зеленый газ
Йод жёлто – зелёный газ
Фтор твёрдый с металлическим
блеском пары фиолетового цвета
Слайд 28
Вопросы и задания
Дополните:
Самый сильный неметалл –
фтор.
Самая сильная бескислородная кислота –
HI.
Как изменяются окислительные свойства галогенов?
Уменьшаются в ряду F CI Br I





























