такое изолятор?
Что называется катодом?
Что называется анодом?
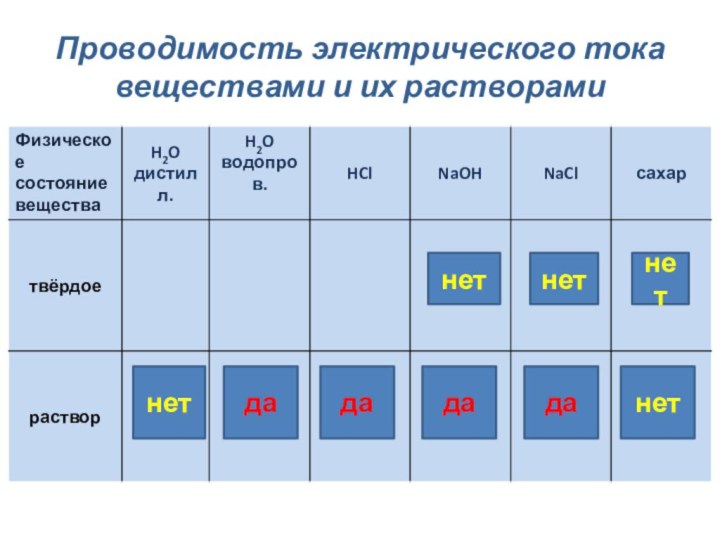
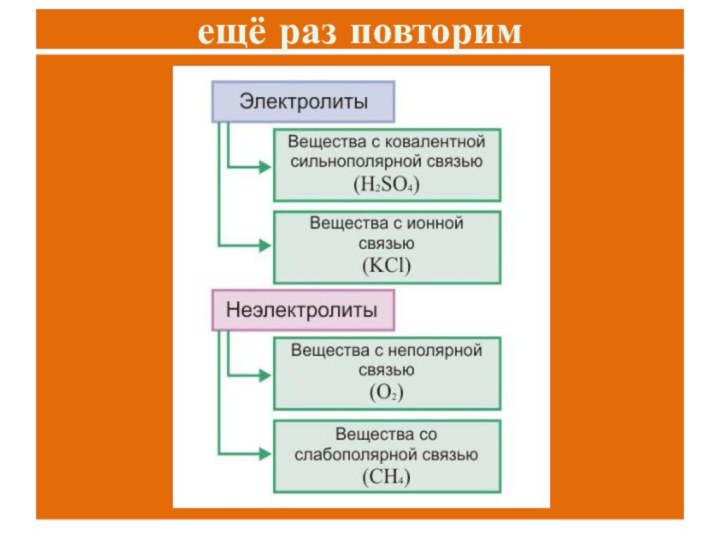
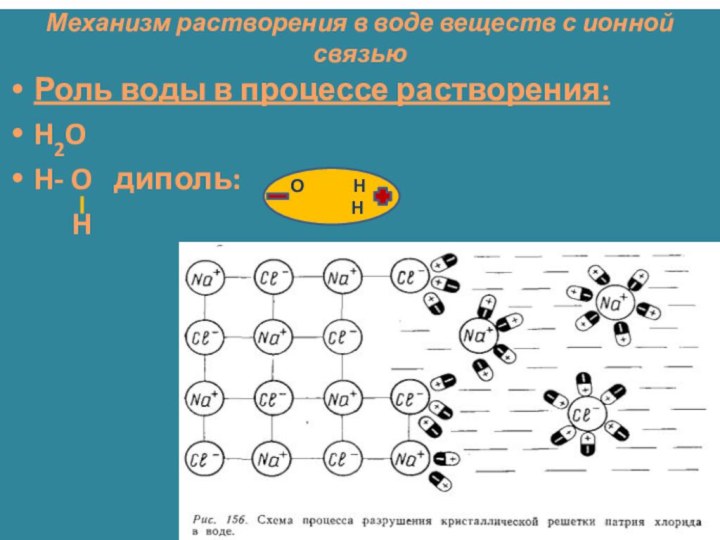
Почему одни вещества проводят
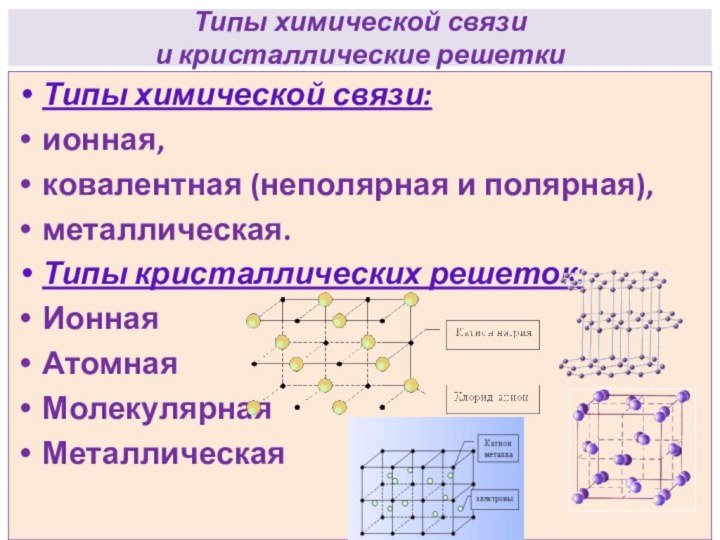
электрический ток, а другие нет?Какие типы химической связи вам известны?
Какие типы кристаллических решеток вы знаете?