- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Исходная презентация Водородная связь для подготовки урока химии на повышенном уровне
Содержание
- 2. Образование химической связиЭнергия связи, кДж/мольχp(H) = 2.1E(H-H)
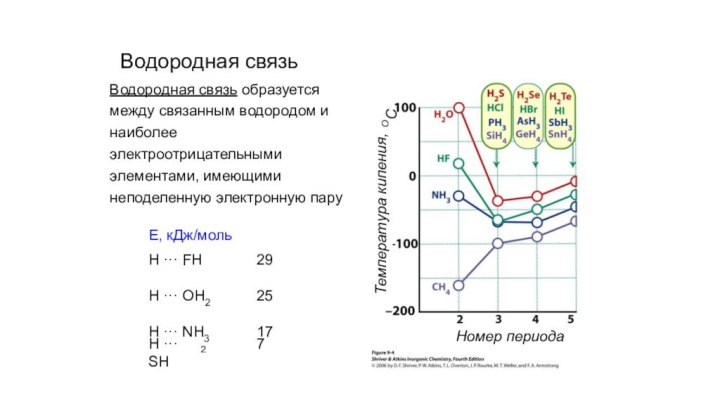
- 3. Водородная связьНомер периодаТемпература кипения,ОСВодородная связь образуется между
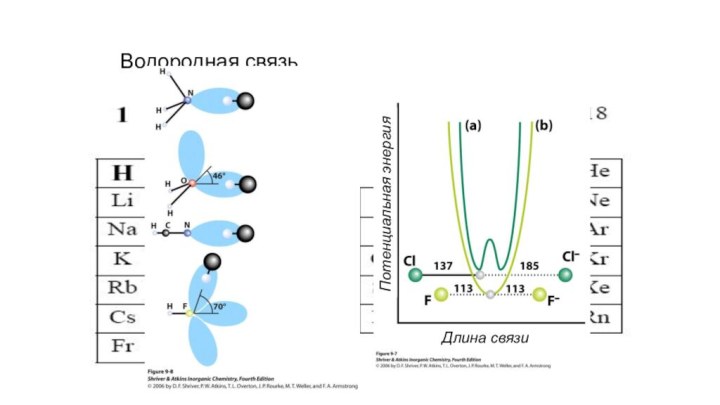
- 4. Водородная связьДлина связиПотенциальная энергия
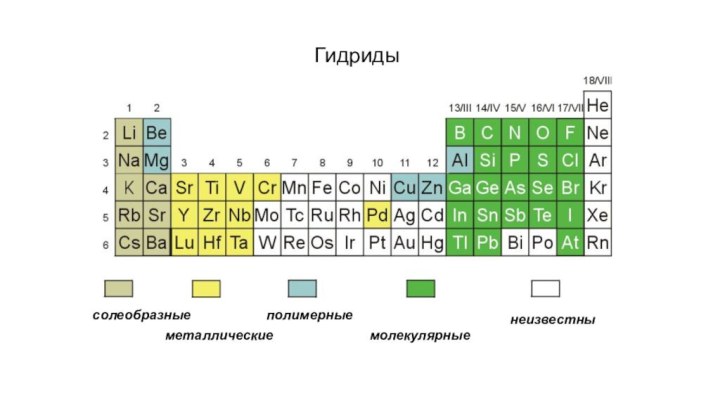
- 5. солеобразныеметаллическиеполимерныемолекулярныенеизвестныГидриды
- 6. Гидриды1. Солеобразные гидриды2Li + H2 = 2LiH(т.пл.
- 7. Гидриды2. Металлические гидридыМеталлическая проводимость, нестехиометрияYb + H2 = YbH2 YbH2 + 0.86[H]YbH2.86PdLaNi5 + 3H2LaNi5H6(хранение водорода)PtZrHxLaNi5H6
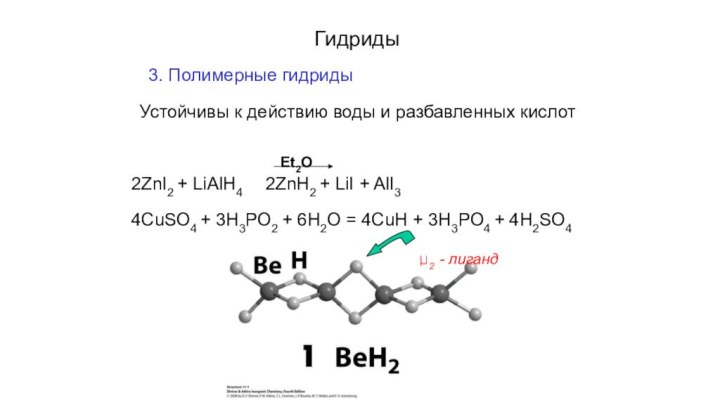
- 8. Гидриды3. Полимерные гидридыУстойчивы к действию воды и
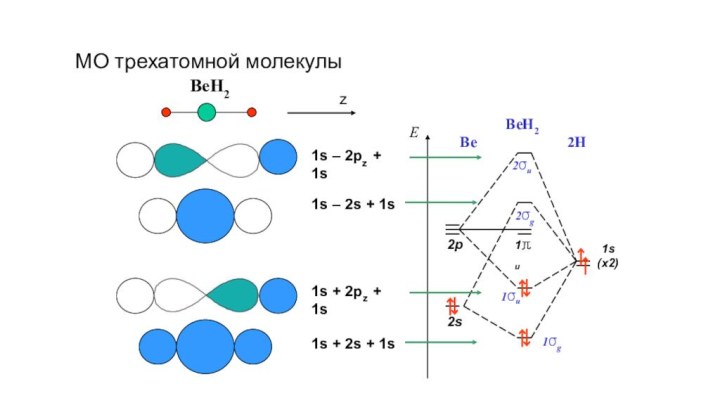
- 9. BeH21s – 2pz + 1s1s + 2pz
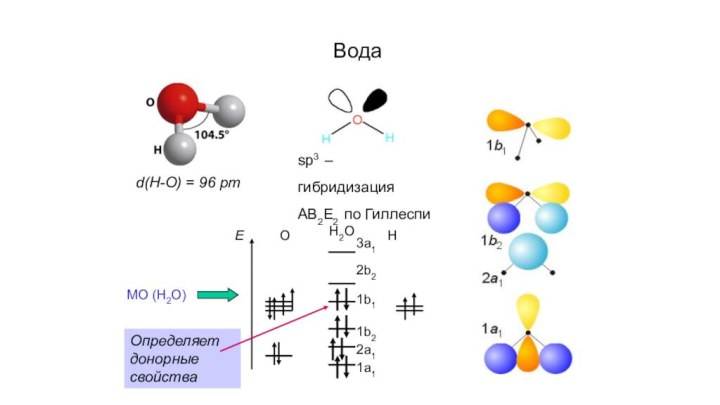
- 10. Водаd(H-O) = 96 pmsp3 – гибридизация АВ2Е2 по ГиллеспиOHH2O3a1 2b21b11b2 2a1 1a1EМО (H2O)Определяет донорные свойства
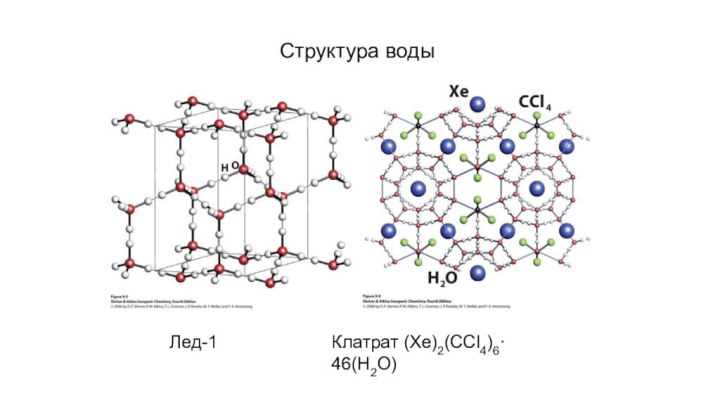
- 11. Структура водыЛед-1Клатрат (Xe)2(CCl4)6· 46(H2O)
- 12. Свойства воды1. ΔfG0298= –237.1 кДж/мольε = 78.39298μ =
- 13. Пероксид водородаН2О2бледно-голубая жидкостьТпл. = -0.4 оСТкип =
- 14. Скачать презентацию
- 15. Похожие презентации
Образование химической связиЭнергия связи, кДж/мольχp(H) = 2.1E(H-H) = 435 кДж/мольχ(H) > χ(Э)Эδ+··· Hδ–BeH2Эδ– ··· Hδ+H2Sχ(H) < χ(Э)


![Исходная презентация Водородная связь для подготовки урока химии на повышенном уровне Гидриды1. Солеобразные гидриды2Li + H2 = 2LiH(т.пл. 680 оС)4LiH + AlCl3Li[AlH4] +](/img/tmb/6/544670/ce43b275a97d1bc16b948ca870dc0647-720x.jpg)
![Исходная презентация Водородная связь для подготовки урока химии на повышенном уровне Гидриды2. Металлические гидридыМеталлическая проводимость, нестехиометрияYb + H2 = YbH2 YbH2 + 0.86[H]YbH2.86PdLaNi5 + 3H2LaNi5H6(хранение водорода)PtZrHxLaNi5H6](/img/tmb/6/544670/8524d79afdc5ef06a19ebc92e0ad99dd-720x.jpg)


Слайд 3
Водородная связь
Номер периода
Температура кипения,
ОС
Водородная связь образуется между связанным
водородом и наиболее электроотрицательными элементами, имеющими неподеленную электронную пару
H
··· SH2
7
Слайд 6
Гидриды
1. Солеобразные гидриды
2Li + H2 = 2LiH
(т.пл. 680
оС)
4LiH + AlCl3
Li[AlH4] + 3LiCl↓
4NaH + BCl3 Na[BH4] + 3NaCl↓
NaH
+ H2O = NaOH + H2MgH2
Et2O
ТГФ
Солеобразные гидриды обладают структурами галогенидов щелочных и щелочноземельных металлов:
Ионные соединения!
NaH
Слайд 7
Гидриды
2. Металлические гидриды
Металлическая проводимость, нестехиометрия
Yb + H2 =
YbH2 YbH2 + 0.86[H]
YbH2.86
Pd
LaNi5 + 3H2
LaNi5H6
(хранение водорода)
P
t
ZrHx
LaNi5H6
Слайд 8
Гидриды
3. Полимерные гидриды
Устойчивы к действию воды и разбавленных
кислот
Et2O
2ZnI2 + LiAlH4 2ZnH2 + LiI + AlI3
4CuSO4 + 3H3PO2
+ 6H2O = 4CuH + 3H3PO4 + 4H2SO4μ2 - лиганд
Слайд 9
BeH2
1s – 2pz + 1s
1s + 2pz +
1s
1s – 2s + 1s
1s + 2s + 1s
Be
BeH2
2H
E
1s
(x2)2s
2p
2σ
u
1πu
1σ
u
2σg
1σg
МО трехатомной молекулы
z
Слайд 10
Вода
d(H-O) = 96 pm
sp3 – гибридизация АВ2Е2 по
Гиллеспи
O
H
H2O
3a1 2b2
1b1
1b2 2a1 1a1
E
МО (H2O)
Определяет донорные свойства
Слайд 12
Свойства воды
1. ΔfG0
298
= –237.1 кДж/моль
ε = 78.39
298
μ = 1.84
D
dж = 1 г/см3
dтв = 0.92 г/см3
2. 2H2O ⇔
H3O+ + OH–kW = 1·1014
H2O + HCl ⇔ H3O+ + Cl–
основание кислота
3. Окислитель
NH3 + H2O ⇔ NH + + OH–
4
2H2O(ж) + 2Al(тв) = 2Al(OH)3 + H2 H2O(г) + 3FeO(тв) ⇔ Fe3O4 + H2
4. Восстановитель
2H2O + 4CoF3(р-р) = 4CoF2 + O2 + 4HF
Слайд 13
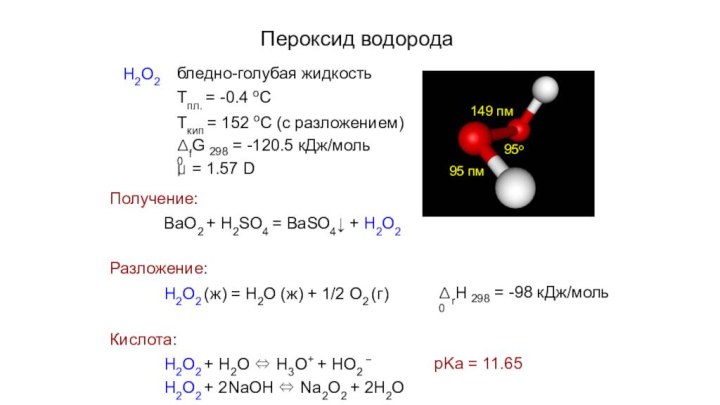
Пероксид водорода
Н2О2
бледно-голубая жидкость
Тпл. = -0.4 оС
Ткип = 152
оС (с разложением)
ΔfG0
298
= -120.5 кДж/моль
μ = 1.57 D
Получение:
BaO2 +
H2SO4 = BaSO4↓ + H2O295 пм
149 пм
95
о
Разложение:
Н2О2 (ж) = Н2О (ж) + 1/2 О2 (г)
ΔrH0
298
= -98 кДж/моль
Кислота:
Н2О2 + Н2О ⇔ Н3О+ + НО2
−
pKa = 11.65
H2O2 + 2NaOH ⇔ Na2O2 + 2H2O