- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Фосфор.
Содержание
- 2. ФОСФОРОбщая характеристика фосфора. Рассмотрение аллотропных видоизменений фосфора.
- 3. ИсторияФосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году.
- 4. Заполните таблицу:
- 7. Сравнение фосфора и азота еще один представитель
- 8. Нахождение в природе и организмеВ свободном состоянии
- 9. Получение фосфораФосфор получают из апатитов или фосфоритов
- 10. Аллотропия- явление, когда один и то же
- 11. Белый, красный и черный фосфор – аллотропные
- 12. Химические свойства фосфораХимические свойства белого и красного
- 13. С неметаллами — восстановитель:2P + 3S →
- 15. Осуществите превращения:Осуществите превращенияCa3(PO4)2 1
- 16. Скачать презентацию
- 17. Похожие презентации
ФОСФОРОбщая характеристика фосфора. Рассмотрение аллотропных видоизменений фосфора. Изучение химических свойств фосфора. Углубление и систематизация знаний периодического закона и системы химических элементов на примере строения и свойств простых веществ, образованных фосфором










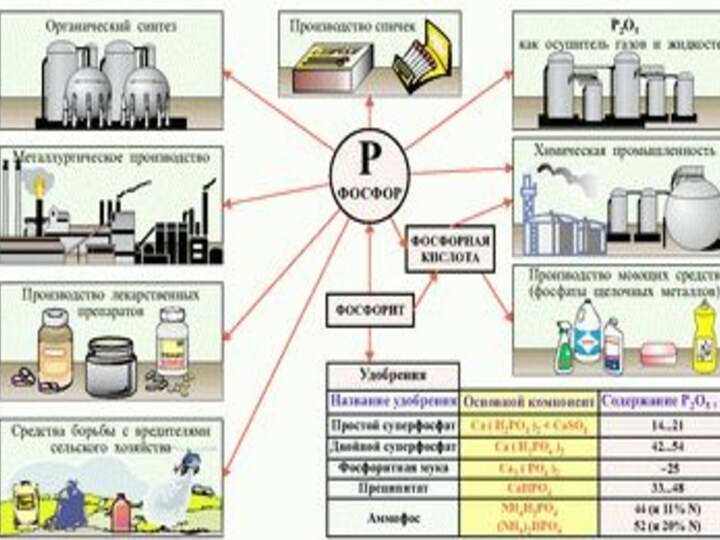


Слайд 2
ФОСФОР
Общая характеристика фосфора. Рассмотрение аллотропных видоизменений фосфора. Изучение
химических свойств фосфора.
и системы химических элементов на примере строения и свойств простых веществ, образованных фосфором
Слайд 3
История
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно
другим алхимикам, Бранд пытался отыскать филосовский камень, а получил
светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для его добычи.
Слайд 7
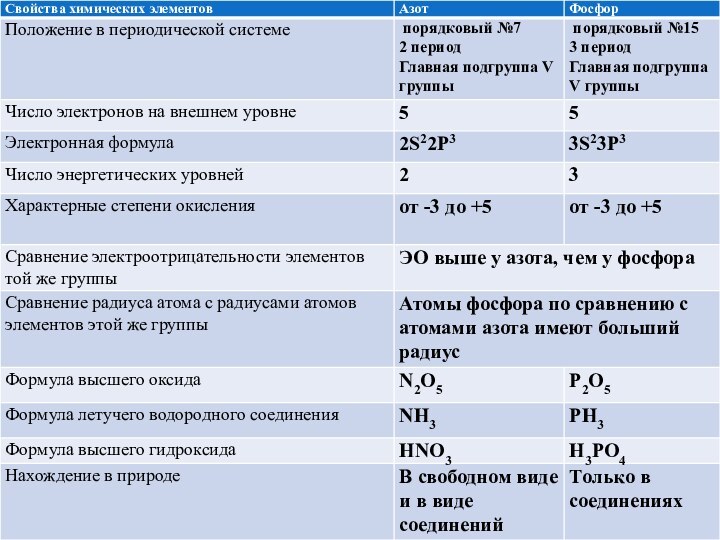
Сравнение фосфора и азота
еще один представитель
главной подгруппы V группы периодической системы, Так как в атоме фосфора
электронных слоев больше, чем в атоме азота, по сравнению с азотом атомы фосфора имеют больший радиус. Ядро фосфора будет слабее притягивать внешний электрон, чем ядро атома азота, отсюда меньшее значение электроотрицательности, а значит, более выраженные восстановительные свойства.Фосфор проявляет степени окисления -3, +3, +5. Самые устойчивые соединения со степенью окисления +5.
Слайд 8
Нахождение в природе и организме
В свободном состоянии в
природе не встречаются вследствие легкой окисляемости фосфора. Природные минералы
– фосфорит Сa3(РО4)2, апатит – Сa3(РО4)2•СaCI2 или Сa3(РО4)2•СaF2.Зубная эмаль, представляющая собой в соответствии со своими функциями самое твёрдое из веществ, тот же самый апатит.
В растениях фосфор сосредотачивается главным образом в семенах и плодах, в организме животных, птиц и рыб – в скелете и нервной ткани. В среднем тело человека содержится около 1,5 кг фосфора, из которых около 1,4 кг приходится на кости. Если бы фосфор исчез из костей, наше тело превратилось бы в бесформенные массы. Если бы фосфор исчез из мышц, мы утратили бы способность двигаться, из нервной ткани – мы перестали бы мыслить.
Академик А.Е. Ферсман назвал фосфор “элементом жизни и мысли”.
Слайд 9
Получение фосфора
Фосфор получают из апатитов или фосфоритов в
результате взаимодействия с коксом и кремнезёмом при температуре около 1600°С:
2Ca3(PO4)2 + 10C + 6SiO2 → P4 + 10CO + 6CaSiO3. Предварительно измельченная и обогащенная фосфорсодержащая руда смешивается в заданных соотношениях с кремнеземом и коксом и загружается в электропечь. Кремнезем необходим для снижения температуры реакции, а также увеличения ее скорости за счет связывания выделяющейся в процессе восстановления окиси кальция в силикат кальция, который непрерывно удаляется в виде расплавленного шлака.
Слайд 10 Аллотропия- явление, когда один и то же химический
элемент образует несколько простых веществ
Химический элемент фосфор образует несколько
аллотропных модификаций. Наиболее известны белый фосфор и красный фосфор.При длительном нагревании без доступа воздуха белый фосфор желтеет и постепенно превращается в красный. Красный фосфор при нагревании в таких же условиях превращается в пар, при конденсации которого образуется белый фосфор.
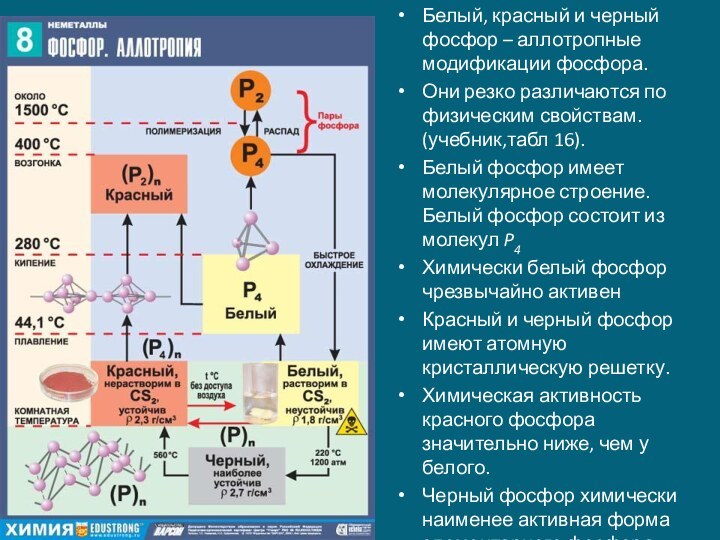
Слайд 11 Белый, красный и черный фосфор – аллотропные модификации
фосфора.
Они резко различаются по физическим свойствам. (учебник,табл 16).
Белый фосфор
имеет молекулярное строение. Белый фосфор состоит из молекул P4 Химически белый фосфор чрезвычайно активен
Красный и черный фосфор имеют атомную кристаллическую решетку.
Химическая активность красного фосфора значительно ниже, чем у белого.
Черный фосфор химически наименее активная форма элементарного фосфора
Слайд 12
Химические свойства фосфора
Химические свойства белого и красного фосфора
близки, но белый фосфор химически более активен.
Белый фосфор самовоспламеняется
на воздухе, а красный горит при поджигании:4P + 5O2 → 2P2O5 (с избытком кислорода),
4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода).
При взаимодействии с металлами образуются фосфиды:
3Ca + 2P = Ca3P2.
С водородом фосфор не реагирует, но при разложении водой или кислотами фосфидов образуется фосфин PH3 — ядовитый газ с неприятным запахом:
Ca3P2 + 6HCl = 3CaCl2 + 2PH3 ↑.
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3 ↑
Свойства фосфина -
PH3 + 2O2 = H3PO4.
PH3 + HI = PH4I
.
Слайд 13
С неметаллами — восстановитель:
2P + 3S → P2S3,
2P
+ 3Cl2 → 2PCl3.
Сильные окислители превращают фосфор в фосфорную кислоту:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO;
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O.
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
6P + 5KClO3 → 5KCl + 3P2O5
В холодных концентрированных растворах щелочей медленно протекает реакция диспропорционирования:
4P + 3KOH + 3H2O = PH3 + 3KH2PO3
Слайд 15
Осуществите превращения:
Осуществите превращения
Ca3(PO4)2 1 P
2 P2O5
Ca3P2
3 PH3 4 P2O5Для уравнений 1,2,4 составьте электронный баланс, укажите окислитель и восстановитель.