- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Факторы скорости химической реакции
Содержание
- 2. «Факторы химических реакций».
- 4. Демонстрируется опыт №1.
- 5. Демонстрируется опыт №2.
- 6. Демонстрируется опыт №3.
- 7. Демонстрируется опыт №4.Расчеты показывают, что при изменении
- 9. Правило Вант-Гоффа математически выражается
- 11. Задача №2 Вычислите, во сколько раз увеличится
- 12. Закрепление1) Какая из реакций будет идти быстрее?
- 13. Насколько сложно было работать?Что вызвало наибольшие затруднения?Оцените
- 14. Домашняя работа №1. Определите, как изменится скорость
- 15. Молодцы!
- 16. Правильно!
- 17. Неправильно!
- 18. Скачать презентацию
- 19. Похожие презентации
«Факторы химических реакций».

















Слайд 9 Правило Вант-Гоффа математически выражается следующей
формулой:
где
– скорость реакции при температуре t2,
– скорость реакции при температуре t1,
– температурный коэффициент.
Слайд 11
Задача №2
Вычислите, во сколько раз увеличится скорость
реакции при повышении температуры от 30 до 70 ∘
С, если температурный коэффициент скорости равен 2.Почему продукты хранят в холодильнике?
Можно ли сварить яйцо при температуре 80 С?
Слайд 12
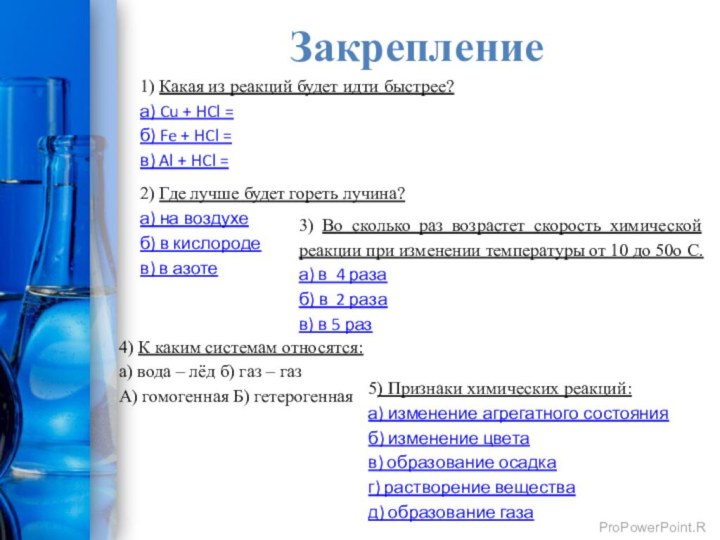
Закрепление
1) Какая из реакций будет идти быстрее?
а)
Cu + HCl =
б) Fe + HCl =
в)
Al + HCl =2) Где лучше будет гореть лучина?
а) на воздухе
б) в кислороде
в) в азоте
3) Во сколько раз возрастет скорость химической реакции при изменении температуры от 10 до 50o С.
а) в 4 раза
б) в 2 раза
в) в 5 раз
4) К каким системам относятся:
а) вода – лёд б) газ – газ
А) гомогенная Б) гетерогенная
5) Признаки химических реакций:
а) изменение агрегатного состояния
б) изменение цвета
в) образование осадка
г) растворение вещества
д) образование газа
Слайд 13
Насколько сложно было работать?
Что вызвало наибольшие затруднения?
Оцените свою
работу на уроке (светофор: красный- «Есть к чему стремиться,
но сегодня отдыхал», желтый – «Хорошо, могу еще лучше!», зеленый – «Очень старался, с урока уйду с пониманием изученной темы» . Ученики поднимают листочки, которые лежат с краю на парте и самостоятельно оценивают свою работу на уроке).Рефлексия
Слайд 14
Домашняя работа
№1. Определите, как изменится скорость некоторой реакции:
а) при повышении температуры от 10° до
50° С;б) при понижении температуры от 10° – 0° С.
Температурный коэффициент реакции равен 3.
№2. Закончите уравнение реакции и объяснить какая реакция будет идти быстрее?
Mg+H2SO4=
Zn+H2SO4=
Fe+H2SO4=
№ 3. Приведите примеры влияния факторов на скорость реакции на бытовом уровне.





























