Слайд 2
В электрохимии выделяют 2 основных вида процессов:
1)
самопроизвольные процессы, которые реализуются в аккумуляторах, в гальванических и
топливных элементах, при коррозионных процессах;
2) не самопроизвольные процессы – это электролиз растворов и расплавов (осаждение металлов, синтез органических и неорганических веществ, перекиси водорода, а также получения газов (Н2, О2, Сl2).
Слайд 3
Взаимное превращение электрической и химической форм энергии происходит
в электрохимических системах, состоящих из:
проводников первого рода – веществ,
обладающих электронной проводимостью и находящихся в контакте с электролитом - металлов;
проводников второго рода – веществ, обладающих ионной проводимостью – электролитов.
Слайд 4
Двойной электрический слой, его строение. Электродный потенциал.
Слайд 5
02.05.2018
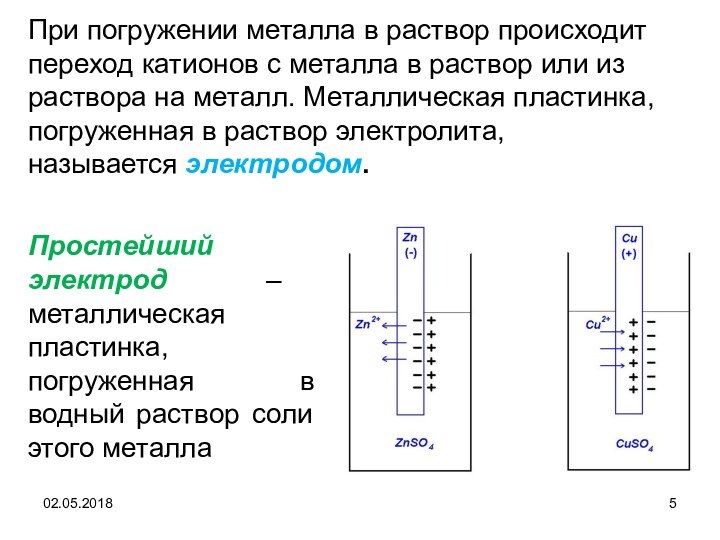
Простейший электрод – металлическая пластинка, погруженная в водный
раствор соли этого металла
При погружении металла в раствор
происходит переход катионов с металла в раствор или из раствора на металл. Металлическая пластинка, погруженная в раствор электролита, называется электродом.
Слайд 6
02.05.2018
Цинковый и медный электроды.
При погружении, цинковой пластинки, более
активного металла, в раствор соли цинка ZnSO4 происходит отрыв ионов цинка Zn2+ от
кристаллической решетки металла под влиянием полярных молекул растворителя. В результате перехода катионов в раствор металл приобретает отрицательный заряд за счет оставшихся на нем электронов, а прилежащий к нему слой раствора заряжается положительно за счет катионов, удерживаемых отрицательным зарядом металла. При погружении медной пластинки, менее активного металла, происходит процесс осаждения катионов из раствора на металле. Пластинка приобретает положительный заряд
Слайд 7
На границе раздела фаз возможны переходы поверхностных частиц
из одной фазы в другую:
Zn2+ + 2e = Zn
Cu2+
+ 2e = Cu
Слайд 8
SO4−2
Cu2+
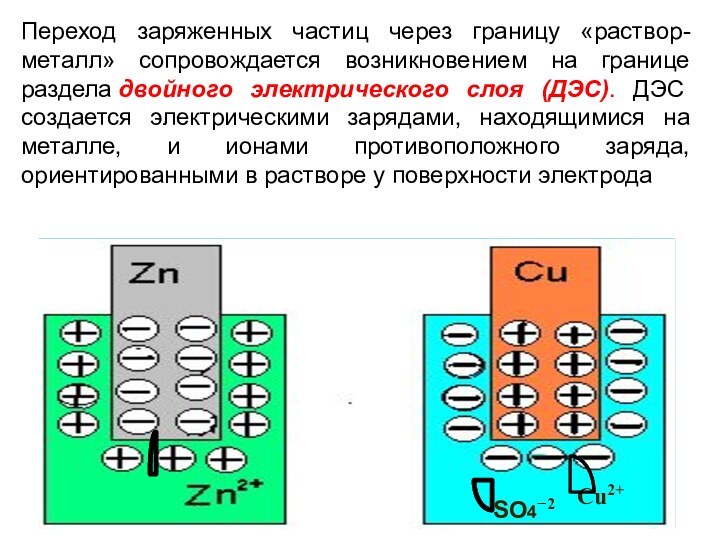
Переход заряженных частиц через границу «раствор-металл» сопровождается возникновением
на границе раздела двойного электрического слоя (ДЭС). ДЭС создается электрическими
зарядами, находящимися на металле, и ионами противоположного заряда, ориентированными в растворе у поверхности электрода
Слайд 9
Между металлом и раствором возникает разность потенциалов, которая
называется электродным потенциалом или потенциалом электрода (ϕ).
Слайд 10
Электродный потенциал зависит от природы материала электрода,
температуры,
концентрации
раствора и других свойств системы.
Абсолютное значение электродного потенциала
измерить нельзя. Его измеряют относительно электрода сравнения в стандартных условиях.
Слайд 11
Стандартные электроды. Водородный электрод
H+, H2 Pt
Стандартный
водородный электрод представляет собой платиновую пластинку, покрытую тонким слоем
рыхлой пористой платины (для увеличения поверхности электрода) и опущенную в водный раствор серной кислоты. Через раствор серной кислоты пропускают водород под атмосферным давлением.
2Н+ + 2ē = Н2
Стандартные электроды - это электроды, работающие при стандартных условиях: температуре 298 К (25ºС), давлении 101325Па и концентрации ионов в растворе 1 моль/л.
Слайд 12
Электродный потенциал водородного электрода принят равным нулю
Стандартные электродные
потенциалы
Потенциалы других электродов, измеренные в стандартных условиях по отношению
к стандартному водородному электроду, называются стандартными электродными потенциалами или окислительно-восстановительными потенциалами. Обозначаются как ϕ° (E °)
Слайд 13
02.05.2018
Электрохимический ряд напряжений металлов
По величине стандартных электродных потенциалов
металлы расположены в ряд, называемый электрохимическим рядом напряжений:
Слайд 14
Ряд напряжений металлов:
Электр. процесс ϕо, В Электр. процесс ϕо,
В
К - е- = К+ - 2,92 Co - 2e- =
Co2+ - 0,28
Ba - 2e- = Br2+ - 2,91 Ni - 2e- = Ni2+ - 0,25
Ca - 2e- = Ca2+ - 2,87 Sn - 2e- = Sn2+ - 0,14
Na - e- = Na+ - 2,81 Pb - 2e- = Pb2+ - 0,13
Mg - 2e- = Mg2+ - 2,36 H2 - 2e- = 2H+ 0,00
Be - 2e- = Be2+ - 1,85 Bi - 3e- = Bi3+ 0,22
Al - 3e- = Al3+ - 1,66 Cu - 2e- = Cu2+ 0,34
Mn - 2e- = Mn2+ - 1,18 Ag - e- = Ag+ 0,80
Zn - 2e- = Zn2+ - 0,76 Hg - 2e- = Hg2+ 0,85
Fe - 2e- = Fe2+ - 0,44 Pt - 2e- = Pt2+ 1,19
Cd - 2e- = Cd2+ - 0,40 Au - 3e- = Au3+ 1,50
Слайд 15
Свойства ряда напряжений металлов
Восстановительная активность Ме в ряду
напряжений уменьшается слева направо
Окислительная способность катионов Ме увеличивается слева
направо
Все Ме c ϕо < 0 В (кроме Pb), вытесняют Н2 из разбавленных растворов кислот (HCl разб., H2SO4разб.).
Каждый предшествующий Ме в ряду напряжений вытесняет любой последующий Ме из раствора его соли.
Чем дальше расположены друг от друга Ме в ряду напряжений, тем бóльшую электродвижущую силу (ε) будет иметь построенный из них гальванический элемент.
Слайд 16
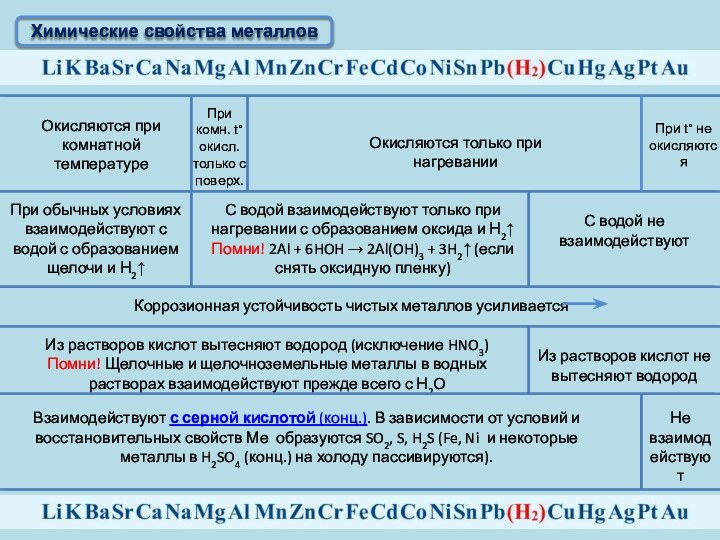
Химические свойства металлов
Окисляются при комнатной температуре
При комн.
t°окисл. только с поверх.
Окисляются только при нагревании
При t°
не окисляются
При обычных условиях взаимодействуют с водой с образованием щелочи и Н2↑
С водой взаимодействуют только при нагревании с образованием оксида и Н2↑
Помни! 2Al + 6HOH → 2Al(OH)3 + 3H2↑ (если снять оксидную пленку)
С водой не взаимодействуют
Коррозионная устойчивость чистых металлов усиливается
Из растворов кислот вытесняют водород (исключение HNO3)
Помни! Щелочные и щелочноземельные металлы в водных растворах взаимодействуют прежде всего с Н2О
Из растворов кислот не вытесняют водород
Взаимодействуют с серной кислотой (конц.). В зависимости от условий и восстановительных свойств Ме образуются SO2, S, H2S (Fe, Ni и некоторые металлы в H2SO4 (конц.) на холоду пассивируются).
Не взаимодействуют
Слайд 17
02.05.2018
Расчет электродного потенциала. Уравнение Нернста
Если условия отличаются от
стандартных:
E° - станд.эл.потенциал Ме, В
n – число ē в
процессе
F – число Фарадея 96500 Кл/моль
Слайд 18
Ещё один вид уравнения Нернста:
или
Слайд 19
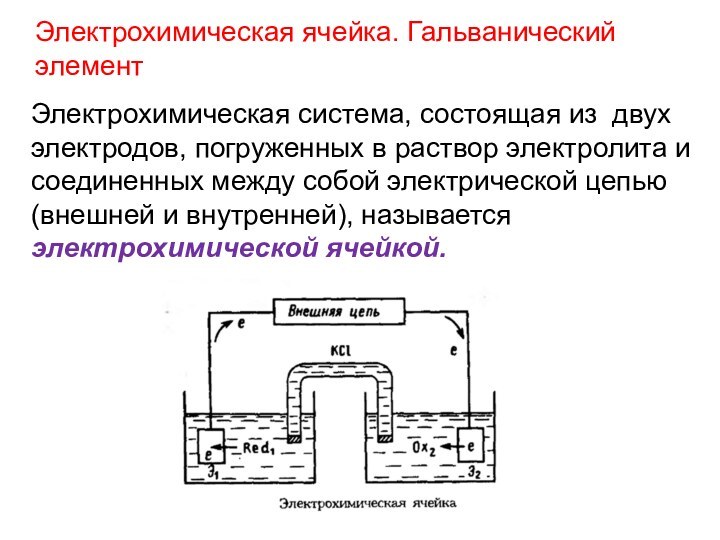
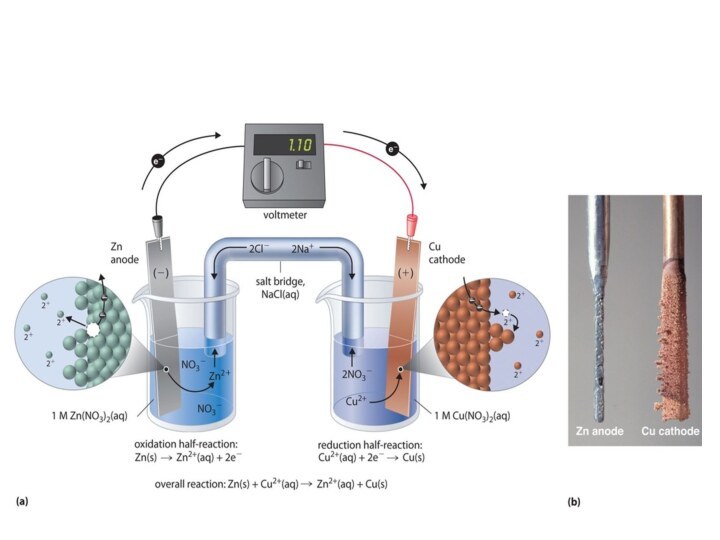
Электрохимическая ячейка. Гальванический элемент
Электрохимическая система, состоящая из двух
электродов, погруженных в раствор электролита и соединенных между собой
электрической цепью (внешней и внутренней), называется электрохимической ячейкой.
Слайд 20
02.05.2018
Два основных типа электрохимических ячеек: гальванический элемент;
электролитическая
ячейка.
В гальваническом элементе самопроизвольно протекает химическая реакция, в результате
чего он является источником электрической энергии (химическим источником тока) (батарейки, аккумуляторы).
В электролитической ячейке наоборот электрическая энергия внешнего источника напряжения, необходима для протекания несамопроизвольной химической реакции в направлении, противоположном по сравнению с реакцией в гальваническом элементе (электролиз).
Слайд 21
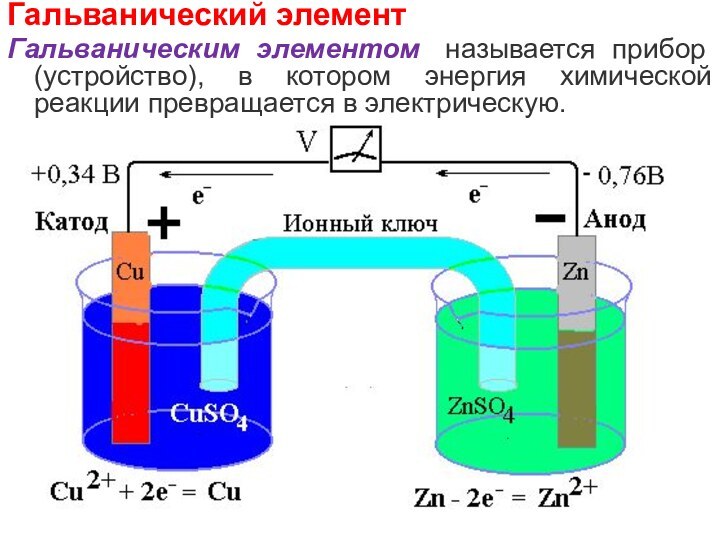
Гальванический элемент
Гальваническим элементом называется прибор (устройство), в котором
энергия химической реакции превращается в электрическую.
Слайд 22
02.05.2018
Накапливание ионов Zn+2 в первом сосуде и SO42− – во
втором приведёт к остановке реакций. Во избежание этого оба
раствора соединяют с помощью U-образной трубки («солевого мостика», «ионный ключ»), заполненной раствором электролита (как правило, KCl + агар-агар). Это делает возможной диффузию ионов Zn+2 и SO42− (можно использовать также мембрану).
Слайд 24
Электроды гальванического элемента:
Анод (отрицательный электрод, восстановитель, процесс окисления)
– электрод, изготовленный из более активного Mе, с меньшим
значение потенциала ϕо.
Катод (положительный электрод, окислитель, процесс восстановления) – электрод, изготовленный из менее активного Mе, с большим значение потенциала ϕо.
В гальванических элементах перенос электронов от восстановителя к окислителю происходит по внешнему пути, а не непосредственно между реагентами.
Слайд 25
Электрохимическая схема гальванического элемента
А(-) Zn/ZnSO4//CuSO4/Cu (+)К
Токообразующая реакция:
А(-): Zn
– 2e = Zn2+
К(+): Cu2+ + 2e = Cu
Zn
+ Cu2+ = Zn2+ + Cu
CuSO4 + Zn = ZnSO4 + Cu
Слайд 26
Разность потенциалов катода и анода называется электродвижущей силой (ЭДС) гальванического
элемента и вычисляется по формуле:
ЭДС = Е0 катода -
Е0анода
ЭДС = ∆E° = E°катода (Сu2+|Cu)– E°анода (Zn2+|Zn)– =
= 0,34-(0.76)=1.1 В
При этом ЭДС всегда будет величиной положительной.
Слайд 27
02.05.2018
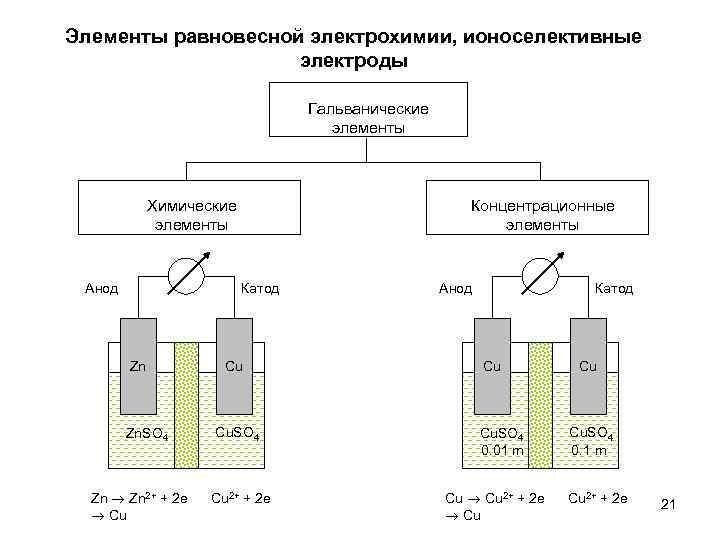
Гальванический элемент, в котором источником энергии является не
химическая реакция, а работа выравнивания концентраций (активностей) ионов, называется концентрационным.
Он может состоять из двух одинаковых металлических электродов, погруженных в растворы одной и той же соли, но с различной концентрацией (активностью) ионов металла.
Слайд 28
02.05.2018
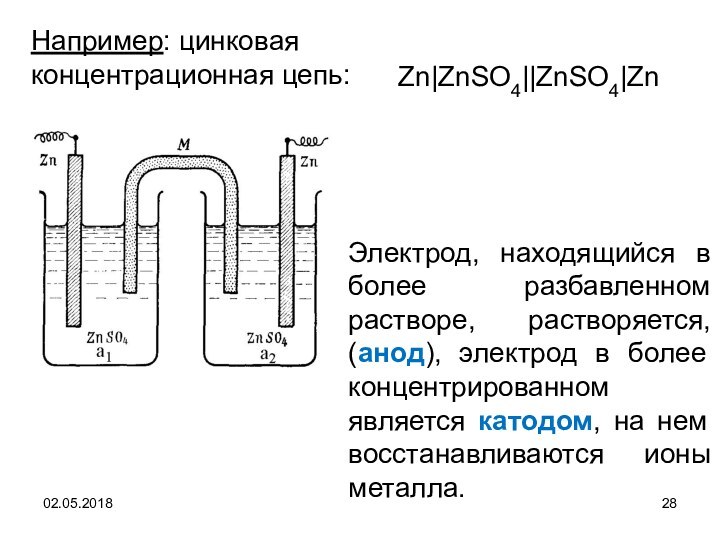
Zn|ZnSO4||ZnSO4|Zn
Например: цинковая концентрационная цепь:
Электрод, находящийся в более разбавленном
растворе, растворяется, (анод), электрод в более концентрированном является катодом,
на нем восстанавливаются ионы металла.
Слайд 30
02.05.2018
Например для элемента Якоби-Даниэля ЭДС рассчитывается с помощью
уравнения Нернста. ЭДС всегда является положительной величиной и равна
разности электродных потенциалов катода и анода:
Расчет ЭДС
Расчет ЭДС химического гальванического элемента:
Слайд 31
02.05.2018
ЭДС концентрационного гальванического элемента равна:
При этом а1> a2
Слайд 32
02.05.2018
Диффузионные потенциалы возникают на границе соприкосновения двух растворов
(растворы разных веществ или растворы одного и того же
вещества, но с разными концентрациями).
При соприкосновении двух растворов происходит взаимопроникновение в них частиц (ионов) растворенных веществ вследствие процесса диффузии.
Слайд 33
02.05.2018
Причина возникновения диффузионного потенциала заключается в неодинаковой подвижности
ионов растворенных веществ. Если ионы электролита обладают разной скоростью
диффузии, то более быстрые ионы постепенно оказываются впереди менее подвижных. Образуются как бы две волны разнозаряженных частиц.
Если смешиваются растворы одного и того же вещества, но с разной концентрацией, то более разбавленный раствор приобретает заряд, совпадающий по знаку с зарядом более подвижных ионов, а менее разбавленный – заряд, совпадающий по знаку с зарядом менее подвижных ионов.