- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему К уроку химии +ОБЖ: основания и щелочи
Содержание
- 2. ОСНОВАНИЯМИ НАЗЫВАЮТСЯ ВЕЩЕСТВА, В КОТОРЫХ АТОМЫ
- 3. ФИЗИЧЕСКИЕ СВОЙСТВА.Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твердые, белые, очень гигроскопичные вещества.
- 4. Сила основания и растворимость в воде возрастает
- 5. ОБЩАЯ ФОРМУЛА ОСНОВАНИЙ МЕ(ОН)N.
- 6. ХИМИЧЕСКИЕ СВОЙСТВА.В твёрдом состоянии все щелочи поглощают
- 7. Взаимодействие с индикаторами щелочи окрашивают фиолетовый лакмус
- 9. ДИССОЦИАЦИЯ КОН + nН2О К+×mН2О + ОН–×dН2О
- 10. ВЗАИМОДЕЙСТВИЕ ЩЕЛОЧЕЙ С НЕКОТОРЫМИ МЕТАЛЛАМИ: В растворе:
- 11. ВЗАИМОДЕЙСТВИЕ ЩЕЛОЧЕЙ С НЕМЕТАЛЛАМИ: 6NaOH + 3Cl2 5NaCl + NaClO3 + 3H2O.
- 12. ВЗАИМОДЕЙСТВИЕ ЩЕЛОЧЕЙ С КИСЛОТНЫМИ И АМФОТЕРНЫМИ ОКСИДАМИ:
- 13. СИЛА ОСНОВАНИЯ ВАЖНА В РЕАКЦИЯХ СО СЛАБЫМИ
- 14. 2 NaOH + H2Sсильное основание слабая кислота=Na2S + 2 H2O продуктов реакции больше
- 15. ЕЩЕ ОДНО ВАЖНОЕ ХИМИЧЕСКОЕ СВОЙСТВО ОСНОВАНИЙ –
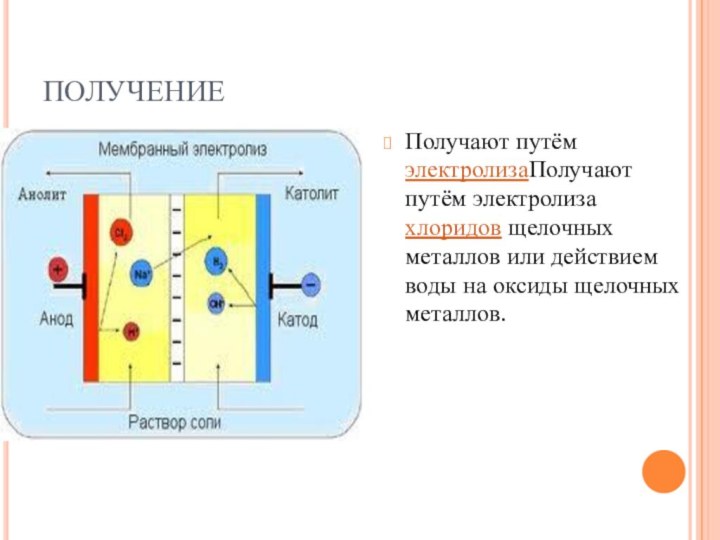
- 16. ПОЛУЧЕНИЕПолучают путём электролизаПолучают путём электролиза хлоридов щелочных металлов или действием воды на оксиды щелочных металлов.
- 17. ПРИМЕНЕНИЕШирокое применение в химической промышленности(нейтрализация, гидролиз, травление
- 18. ЩЕЛОЧИ В БИОЛОГИИПринимают участие во многих биохимических
- 19. ЩЕЛОЧИ ВЫЗЫВАЮТ КОЛЛИКВАЦИОННЫЙ (ВЛАЖНЫЙ) НЕКРОЗ, БЫСТРО РАСПРОСТРАНЯЮЩИЙСЯ
- 20. Степень ожога зависит от времени воздействия, количества
- 21. ЩЕЛОЧНОСТЬ ВОДЫПонятие щелочности воды определяется количеством щелочных
- 22. ЩЕЛОЧНЫЕ КОМПОНЕНТЫ МОГУТ
- 23. Жидкостные и пенные огнетушители представляют собой металлические
- 24. Преимущество пенных огнетушителей (ОПХ–5) заключается в том,
- 25. Химически активные реагенты и их смеси представляют
- 26. ИСТОЧНИКИ:Большая Советская энциклопедияhttp://www.proelectro.info/en/company/propositions/2291http://ru.wikipedia.org/wiki/%D0%A9%D1%91%D0%BB%D0%BE%D1%87%D0%B8http://www.xumuk.ru/encyklopedia/2/5261.htmlhttp://humbio.ru/humbio/env_fact/00033a38.htmhttp://www.intergreen.ru/docs/recycling_acid.htmlhttp://ecouniversal.ru/ru/services/recycling/himicheskie-othody
- 27. Скачать презентацию
- 28. Похожие презентации
ОСНОВАНИЯМИ НАЗЫВАЮТСЯ ВЕЩЕСТВА, В КОТОРЫХ АТОМЫ МЕТАЛЛА СВЯЗАНЫ С ГИДРОКСИ-ГРУППАМИ.Щёлочи — гидроксиды щелочных — гидроксиды щелочных, щёлочноземельных металлов — гидроксиды щелочных, щёлочноземельных металлов и аммония. К щёлочам относят хорошо растворимые в воде основания. При диссоциации щёлочи образуют анионы

























Слайд 2 ОСНОВАНИЯМИ НАЗЫВАЮТСЯ ВЕЩЕСТВА, В КОТОРЫХ АТОМЫ МЕТАЛЛА СВЯЗАНЫ
С ГИДРОКСИ-ГРУППАМИ.
щелочных, щёлочноземельных металлов и аммония. К щёлочам относят хорошо растворимые в воде основания. При диссоциации щёлочи образуют анионы OH− и катион металла.
Слайд 3
ФИЗИЧЕСКИЕ СВОЙСТВА.
Гидроксиды щелочных металлов (едкие щёлочи) представляют собой
твердые, белые, очень гигроскопичные вещества.
Слайд 4
Сила основания и растворимость в воде возрастает с
увеличением радиуса катиона в каждой группе периодической системы.
Самые сильные
щёлочи — гидроксид цезияСамые сильные щёлочи — гидроксид цезия в группе Ia и гидроксид радияСамые сильные щёлочи — гидроксид цезия в группе Ia и гидроксид радия в группе IIa. Кроме того, едкие щёлочи растворимы в этанолеСамые сильные щёлочи — гидроксид цезия в группе Ia и гидроксид радия в группе IIa. Кроме того, едкие щёлочи растворимы в этаноле и метаноле
Слайд 6
ХИМИЧЕСКИЕ СВОЙСТВА.
В твёрдом состоянии все щелочи поглощают H2O
из воздуха, а также CO2 постепенно превращаясь в карбонаты.
Важное
химическое свойство щелочей — способность образовывать соли в реакции с кислотами.
Слайд 7
Взаимодействие с индикаторами
щелочи окрашивают фиолетовый лакмус в
синий цвет, метилоранж – в желтый, а фенолфталеин –
в малиновыйиндикатор + ОН– (щелочь)
окрашенное соединение.
Слайд 9
ДИССОЦИАЦИЯ
КОН + nН2О К+×mН2О + ОН–×dН2О сокращенно:
КОН К+ + ОН–.
Многокислотные основания диссоциируют по нескольким
ступеням.Пример: двухкислотное основание Fe(OH)2 диссоциирует по двум ступеням:
Fe(OH)2 FeOH+ + OH– (1 ступень);
FeOH+ Fe2+ + OH– (2 ступень).
Слайд 10
ВЗАИМОДЕЙСТВИЕ ЩЕЛОЧЕЙ С НЕКОТОРЫМИ МЕТАЛЛАМИ:
В растворе:
2Al +
2NaOH + 6H2O => 2Na[Al(OH)4] + 3H2
2Al + 2OH–
+ 6H2О => 2[Al(OH)4]– + 3H2.При сплавлении:
2Al + 2NaOH + 2H2O 2NaAlО2 + 3H2.
Слайд 12
ВЗАИМОДЕЙСТВИЕ ЩЕЛОЧЕЙ С КИСЛОТНЫМИ И АМФОТЕРНЫМИ ОКСИДАМИ:
2NaOH +
СО2 => Na2CO3 + H2O
2OH– + CO2
=>CO32– + H2O.В растворе:
2NaOH + ZnO + H2O =>Na2[Zn(OH)4]
2OH– + ZnO + H2О =>[Zn(OH)4]2–
При сплавлении с амфотерным оксидом:
2NaOH + ZnO Na2ZnO2 + H2O.
Слайд 13 СИЛА ОСНОВАНИЯ ВАЖНА В РЕАКЦИЯХ СО СЛАБЫМИ КИСЛОТАМИ.
СЛАБОЕ ОСНОВАНИЕ И СЛАБАЯ КИСЛОТА РЕАГИРУЮТ ЛИШЬ В НЕЗНАЧИТЕЛЬНОЙ
СТЕПЕНИ. НАПРОТИВ, СИЛЬНОЕ ОСНОВАНИЕ ЛЕГЧЕ РЕАГИРУЕТ С ЛЮБОЙ КИСЛОТОЙ НЕЗАВИСИМО ОТ ЕЁ СИЛЫ.2 NH4OH + H2S
слабое основание слабая кислота
=
(NH4)2S+2 H2O
реакция протекает лишь в незначительной степени -мало продуктов реакции.
Слайд 15 ЕЩЕ ОДНО ВАЖНОЕ ХИМИЧЕСКОЕ СВОЙСТВО ОСНОВАНИЙ – СПОСОБНОСТЬ
РАЗЛАГАТЬСЯ ПРИ НАГРЕВАНИИ НА ВОДУ И ОСНОВНОЙ ОКСИД.
Cu(OH)2 =
CuO + H2O (при нагревании)2 Fe(OH)3 = Fe2O3 + 3 H2O (при нагревании)
Слайд 16
ПОЛУЧЕНИЕ
Получают путём электролизаПолучают путём электролиза хлоридов щелочных металлов
или действием воды на оксиды щелочных металлов.
Слайд 17
ПРИМЕНЕНИЕ
Широкое применение
в химической промышленности(нейтрализация, гидролиз, травление металлов
и т.д.).
Многие щёлочи - основные продукты химического производства
и используются в качестве исходных веществ. Изготовление биодизеля,
Производство моющих веществ,
Растворение отложений в канализационных трубах.
Слайд 18
ЩЕЛОЧИ В БИОЛОГИИ
Принимают участие во многих биохимических процессах.
Направленное воздействие оснований используется в медицине.
При попадании в
организм концентрированных щелочей возможны сильные ожоги внутренних органов, падение сердечной деятельности и т.д., приводящие в ряде случаев к гибели организмаСлайд 19 ЩЕЛОЧИ ВЫЗЫВАЮТ КОЛЛИКВАЦИОННЫЙ (ВЛАЖНЫЙ) НЕКРОЗ, БЫСТРО РАСПРОСТРАНЯЮЩИЙСЯ В
ГЛУБЬ ТКАНЕЙ.
Риск перфорации пищевода и желудка при отравлении щелочами
выше, чем при отравлении кислотами!В обоих случаях возможны ожоги рта, пищевода и желудка. Если ожогов рта нет, то это еще не исключает поражений пищевода и желудка. В жидком виде кислоты и щелочи вызывают более поверхностные, часто циркулярные ожоги на большей поверхности, а в твердом (например, в таблетках) - ограниченные, но глубокие ожоги.
Слайд 20
Степень ожога зависит от времени воздействия, количества и
рН попавшего внутрь вещества (особенно опасны кислоты с рН
меньше 2 и щелочи с рН больше 12).
Слайд 21
ЩЕЛОЧНОСТЬ ВОДЫ
Понятие щелочности воды определяется количеством щелочных компонентов,
присутствующих в воде.
Они действуют как нейтрализаторы в
изменениях рН.Когда вода находится в идеальном интервале Рн(7,2-7,6), ее щелочность в основном определяется бикарбонатами.
Слайд 22
ЩЕЛОЧНЫЕ КОМПОНЕНТЫ МОГУТ БЫТЬ СЛЕДУЮЩИЕ:
Бикарбонаты (HCO3-) в диапазоне
рН 6,0-8,3
Карбонаты (CO32-) в диапазоне рН 8,3-10,2
Гидрооксиды (OH-) в
диапазоне рН свыше 10,2 Слайд 23 Жидкостные и пенные огнетушители представляют собой металлические баллоны,
заполненные щелочной жидкостью, внутрь которой введена стеклянная или полиэтиленовая
трубка (стакан).К стеклянной трубке снаружи подведен ударник. От удара ударник разбивает трубку. выбрасывается струя пены длиной от 8 до 12м. Продолжительность действия огнетушителя примерно 60сек.
ЩЕЛОЧИ В ЖИЗНЕДЕЯТЕЛЬНОСТИ ЧЕЛОВЕКА
Слайд 24
Преимущество пенных огнетушителей
(ОПХ–5) заключается в том, что
пена гасит большинство горящих веществ, в том числе горящие
жидкости(масла, керосин, бензин, нефть).
Слайд 25 Химически активные реагенты и их смеси представляют собой
достаточно опасные для человеческого организма и окружающей среды вещества,
которые также могут являться причиной возникновения множества заболеваний. Поэтому их необходимо деактивировать путем переработки в специальных установках.Проводится специально обученными специалистами, имеющими большой опыт проведения утилизации такого рода.