Слайд 2
Ознакомимся с понятием:
Гидролиз — это
реакция обменного разложения веществ водой.
Гидролизу подвергаются различные вещества: неорганические
- соли, карбиды и гидриды металлов, галогениды неметаллов; органические — галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды.
Реакции гидролиза могут протекать обратимо и необратимо.
Слайд 3
Гидролиз органических веществ
1. Гидролиз галогеналканов используют дли получения
спиртов.
Присутствие щелочи (ОН ) позволяет «связать» получающуюся кислоту и
сместить равновесие в сторону образования спирта.
2. Гидролиз сложных эфиров протекает обратимо в кислотной среде (в присутствии неорганической кислоты) с образованием соответствующего спирта и карбоновой кислоты.
Для смещения химического равновесия в сторону продуктов реакции гидролиз проводят в присутствии щелочи.
Слайд 4
Историческая справка
Исторически первым примером такой реакции было щелочное
расщепление сложных эфиров высших жирных кислот, что привело к
получению мыла.
Это произошло в 1811 г., когда французский ученый Э. Шеврёль, нагревая жиры с водой в щелочной среде, получил глицерин и мыла — соли высших карбоновых кислот. На основании этого эксперимента был установлен состав жиров, они оказались сложными эфирами, но только «трижды сложными, производными трехатомного спирта глицерина — триглицеридамин.
А процесс гидролиза сложных эфиров в щелочной среде до сих пор называют «омылением».
Слайд 5
В 1808 году французский химик Мишель Эжен Шеврёль
(1786—1889) по просьбе владельцев текстильной фабрики установил состав мыла.
В результате анализа оказалось, что мыло — это натриевая соль высшей жирной (карбоновой) кислоты.
Слайд 6
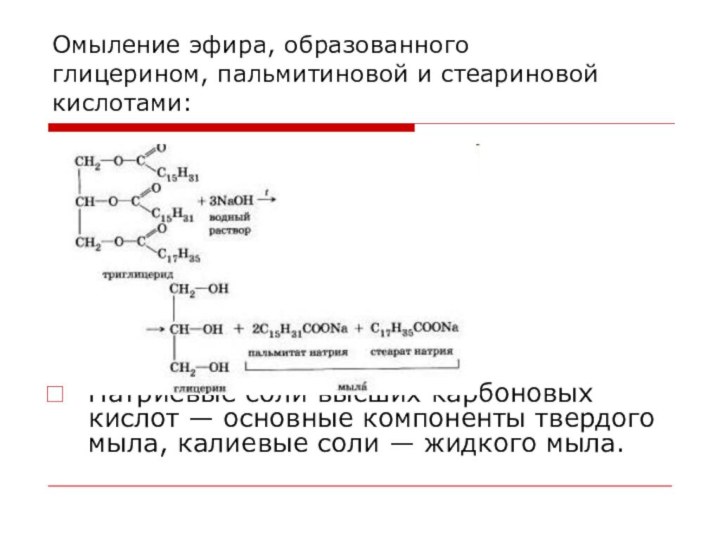
Омыление эфира, образованного глицерином, пальмитиновой и стеариновой кислотами:
Натриевые
соли высших карбоновых кислот — основные компоненты твердого мыла,
калиевые соли — жидкого мыла.
Слайд 7
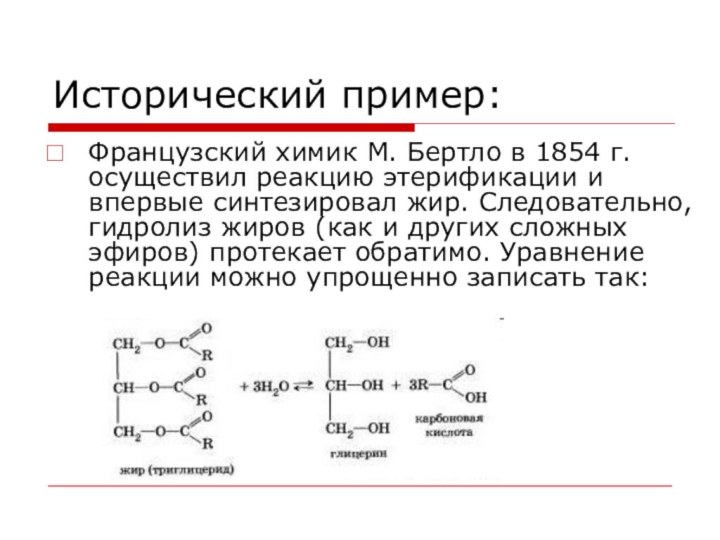
Исторический пример:
Французский химик М. Бертло в 1854 г.
осуществил реакцию этерификации и впервые синтезировал жир. Следовательно, гидролиз
жиров (как и других сложных эфиров) протекает обратимо. Уравнение реакции можно упрощенно записать так:
Слайд 8
Биологический аспект:
В живых организмах происходит ферментативный гидролиз жиров.
В кишечнике под влиянием фермента липазы жиры пищи гидратизуются
на глицерин и органические кислоты, которые всасываются стенками кишечника, и в организме синтезируются новые жиры, свойственные данному организму.
Они по лимфатической системе поступают в кровь, а затем в жировую ткань. Отсюда жиры поступают в другие органы и ткани организма, где в процессе обмена веществ в клетках опять гидролизуются и затем постепенно окисляются до оксида углерода и воды с выделением энергии, необходимой для жизнедеятельности.
Слайд 9
Гидролиз солей:
Сущность гидролиза сводится к обменному химическому взаимодействию
катионов или анионов соли с молекулами воды. В результате
этого взаимодействия образуется мало диссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов Н- или ОН+ и раствор соли становится кислотным или щелочным соответственно.
Слайд 10
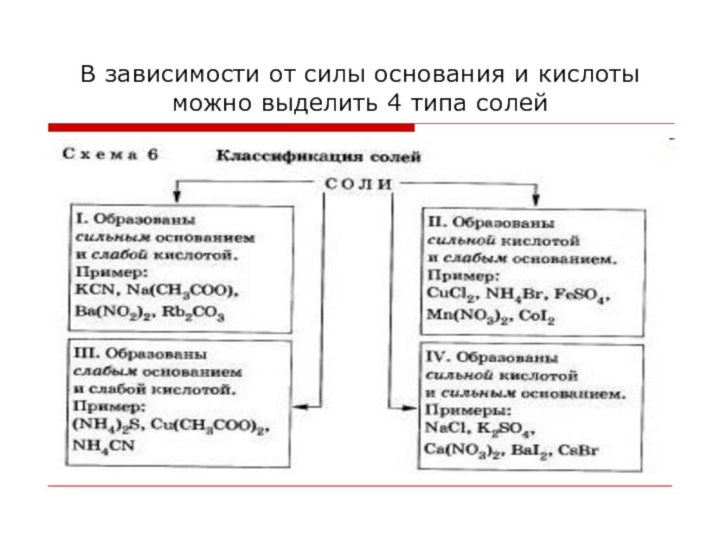
В зависимости от силы основания и кислоты можно
выделить 4 типа солей
Слайд 11
Соли, образованные сильным основанием и слабой кислотой:
а) во
аниону соли, как правило, гидролизуются обратимо;
б) химическое равновесие в
таких реакциях сильно смещено влево;
в) реакция среды в растворах подобных солеи щелочная (рН > 7);
г) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
Слайд 12
Соли, образованные сильной кислотой и слабым основанием.
а) по
катиону соли, как правило, гидролизуются обратимо
б) химическое равновесие реакций
сильно смещено влево
Слайд 13
Соли, образованные слабым основанием и слабой кислотой.
а) если
соли гидролизируются и по катиону, и по аниону обратимо,
то химическое равновесие в реакциях гидролиза смещено вправо;
б) реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующегося основания и кислоты;
в) соли могут гидролизироваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
Слайд 14
Соли, образованные сильным основанием и сильной кислотой, не
подвергаются гидролизу: