- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Углерод
Содержание
- 2. Цель урока: повторить строение атома и аллотропию на примере углерода. Рассмотреть химические свойства углерода.
- 3. Строение атома углеродаРасположение электронов в атоме углерода
- 4. Некоторые характеристики элементов подгруппы углерода.
- 5. Физические свойстваАлмазПрозрачное вещество, сильно лучепреломляемоеХимически устойчивое вещество.
- 6. Алмазный фонд
- 7. ФуллеренФуллерен
- 8. АдсорбцияАбсорбция — поглощение газов или растворенных веществ
- 9. Окислительно-восстановительные свойства углерода0С- 4СH4Na4СMg2Скарбиды+2СO+4СO2H2СO3K2СO3карбонатыЗадание: проанализируйте химические свойства
- 10. Окислительно-восстановительные свойства углерода0С- 4СH4Na4СMg2Скарбиды+2СO+4СO2H2СO3K2СO3карбонатыЗадание: проанализируйте химические свойства
- 11. Окислительно-восстановительные свойства углерода0-4+2+4Окислительные свойстваС+4eСH4Na4С
- 12. Взаимодействие с простыми веществамиУглерод окислитель1.С металлами: а)
- 13. Окислительно-восстановительные свойства углерода0-2+2+4Восстановительные свойства ССOСO2H2СO3СCl4- 2e- 4e
- 14. Взаимодействие с простыми веществамиУглерод восстановительС кислородом
- 15. CaCO3- мел, известняк, мраморCaCO3* MgCO3 – доломит.В
- 16. Скачать презентацию
- 17. Похожие презентации
Цель урока: повторить строение атома и аллотропию на примере углерода. Рассмотреть химические свойства углерода.












Слайд 2 Цель урока: повторить строение атома и аллотропию на
примере углерода. Рассмотреть химические свойства углерода.
Слайд 3
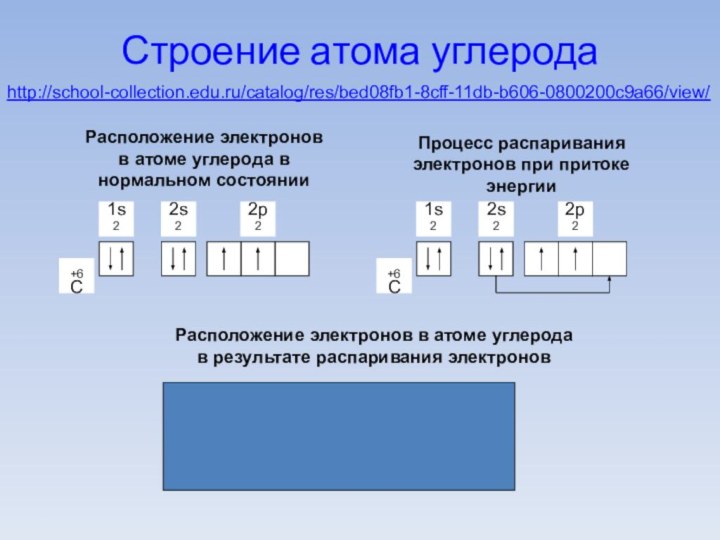
Строение атома углерода
Расположение электронов в атоме углерода в
нормальном состоянии
Процесс распаривания электронов при притоке энергии
1s2
2s1
2p3
+6С
Расположение электронов в
атоме углерода в результате распаривания электроновhttp://school-collection.edu.ru/catalog/res/bed08fb1-8cff-11db-b606-0800200c9a66/view/
Слайд 5
Физические свойства
Алмаз
Прозрачное вещество, сильно лучепреломляемое
Химически устойчивое вещество. Очень
твердый
В атмосфере кислорода сгорает при температуре 700-800 градусов
Графит
Вещество
серо-стального цветаХимически инертен
Кристаллы имеют слоистую структуру
Плотность 2,22-2,26 г/см3
Углерод
Аморфный
углерод
Мелкокристаллический
Графит: сажа, кокс,
древесный уголь
Слайд 8
Адсорбция
Абсорбция — поглощение газов или растворенных веществ из
смесей поглотителями, называемыми абсорбентами.
Товий Егорович Ловиц
Николай Дмитриевич
Зелинский
Слайд 9
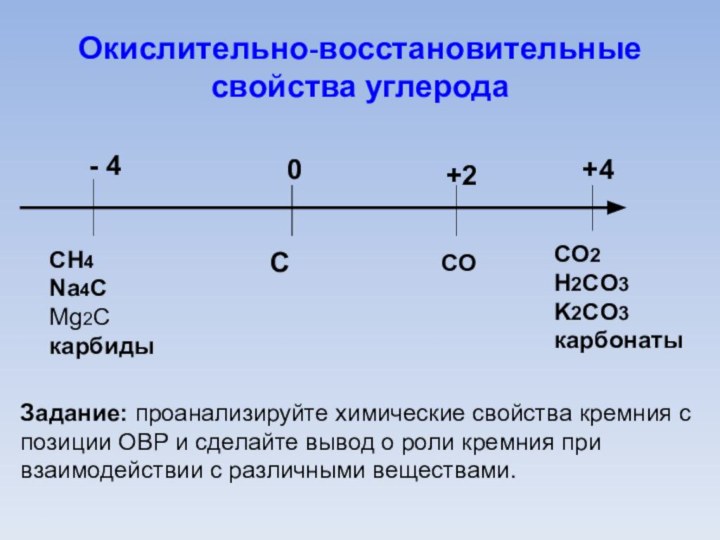
Окислительно-восстановительные свойства углерода
0
С
- 4
СH4
Na4С
Mg2С
карбиды
+2
СO
+4
СO2
H2СO3
K2СO3
карбонаты
Задание: проанализируйте химические свойства углерода
с позиции ОВР и сделайте вывод о роли углерода
при взаимодействии с различными веществами.
Слайд 10
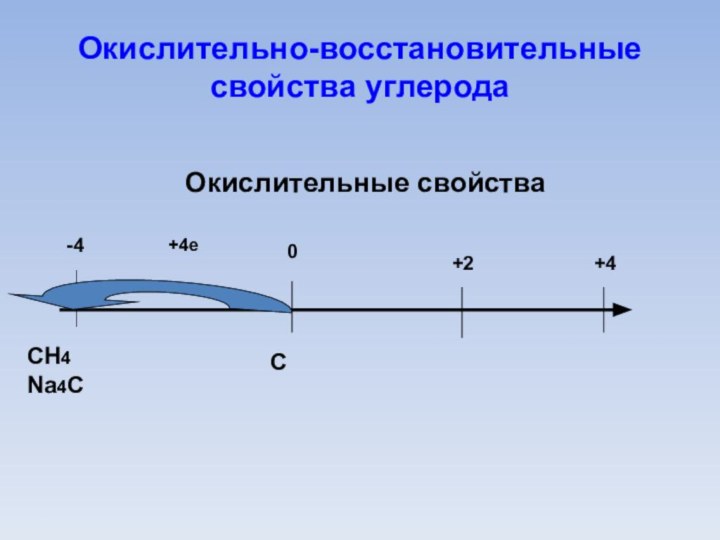
Окислительно-восстановительные свойства углерода
0
С
- 4
СH4
Na4С
Mg2С
карбиды
+2
СO
+4
СO2
H2СO3
K2СO3
карбонаты
Задание: проанализируйте химические свойства кремния
с позиции ОВР и сделайте вывод о роли кремния
при взаимодействии с различными веществами.
Слайд 12
Взаимодействие с простыми веществами
Углерод окислитель
1.С металлами:
а) Ca0+
C0 = Ca+2C-12 карбид кальция
б) 4Al0 + 3С0
= Al+34С-43 карбид алюминия2. С водородом
2H02 + С0 = СH+14 метан
Слайд 13
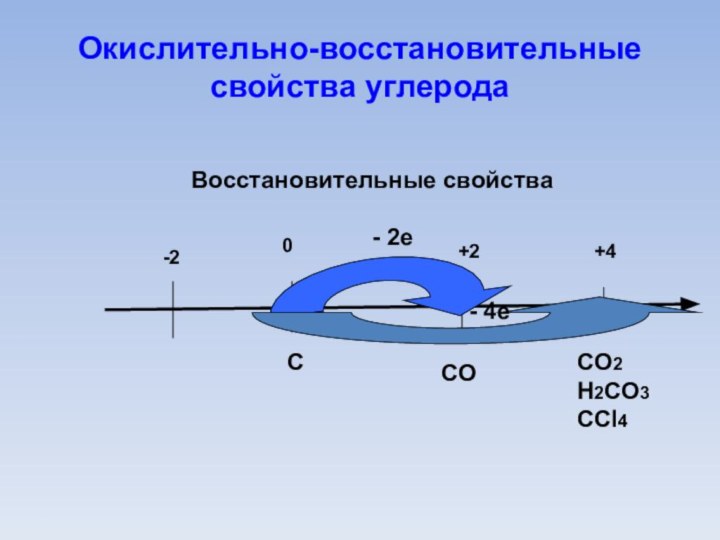
Окислительно-восстановительные свойства углерода
0
-2
+2
+4
Восстановительные свойства
С
СO
СO2
H2СO3
СCl4
- 2e
- 4e
Слайд 14
Взаимодействие с простыми веществами
Углерод восстановитель
С кислородом
а) C0 + O02 = C+4O-22 оксид углерода (IV)
б) 2C0 + O02 = 2 C+2O-2 оксид углерода (II)2. С галогенами
C0 + 2Cl02 = C+4Cl-14 четыреххлористый углерод
3. С серой
С0 + 2S0 = C+4S-22 сульфид углерода (IV)
Слайд 15
CaCO3- мел, известняк, мрамор
CaCO3* MgCO3 – доломит.
В свободном
виде:
алмаз, графит,
УГЛЕРОД В ПРИРОДЕ
Является составной частью каменного
угля, нефти и природного газа.Калачеевская меловая пещера –
исторический памятник
Органогенный элемент