- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Соли в свете теории электролитической диссоциации (8 класс)
Содержание
- 2. Цели урокаДать понятие о солях;Рассмотреть классификацию солей;Ознакомить с общими свойствами солей в свете ионных представлений.
- 3. 1.Определите ряд формул, состоящих только из 1 вариант
- 4. Соли – электролиты, которые при диссоциации образуют
- 5. СОЛИСРЕДНИЕКИСЛЫЕОСНОВНЫЕПродукты полного замещения атомов водорода в кислоте
- 6. CO32- + 2H+ → CO2
- 7. Cu2+ + SO42- + 2Na+
- 8. 3.СОЛЬ (Р)1 + СОЛЬ(Р)2 → СОЛЬ3 +
- 9. Cu2+ + SO42- +
- 10. Ряд напряжений металлов:K, Ca, Na, Mg, Al,
- 11. вступают в химическое взаимодействие СОЛИc кислотами,щелочами,солями,металлами
- 12. Из перечня формул выпишите отдельно формулы средних,
- 13. Скачать презентацию
- 14. Похожие презентации












Слайд 2
Цели урока
Дать понятие о солях;
Рассмотреть классификацию солей;
Ознакомить с
общими свойствами солей в свете ионных представлений.
Слайд 3
1.Определите ряд формул, состоящих только из
1 вариант КИСЛОТНЫХ
ОКСИДОВ 2 вариант- ОСНОВНЫХ ОКСИДОВ
а)
Na2O, N2O, CuO б) CO2, P2O5, Cl2O7 в) MgO, BaO, Na2O г) Li2O, CaO, CO2.Выберите из списка веществ формулы только
1 вариант КИСЛОТ 2 вариант- ОСНОВАНИЙ
а) НСl, AlCl3, CO2, H2SO4 б) H2SO4, HCl, HNO3, HF
в) NaOH, BaCl2, CO, Ca(OH)2 г) Al(OH)3, NaOH, KOH, Ba(OH)2
3. Выберите формулу
1 вариант ОКСИДА СЕРЫ (IV) 2 вариант- ОКСИДА УГЛЕРОДА (II)
а)H2S б) CO в) HNO3 г) ZnO д) SO2
4.Выберите формулу
1 вариант СЕРНОЙ КИСЛОТЫ 2 вариант- ГИДРОКСИДА КАЛЬЦИЯ
а) KOH б) H2SO4 в) H2 SO3 г) Ca(OH)2
5.Закончите молекулярное уравнение реакций и запишите соответствующее
ионное уравнение
1 вариант: Fe(OH)2 + HNO3 → 2 вариант: NaOH + H2SO4 →
ТЕСТ
Слайд 4 Соли – электролиты, которые при диссоциации образуют катионы
металла (или аммония NH4+) и анионы кислотных остатков
Na2SO4 ↔
2Na+ + SO42- катион
металла
анион
кислотного
остатка
NH4Cl ↔
NH4+
Cl-
+
катион
аммония
анион
хлора
Слайд 5
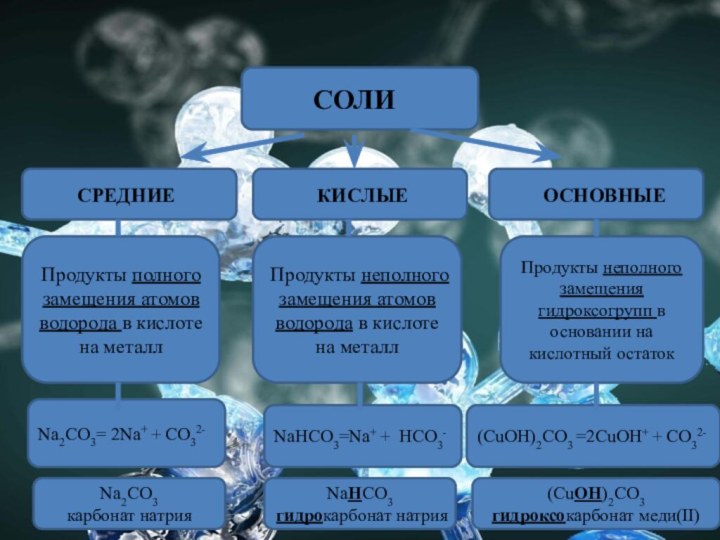
СОЛИ
СРЕДНИЕ
КИСЛЫЕ
ОСНОВНЫЕ
Продукты полного замещения атомов водорода в кислоте на
металл
Продукты неполного замещения атомов водорода в кислоте на металл
Продукты
неполного замещения гидроксогрупп в основании на кислотный остатокNa2СO3= 2Na+ + СO32-
NaНСO3=Na+ + НСO3-
(CuOH)2СO3 =2CuOH+ + СO32-
Na2СO3
карбонат натрия
NaНСO3 гидрокарбонат натрия
(CuOH)2СO3 гидроксокарбонат меди(II)
Слайд 6 CO32- + 2H+ → CO2 ↑
+ 2H2O
Na2CO2 + 2HCl → 2NaCl
+ CO2 ↑+ 2H2OBa2+ + SO42- → BaSO4↓
2Na+ + CO32- + 2H+ + 2Cl- → 2Na+ + 2Cl - + CO2 ↑+ 2H2O
Ba2+ + 2Cl- + 2H+ + SO42- → BaSO4↓ + 2H+ + 2Cl-
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
1. СОЛЬ + КИСЛОТА →другая СОЛЬ +другая КИСЛОТА (↓или ↑) р.обмена
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Слайд 7 Cu2+ + SO42- + 2Na+ +
2OH- → Cu(OH)2↓ + 2Na+ +
SO42-Cu SO4 + 2NaOH → Cu(OH)2↓ + Na2 SO42-
Cu2+ + 2OH- → Cu(OH)2↓
2. СОЛЬ(Р) + ЩЕЛОЧЬ→другая СОЛЬ +другое ОСНОВАНИЕ (↓) р.обмена
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Слайд 8 3.СОЛЬ (Р)1 + СОЛЬ(Р)2 → СОЛЬ3 + СОЛЬ4
(↓) р обмена
Ag+ + Cl- →
AgCl↓ Na+ + Cl- + Ag+ + NO3- → AgCl↓ + Na+ + NO3-
NaCl + AgNO3 → AgCl↓ + NaNO3
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Слайд 9 Cu2+ + SO42- + Zn0
→ Cu0 + Zn2+ +
SO42-СОЛЬ (Р) + МЕТАЛЛ →другая СОЛЬ +другой МЕТАЛЛ р.замещения
Cu2+ + Zn0 → Cu0 + Zn2+
CuSO4 + Zn → Cu + ZnSO4
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Слайд 10
Ряд напряжений металлов:
K, Ca, Na, Mg, Al, Zn,
Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag,
AuВытеснительный ряд металлов:
Mg, Al, Zn, Cr, Fe, Co, Sn, Pb, H2, Cu, Hg, Ag, Au
С растворами КИСЛОТ взаимодействуют МЕТАЛЛЫ, которые расположены ЛЕВЕЕ ВОДОРОДА в соответствии с электрохимическим рядом напряжений металлов.
Каждый МЕТАЛЛ вытесняет из РАСТВОРА СОЛЕЙ другие металлы, расположенные ПРАВЕЕ его в электрохимическом ряду напряжений металлов.