ведут себя степени окисления в процессе реакции.
HCl + NaOH
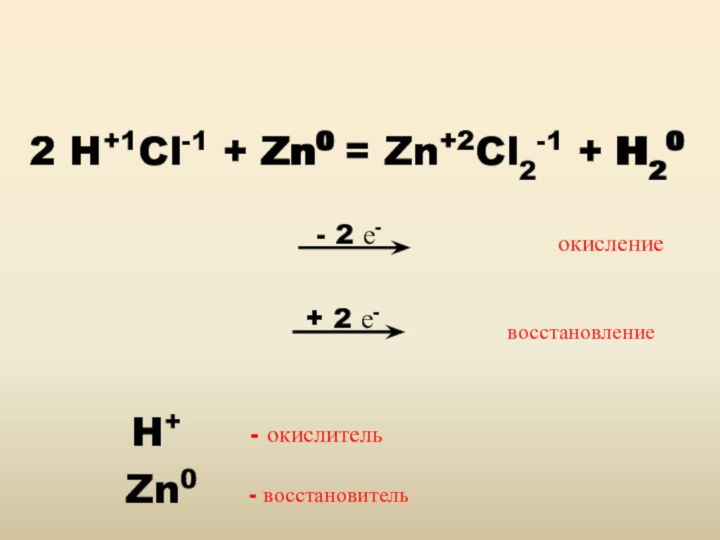
= NaCl + H2O2 HCl + Zn = ZnCl2 + H2
+ 1 - 1 + 1 - 2 + 1 + 1 - 1 + 1 - 2
+ 1 - 1 0 + 2 - 1 0
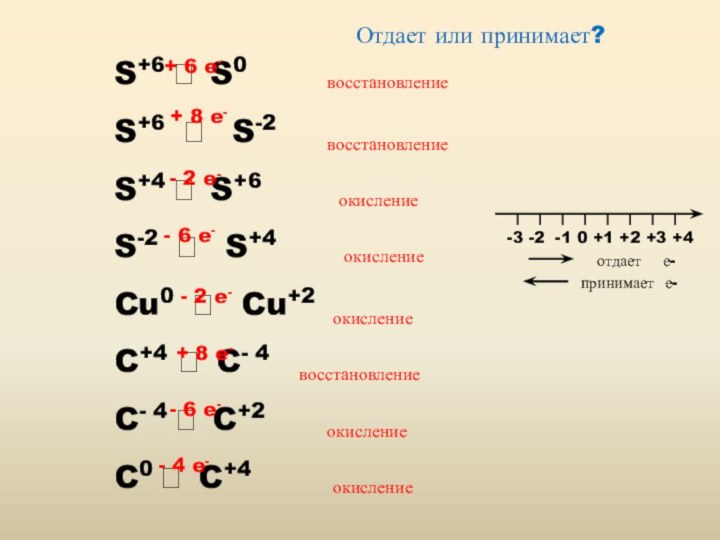
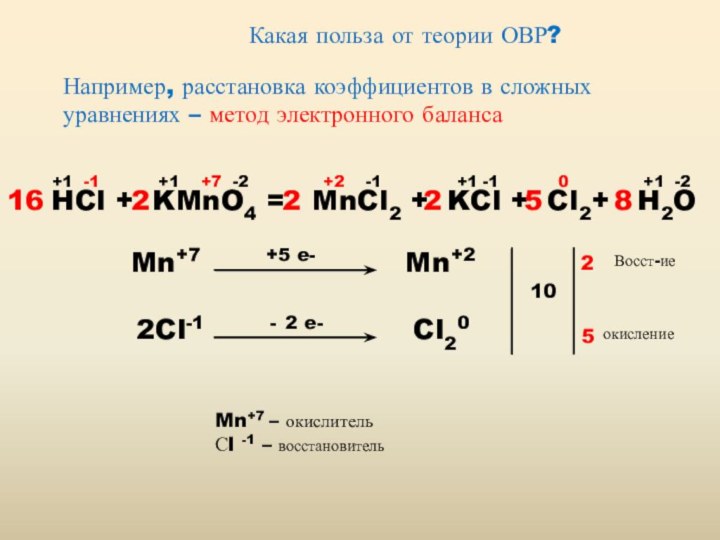
Реакции, в которых происходит изменение степеней окисления, называются
окислительно-восстановительными
Окислительно-восстановительная реакция