Слайд 2
Характеристика элемента – металла по положению в ПСХЭ
Д.И.Менделеева
Li B
1. Металлы находятся в I-III группе главной
подгруппе (искл. H -1e, Hе-2e, B-3e),
а также в I-VIII группах побочной подгруппе.
Fr At 2. На внешнем энергетическом уровне у
металлов от 1 до 3-х электронов.
3. Ме0 - n е = Ме+n (окисление)
восстановитель
4. Степень окисления металла:
0, +1, +2, +3 (низшая)
+4, +5, +6, +7, +8 (высшая)
Слайд 3
Изменение металлических свойств в ПСХЭ
В группах:
металлические свойства усиливаются
причина: 1.увеличивается заряд ядра,
2.число электронов на внешнем э.у.
не изменяется
3.радиус атома увеличивается
В периодах:
металлические свойства уменьшаются
причина: 1. увеличивается заряд ядра
2. число электронов на внешнем э.у.
увеличивается
3. радиус атома уменьшается
Слайд 4
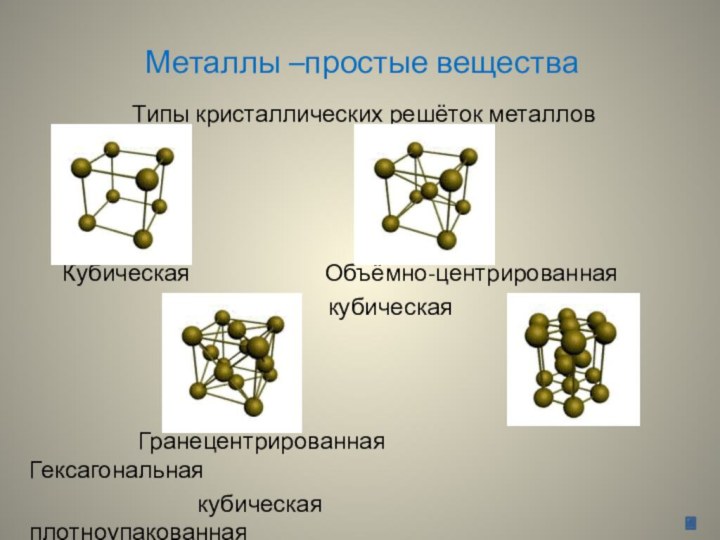
Металлы –простые вещества
Типы кристаллических решёток металлов
Кубическая Объёмно-центрированная
кубическая
Гранецентрированная Гексагональная
кубическая плотноупакованная
Слайд 5
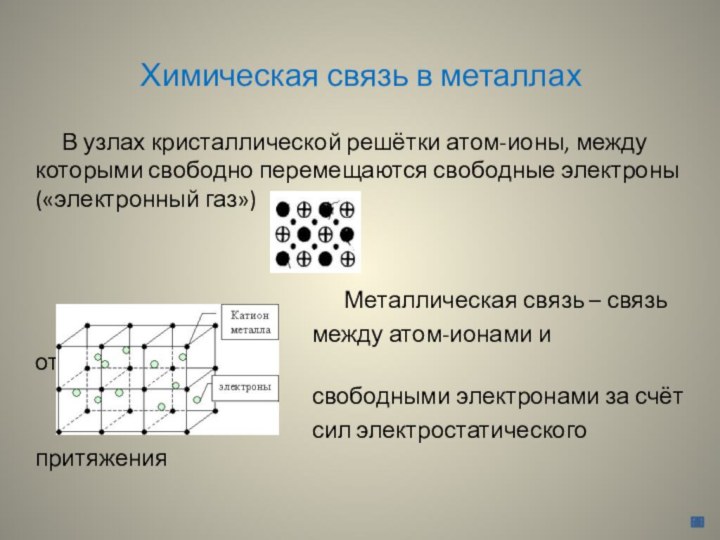
Химическая связь в металлах
В узлах
кристаллической решётки атом-ионы, между которыми свободно перемещаются свободные электроны
(«электронный газ»)
Металлическая связь – связь
между атом-ионами и относительно
свободными электронами за счёт
сил электростатического притяжения
Слайд 6
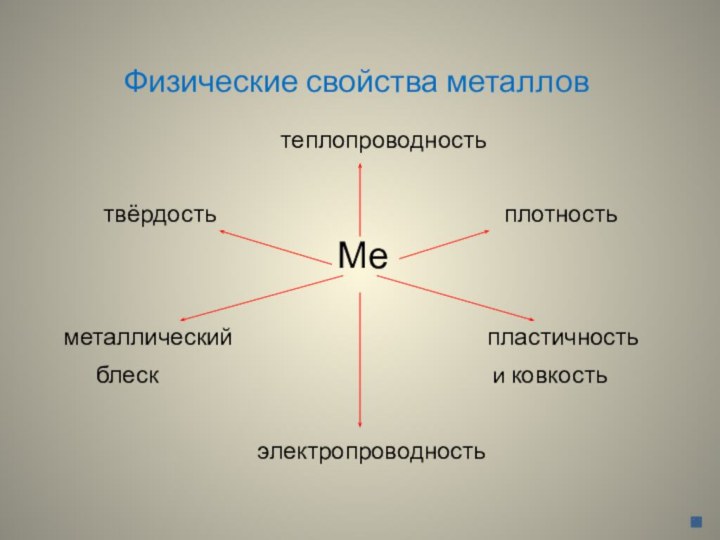
Физические свойства металлов
теплопроводность
твёрдость плотность
Ме
металлический пластичность
блеск и ковкость
электропроводность
Слайд 7
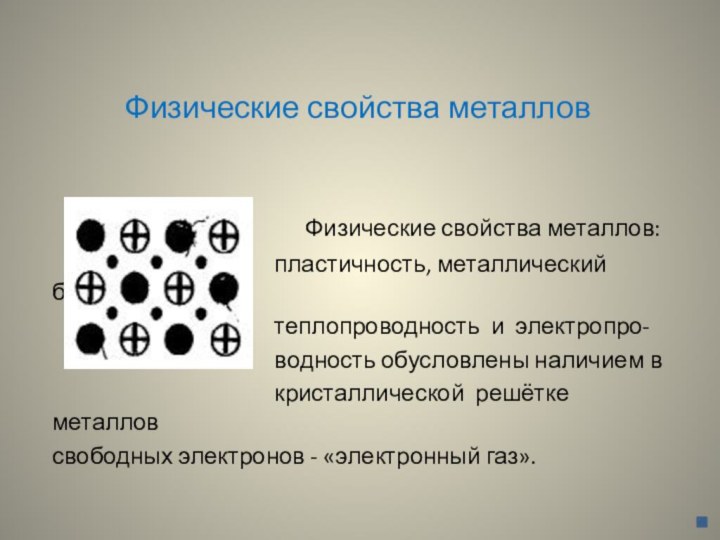
Физические свойства металлов
Физические свойства металлов:
пластичность, металлический блеск,
теплопроводность и электропро-
водность обусловлены наличием в
кристаллической решётке металлов
свободных электронов - «электронный газ».
Слайд 8
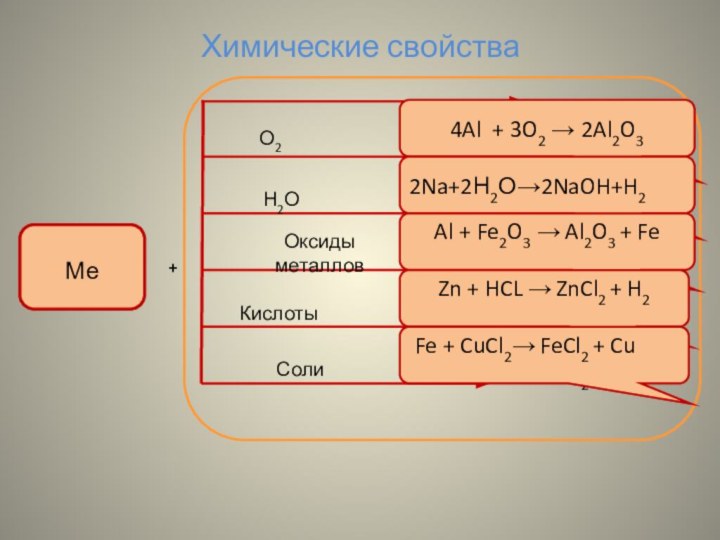
Химические свойства
+
?
4Al + 3O2 → 2Al2O3
2Na+2Н2О→2NaOH+H2
Al + Fe2O3
→ Al2O3 + Fe
Соли
О2
Zn+HCl →
Fe+CuCl2→
Zn + HCL → ZnCl2 + H2
Fe + CuCl2→ FeCl2 + Cu
Слайд 9
Особенности химических свойств
→
Слайд 11
Взаимодействие с растворами солей
Слайд 12
Способы получения
Пирометаллургия – получение металлов и сплавов
под действием высоких температур.
-Гидрометаллургия – получение металлов из водных
растворов.
-Электрометаллургия – получение металлов под действием электрического тока.
Восстановление углем (угарным газом):
2PbO + C = CO2 + 2Pb
Восстановление алюминием (кальцием):
2Al + Fe2O3 = Al2O3 + 2Fe
Восстановление водородом:
СuO + H2 = Cu + H2O
Слайд 13
Способы получения
Гидрометаллургия
1 стадия: растворение в кислоте нерастворимых минералов,
содержащих металлы:
CuS + 2HCl = CuCl2 + H2S
2
стадия: вытеснение металлов из растворов их солей более активными металлами:
CuCl2 + Fe = FeCl2 + Cu
Слайд 14
Коррозия
Химическая
Электрохимическая
4Fe + 6H2O + 3O2 =
4Fe(OH)3
Коррозия железа и образование ржавчины
Коррозия железа в контакте с
медью и в растворе соляной кислоты:
Катод 2Н+ + 2е = Н2
Анод Fe2+ - 2e = Fe0
Самопроизвольное разрушение металлических материалов, происходящее под воздействием окружающей среды, называется коррозией.
Слайд 15
Способы защиты от коррозии
Защита более активным металлом;
Отделение металла
от агрессивной среды;
Использование замедлителей коррозии;
Электрозащита;
Пассивация металлов;
Изготовление сплавов, стойких к
коррозии.
Слайд 16
Металлы - «рекордсмены»
W(вольфрам) -
самый тугоплавкий
Ag(серебро) - самый электропроводный
Li(литий) - самый лёгкий
AI(алюминий) - самый распространённый
Cs(цезий) - самый легкоплавкий
Au(золото) - лучший катализатор
Cr (хром) - самый твёрдый
Os(осмий) - самый тяжёлый
Слайд 17
О применении металлов
Медь
была первым металлом,
которым овладел человек. Она
открыла эру металлургии и дала
миру первый сплав. Многие
тысячелетия медь была основой
материальной культуры и искусств
Трудно переоценить уникальную
роль меди в истории
человеческой цивилизации.
Слайд 18
Металлы древности на службе
у человека
Семь металлов создал свет
по числу семи планет …
Алхимики
Золото (Au) – солнце
Серебро (Ag) – луна
Ртуть (Hg) – меркурий
Медь (Cu) – меркурий
Железо (Fe) – марс
Олово (Sn) – юпитер
Свинец (Pb) – сатурн
Слайд 19
Из истории сплавов
Бронза была первым сплавом,
полученным человеком.
Распространение бронзы началось
с конца 4 тыс. до н.э. Древнейшие
бронзовые изделия найдены на
территории Ирана, Месопотамии, Турции. В конце 3 тыс. до н.э. бронза появилась в Индии, во 2 тыс. до н.э. – в Китае и Европе.
В Америке бронзовый век охва-
тывает период с VI по Х века н.э.
Слайд 20
Из истории сплавов
В железный век первыми пришли
народы Африки. Они перешагнули
из каменного века в железный
минуя медный и бронзовый. Это
связано с тем, что в Африке железные
руды выходят на поверхность земли.
Африканцы изобрели плавку железа в 600-400
годах до новой эры.
Слайд 21
Чугун –материал для создания шедевров мирового искусства
Санкт-Петербург –своеобразный музей, в котором
собрано бесчисленное множество произведений
изобразительного искусства, выполненных из чугуна.
Рассмотрит лишь некоторые
из них – чугунные ограды
дворцов и набережных рек
Санкт – Петербурга.
Слайд 22
Чугун – материал для создания шедевров мирового искусства
Воронихинская
решётка у Казанского
собора. Отлита в 1811 году.
(Архитектор Воронихин А.Н.)
Слайд 23
Чугун –материал для создания шедевров мирового искусства (продолжение)
Решётка Летнего сада.
36 гранитных колонн, увенчанных вазами и урнами, и тончайшие ажурные звенья, украшенные позолоченными розетками, стали сокровищем мирового искусства.
(Архитекторы Фельтен Ю.М. и Егоров П.Е.)
Слайд 24
Чугун – материал для создания шедевров мирового искусства
(продолжение)
Ограда Русского музея
(Михайловского дворца),
1819-1825 г
(Архитектор Росси К.И.)
До 1917 года назывался
музеем Александра III.
Слайд 25
Чугун – материал для создания шедевров мирового
искусства (продолжение)
Ограда набережной реки Фонтанки. Сооружена в 1780-1789 г по проекту архитектора Квасова А.В.
Слайд 26
Чугун –материал для создания шедевров мирового искусства
Ограда набережной
реки Мойки
(1798-1810 годы)
Слайд 27
О роли металлов
Металлы
сыграли важную роль в истории человечества и несмотря на
то, что в последнее время у них появился конкурент – полимерные материалы, металлы и сейчас продолжают занимать ведущее место в развитии цивилизации.