Слайд 2
Электроотрицательность
Свойства атомов одного элемента оттягивать электроны от других
элементов. Табл. 19 стр 140
Литий ЭО = 1
Фтор ЭО
= 4
Табл стр. 140
Слайд 3
Значение ЭО
Если ЭО меньше 2 то это металл
Если
ЭО больше 2 то это неметалл
В периоде ЭО возрастает
В группе ЭО уменьшается
Чем больше металличность, тем меньше ЭО
Чем больше неметалличность, тем больше ЭО
Слайд 4
Сравнить ЭО
Na и K
Ba и Ca
O и
S
F и Cl
Слайд 5
По ЭО определить Ме или Неме табл.19 стр
140
Хром
Хлор
Цинк
Стронций
Кремний
Слайд 6
Что такое электроотрицательность?
Пользуясь п.с. распределите перечисленные элементы в
порядке возрастания значений электроотрицательности
фосфор, магний, бор, цезий, кислород,
кремний, калий, углерод, водород, литий , фтор, сера, алюминий ,кальций.
Слайд 7
Ответ:
Cs K Li Ca Mg Al B H
Si P C S O F
Слайд 8
Тест
В ряду элементов
F→
Cl→ Br→ I с увеличением порядкового номера химического элемента
ЭО
Увеличивается
Уменьшается
Не изменяется
Изменяется периодически
Ответ: 2
Слайд 9
Задание
В приведенных ниже формулах подчеркните атомы наиболее
ЭО элементов
KCl ; Na2O; N2 ; HI ;
H2S ; AlBr3
Слайд 10
Химическая связь
Химическая связь – это сила которая
удерживает атомы в молекуле
Главную роль играют электроны
Электроны образуют электронный
октет (8 е)
Слайд 11
Классификация видов химической связи
Слайд 12
Виды химической связи
Теория ковалентной связи предложил в
1916 г Джильбер Льюис
Ковалентная связь- Это связь атомов с
помощью общих электронных пар
Ковалентная неполярная
Н2 ,О2; F2 ;Cl2
Ковалентная полярная
HCl; NH3; H2O
Слайд 14
Механизм образования ковалентной неполярной связи
Н2
Н
1s¹↑
Н · + · Н
= Н (:) Н Н-Н
↑
общая электронная пара
Область перекрывания электронных облаков - это область высокой плотности отрицательного заряда, который притягивает положительно заряженные ядра
н
н
Слайд 16
Ковалентная неполярная связь образуется между атомами с одинаковой
ЭО ( Н2, О2)
Ковалентная полярная связь образуется между атома
ЭО у которых отличается незначительно( НCl; H2O)
Слайд 17
О2
О 1s²2s²2p4
..
..
.. ..
: O · + · О : → : О :: О : О=О
· · двойная связь
Слайд 19
Ơ- связь это ковалентная связь, при
образовании
которой область перекрывания электронных облаков находится
на линии,
соединяющей ядра атомов
------------- -
------------
Слайд 20
ɲ - это связь , при образовании которой
область перекрывания электронных облаков находится по обе стороны по
линии соединяющий ядра атомов
Слайд 22
Одинарная связь – ơ
Двойная связь - 1
ơ , 1 ɲ
Тройная связь 1 ơ
, 2 ɲ
-с-с- одинарная
-с = с- двойная
-с Ξ с- тройная
Слайд 23
Механизм образования ковалентной полярной связи
··
δ+ δ- ··
Н· + · Cl : → Н | (:) Cl :
·· ··
δ+ частичный положитедьный заряд
δ- частичный отрицательный заряд
ЭО н= 2,1 ЭОсL = 3,0
Слайд 24
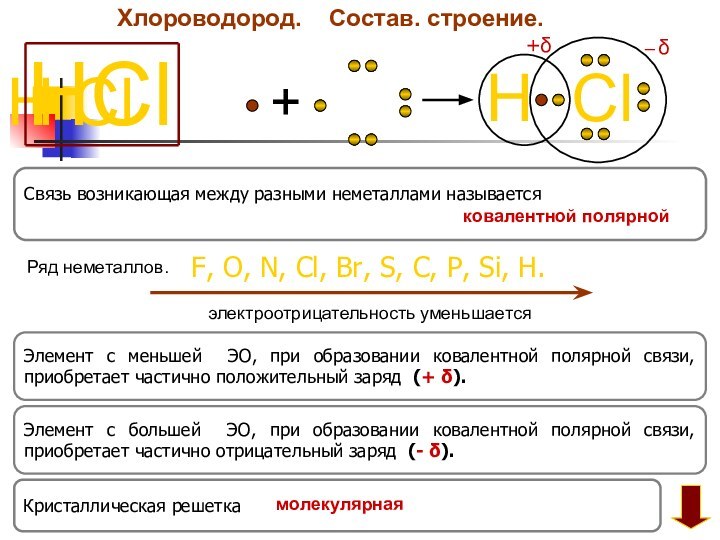
Хлороводород.
Состав. строение.
HCl
H
Cl
+
H
Cl
+δ
─ δ
Элемент с большей ЭО, при
образовании ковалентной полярной связи, приобретает частично отрицательный заряд (-
δ).
Элемент с меньшей ЭО, при образовании ковалентной полярной связи, приобретает частично положительный заряд (+ δ).
F, O, N, Cl, Br, S, C, P, Si, H.
электроотрицательность уменьшается
Связь возникающая между разными неметаллами называется
Ряд неметаллов.
Кристаллическая решетка
ковалентной полярной
молекулярная
Слайд 25
Полярность связи тем больше, чем разность ЭО связанных
атомов.
Полярные молекулы являются диполями.
+
-
Слайд 26
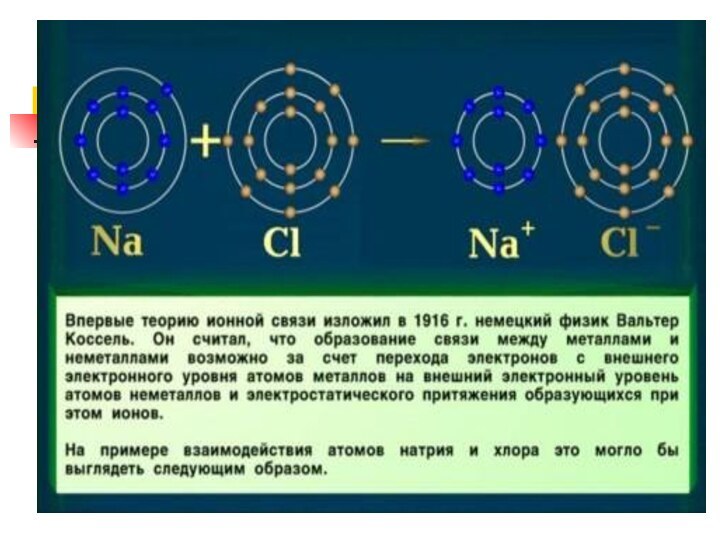
Ионная связь
Теория ионной связи предложил в 1916 г.
немецким ученый В. Коссель.
Ионная связь это связь между ионами
Ме
НеМе
NaCl ; CaCl2 ; K2O ; Al2S3
Слайд 29
Соли соляной кислоты (хлориды)
Хлорид натрия
1. Состав
NaCl
2. Строение
Химическая связь
между катионами и анионами, обусловленная их взаимным
притяжением, называется
ионной
Схема
образования ионной связи в хлориде натрия:
Na
+
Cl
Na
Cl
+
−
или
Na
23
11
0
)
)
)
2
8
1
+
Cl
35
17
)
)
)
7
8
2
0
Na
)
)
11
23
Cl
+
)
)
)
8
8
2
8
2
−
35
17
ион натрия
ион хлора
Na0 − 1e → Na+
Cl 0 + 1e → Cl −
Слайд 30
Механизм образования ионной связи
0
0
Na + Cl → Na+
Cl¯
Na – 1 e → Na +
Cl + 1e → Cl ¯
1.Образование ионов
2.Соединение ионов
Слайд 31
Как определить тип связи?
Тип связи определяется по разности
ЭО
∆ЭО =0 ковалентная неполярная связь Н-Н
∆ЭО
< 1,7 ковалентная полярная
Н-Cl ЭОн =2,1 ЭОcL= 3,0
∆ЭО ≥ 1,7 ионная связь
NaCl ЭОNa=1,01 ЭОсL = 3,0
Слайд 32
Энергия связи
Энергия, которую надо затратить на разрыв связи
( мера ее прочности)
Измеряется в кдж/моль
Зависит от
1.Природы взаимодействующих
атомов
2.Их размеров
3. ЭО
4. Прочность ơсвязи больше ɲсвязи.
Слайд 33
Н-Н 436 кдж/моль C
= C 598
С-Н 416
C Ξ C 813
С-С 356 N Ξ N 946
О-Н 467
S-H 347
HCL 431
H-Br 366
H-I 299
Слайд 34
Пространственное строение
молекул неорганических и органических веществ.
Направление ковалентной связи
1)Линейные
2)Угловые
3)Тетраэдрические
Причина:
различие расположения электронных орбиталей в пространстве.
Слайд 35
Гибридизация.
Гибридизация- выравнивание электронной плотности (меняется форма электронных облаков)
sp³
- алканы,циклоалканы, NH3; H2O
Тетраэдр, валентный угол 109° 28´, 107,3°,104,5°
рис. №11 стр 32.
sp² - алкены, алкадиены, арены; ВСl3
Угловая ,валентный угол 120°
sp - алкины; BeF2
Линейная молекула, валентный угол 180°
Слайд 36
Металлическая связь
Возникает в кристаллической решетке
металлов между
свободными электронами и узлами кристаллической решетки( атомы и ионы)
Слайд 37
Водородная связь
Связь между атомами водорода одной молекулы и
атомами ЭО элементов (О; N ; Cl; F; S)
1.
внутримолекулярная
2. межмолекулярная
Слайд 38
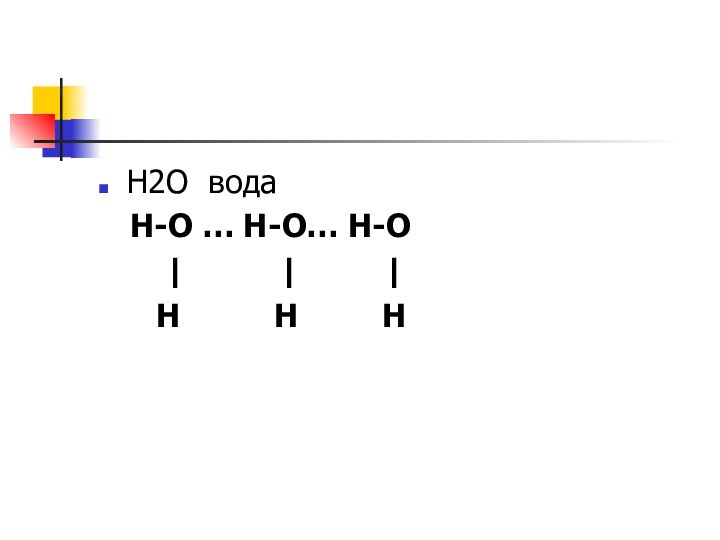
Н2О вода
Н-О … Н-О… Н-О
| |
|
H H H
Слайд 39
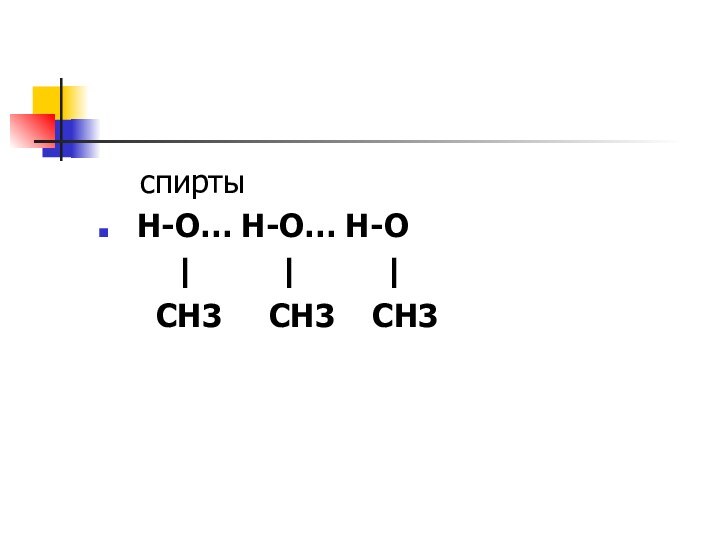
спирты
H-O… Н-O… H-O
| |
|
СH3 СH3 СH3
Слайд 40
Вопросы и упражнения
Что такое химическая связь?
Какие основные виды
химической связи вы знаете?
В каких молекулах присутствует ковалентная
неполяная связь?
В
каких молекулах присутствует ковалентная
полярная связь?
В каких молекулах присутствует ионная связь?
Что такое сигма связь?
Что такое пи связь?
Слайд 41
Вопросы и упражнения
Определить тип химической связи
H2S ; NH3;
H2 ; K2O; Al2S3; N2; P2O5;
Na2SO4; SO3; CH4;
KBr;
Какая связь образуется между элементами с №1 и №9; №11 и№16
Какая молекула более полярна
НF – HCl - HBr – H I
Слайд 42
Вопросы о упражнени.
Составить схемы образования связей
а) хлорид
лития
б) молекула фтора
в) молекула воды
г) молекула
фтороводорода
Слайд 43
В каких молекулах длина связи больше?
1) H2O
2) H2S
3) H2Se
Какая молекула прочнее?
Слайд 44
Тест
Ионная связь образуется
Между элементами с одинаковым ЭО
Между
элементами ,у которых ЭО отличается незначительно
Между элемента, у которых
ЭО отличатся значительно.
Слайд 45
Тест
Ионная связь характерна для
CH4
NaF
N2
SiO2
Ответ:
2
Слайд 46
Тест
Между атомами элементов с порядковыми номерами 9 и
19 образуется химическая связь
Ковалентная полярная
Ковалентная неполярная
Ионная
Металлическая
Ответ:
3
Слайд 47
Напишите структурную формулу
4,5 диметил гексен -1
3метил4 этил
гетин-1
1. Определите количество сигма
и Пи связей
2.Определить типы
гибридизации каждого атома углерода
Слайд 48
Упражнения
Зарисовать механизм образования в молекулах
В молекуле кислорода
В молекуле
хлороводорода
В хлориде кальция
Слайд 50
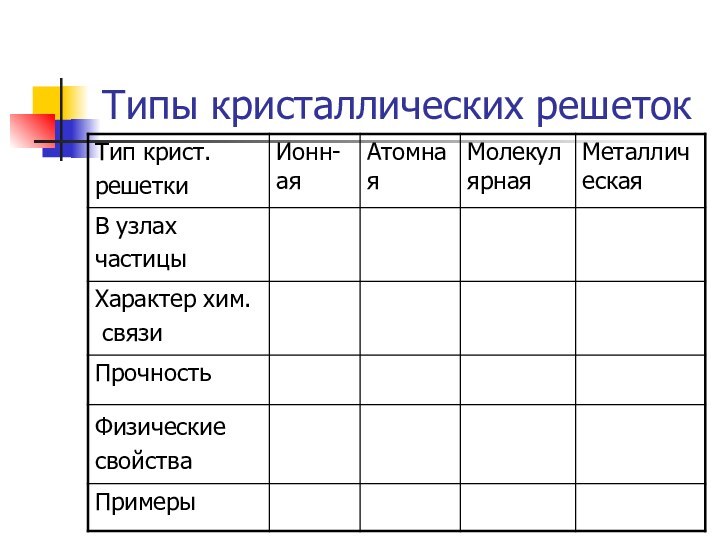
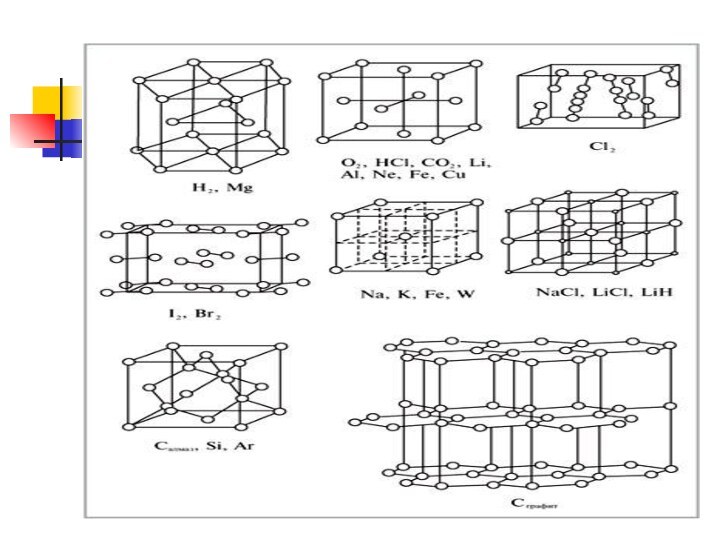
Типы кристаллических решеток
Рис. 12 стр 32
Ионная кристаллическая
решетка
В узлах находятся + ионы и – ионы
Ионная связь. Прочная.
Свойства: тугоплавкие, твердые, многие растворимы в воде. Растворы т расплавы проводят эл. ток.
Пример: соли, щелочи, основные оксиды.
Слайд 52
Типы кристаллических решеток
Самостоятельно
Зарисовать типы кристаллических решеток
Атомной –
алмаз
Ионной – поваренная соль
Молекулярная – иод
Металлическая
Стр 32 рис.12
Слайд 54
Атомная кристаллическая решетка
В узлах находятся
атомы. Связь ковалентная. Очень прочная.
Свойства: очень тугоплавкие, очень твердые,
практически нерастворимы в воде. Плохо проводят ток и тепло.
Примеры: Алмаз, графит, кремний бор, оксид кремния SiO2
Слайд 56
Молекулярная решетка
В узлах находится молекулы.
Прочность слабая. Связь –силы межмолекулярного взаимодействия
и водородные связи.
Прочность слабая.
Свойства: легкоплавкие, низкие температуры плавления и кипения
небольшая твердость
Примеры: иод I2; лед , cухой лед (СО2)
О2 , Н2 , СL2, ,белый фосфор Р4, сахар, глицерин,
глюкоза, глицерин, нафталин, сера S8
Слайд 58
Металлическая кристаллическая решетка
В узлах атомы и положительно заряженные
ионы.
Металлическая связь . Разной прочности
Свойства: разнообразны по свойствам
имеют металлический блеск, электро и теплопроводны, большинство пластичны.
Примеры: металлы
Слайд 60
Причины многообразия веществ
Изотопия элементов и их соединений.
Н- образует
3 изотопа
Протий Н ¹1
Дейтерий Н ²1
Тритий
Н³1
Слайд 61
Аллотропия-явление существования элементов в виде нескольких простых веществ
С
– графит,алмаз, карбин,фуллерен.
Р – белый, красный,черный.
О – кислород О2,
озон О3
Изомерия
Структурная
-цепи
-кратной связи
-функциональной группы
- межклассовая
Пространственная
Слайд 62
Гомология
Гомологи- это вещества которые отличаются на одну
или несколько групп СН2( гомологическая разность)
Химический синтез новых веществ
Неорганических
вешеств 500 000 тыс
Органических веществ 12 млн.
Слайд 63
Вопросы и упражнения
Определите тип кристаллической решетки: Хлорид кальция,алюминий,
иод, графит.
Самыми твердыми веществами являются
Диоксид кремния
Алмаз
Красный фосфор
Слайд 64
Кристаллическая решетка твердой серы?
Молекулярную кристаллическую решетку имеет
А)Калий
Б)Литий
В)Магний
Г)Водород
Слайд 65
Кислород и озон имеют кристаллическую решетку…
а)ионная
1)диссоциируют
б) атомная
2)низкая реакци-
в) молекулярная онная способ-
г) металлическая ность
3)низкая Т плав.
4)металлич. блеск
Слайд 66
Дисперсные системы
Грубодисперсные- мутные частицы видны невооруженным глазом.(Геторогенные)
Легко разделяются.
Размер частиц 100нм
1)суспензия
а)глина и вода
б)мел и вода
2)
Эмульсии
а) смесь растительного масла и воды
Слайд 67
Тонкодисперсные системы (гомо-
генные) –прозрачные.
Частицы обнаруживаются только при помощи ультрамикроскопа.
Осаждаются
с трудом.
1)Коллоидные растворы (1-100нм)
Золи - твердые вещества + жидкость (желатин+ вода)
Гели - жидкость + жидкость (яичный белок+вода)
Аэрозоли - Газ + жидкость ( туман , дым
Слайд 68
Истинные растворы(гомогенные)
прозрачные размер частиц
меньше 1нм.
Частицы невидны даже под микроскопом. Не осаждаются.
1) раствор
сахара в воде
2) раствор серной кислоты
Слайд 69
Повторить
Раствор -?
Классификация растворов- ?
Водные растворы -?
Неводные растворы -?
Гидротация
-?
Гидротированный ион -?
Кристаллогидрат -?
Насыщенный раствор -?
Ненасыщенный раствор-?
Концентрированный -?
Разбавленный -?
Слайд 70
Способы выражения концентрации растворов.
Массовая доля растворенного вещества
mр.в.
ωр.в.= ――― ·
100%
m р-ра
mр-ра = m растворителя + m р.в.
Н2О
Слайд 71
Упражнения и задачи
В растворе массой 100г содержится
хлорид бария массой 20г. Какова массовая доля хлорида
бария в растворе?
Сахар массой 5г растворили в воде массой 20г Какова массовая доля сахара в растворе?
Какова масса нитрата калия и воды ,которые необходимо взять для приготовления 2 кг раствора с массовой долей нитрата калия равной 0,05?
При выпаривании 500г 10% раствора сульфата лития получили раствора массой 200г. Какова концентрация полученного раствора?
Слайд 72
Задачи
К 250г 10% раствора прилили 150млводы (ƥ= 1г/мл)
Какова массовая доля глюкозы в полученном после разбавления растворе?
В
200г воды растворили 67,2л сероводорода (н.у.)
Определите массовую долю сероводорода в растворе.
Какие массы кристаллогидрата сульфата натрия
Na2SO4 · 10H2O и воды надо взять, чтобы получить раствор массой 71г с массовой долей Na2SO4 20%?
Слайд 73
Молярная концентрация
Молярная концентрация показывает число молей растворенного вещества
в одном литре раствора.
ע
С= ―― моль/л
V
ע- количество вещества (ню)
V- объем раствора
Слайд 74
Молярная концентрация.
1М – одномолярный (1моль на 1л)
0,1М децимолярный
( 0,1моль на 1л)
0,01М сантимолярный (? )
0,001М миллимолярный (?
)
Плотность раствора
m
ƥ = ―― ƥ H2O = 1г/мл или 1г/см³
V
Слайд 75
Решение задач
Раствор объемом 500мл содержит гидроксид натрия массой
5г. Определить молярную концентрацию этого раствора.
Вычислить массу хлорида натрия
, содержащего в растворе объемом 200мл, если его молярная концентрация 2 моль/л
Вычислить молярную концентрацию раствора серной кислоты , если массовая доля серной кислоты в этом растворе 12%. Плотность раствора 1,08 г/мл.
Слайд 76
Решение задач.
Молярная концентрация раствора едкого кали КОН 3,8
моль/л, его плотность 1,17 г/мл. Вычислить массовую долю КОН
в этом растворе.
К 500 мл 20% раствора серной кислоты. Плотность раствора 1,2г/мл.
Прилили 250 мл воды. Определить молярную концентрация серной кислоты в новом растворе?
Слайд 77
Практическая работа №1
Тема№1 Приготовление растворов
с заданной концентрацией.
Цель: научиться готовить растворы с заданной молярной и процентной
концентрацией.
Оборудование: мерная посуда, весы.
Вещества: хлорид натрия, карбонат натрия.
Слайд 78
Ход работы
1. Правила техники безопасности.
2. Приготовит растворы.
3. Решить
задачи.
4. Вывод.
Слайд 79
Решить задачи
1.Необходимо приготовить раствор массой 50г с массовой
долей 12% поваренной соли. Вычислите массу соли и воды,
которые необходимо взять для приготовления раствора
2.Вычислить массовую долю раствора растворенного вещества первого и второго раствора , если было взято 60 г воды и 12 г соды, а затем добавили 30г воды и 8 г соды
Слайд 80
Решить задачи
3. Рассчитайте массу соли и
воды, которую необходимо взять для приготовления
100мл 0,1 М раствора хлорида натрия
плотностью 1,1 г/мл
4. Рассчитайте массу соли и воды, которую необходимо взять для приготовления
100мл 0,2М раствора карбоната натрия
плотность 1, 2 г/мл