- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку по химии на тему: Алкены (10 класс)
Содержание
- 2. Алкены – это непредельные углеводороды, содержащие
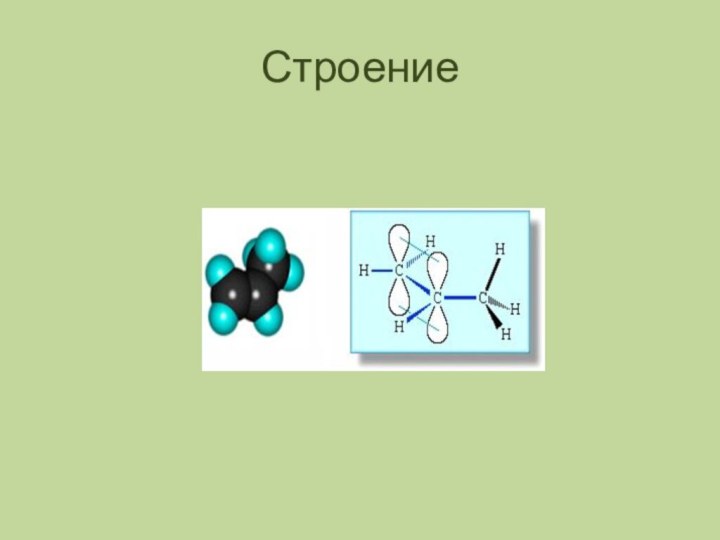
- 3. Строение
- 4. Физические свойства алкенов. Температуры плавления и кипения несколько
- 5. Химические свойства алкеновБольшинство химических реакций алкенов протекают
- 6. Гидратация — взаимодействие алкенов с водой в
- 7. Галогенирование — взаимодействие алкенов с галогенами, например,
- 8. При нагревании смеси алкена с галогеном до
- 9. Алкены способны окисляться с образованием различных продуктов,
- 10. Алкены – это химические вещества углеводородной природы,
- 11. Этилен, стоящий в начале гомологического ряда алкенов,
- 12. Сырьем для получения уксусной кислоты, этилбензола, стирола
- 13. Спасибо за внимание!
- 14. Скачать презентацию
- 15. Похожие презентации
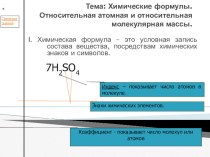
Алкены – это непредельные углеводороды, содержащие в молекуле, кроме одинарных связей, одну двойную углерод – углеродную связь. Состав их отражает общая формула












Слайд 4
Физические свойства алкенов.
Температуры плавления и кипения несколько выше, чем
у алканов. Алкены нерастворимы в воде, хорошо растворимы в
органических растворителях.
Слайд 5
Химические свойства алкенов
Большинство химических реакций алкенов протекают по
механизму электрофильного присоединения:
Гидрогалогенирование – взаимодействие алкенов с галогенводородами
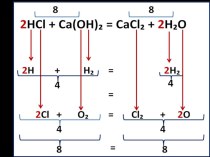
(HCl, HBr), протекающее по правилу Марковникова (при присоединении полярных молекул типа НХ к несимметричным алкенам водород присоединяется к менее гидрированному атому углерода при двойной связи) CH3-CH = CH2 + HCl = CH3-CHCl-CH3
Слайд 6 Гидратация — взаимодействие алкенов с водой в присутствии
минеральных кислот (серной, фосфорной) с образованием спиртов, протекающее по
правилу МарковниковаCH3-C(CH3) = CH2 + H2O = CH3-C(CH3)OH-CH3
Слайд 7 Галогенирование — взаимодействие алкенов с галогенами, например, с
бромом, при котором происходит обесцвечивание бромной воды
CH2 =
CH2 + Br2 = BrCH2-CH2Br Слайд 8 При нагревании смеси алкена с галогеном до 500С
возможно замещение атома водорода алкена по радикальному механизму:
CH3-CH
= CH2 + Cl2 = Cl-CH2-CH = CH2 + HCl По радикальному механизму протекает реакция гидрирования алкенов. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3
Слайд 9 Алкены способны окисляться с образованием различных продуктов, состав
которых зависит от условий проведения реакции окисления. Так, при
окислении в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомных спиртов:3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH
При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием кетоны, карбоновых кислот или углекислого газа:
Окисление этилена кислородом при 200С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O
Слайд 10 Алкены – это химические вещества углеводородной природы, имеющие
в своей структуре одну двойную связь. К ним относятся
этилен, пропилен, бутилен, изобутилен, пентен, гексен, гептен и другие. Применение алкенов характерно для многих областей промышленности, а также для народного хозяйства.Ввиду высокой химической активности соединений с двойной связью, они широко применяются в качестве сырья для химической промышленности.
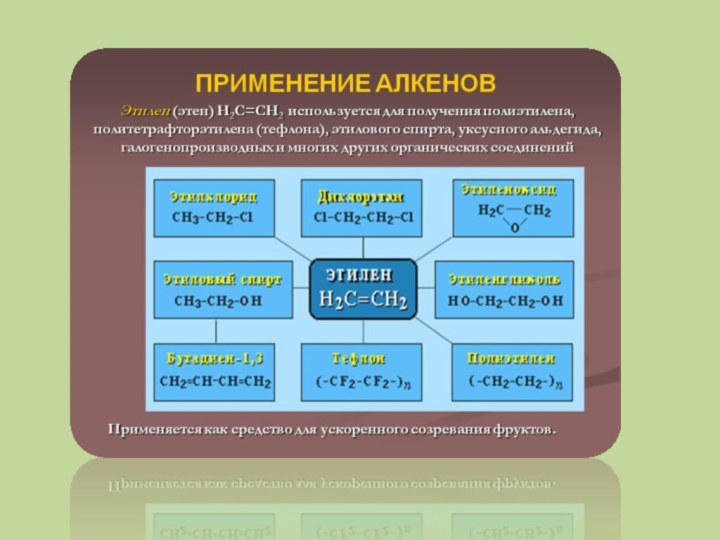
Слайд 11 Этилен, стоящий в начале гомологического ряда алкенов, используется
для получения этиленгликоля,который, в свою очередь, используется для производства
синтетического волокна лавсана, антифризов, взрывчатых веществ. Важное место в применении играет полимеризация этилена. Она проходит при высокой температуре и давлении.Слайд 12 Сырьем для получения уксусной кислоты, этилбензола, стирола и
многих других промышленно важных химических соединений также является этилен.
Химические свойства его определяют область его применения как основы для получения всех этих веществ. Высокая реакционная способность обусловлена наличием двойной связи. Реакции присоединения в алкенах происходят по двойной связи. В результате идет расщепление π-связи и образование на ее месте двух σ-связей.Применение алкенов не ограничивается их использованием в качестве сырья для получения огромного числа соединений. Например, этилен применяют в овощехранилищах и в теплицах для ускорения созревания фруктов и овощей, а также как регулятор роста растений.