- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на темуИонные уравнения
Содержание
- 2. Здравствуйте!Мы рады вас видеть на нашем уроке!У нас все получится!
- 3. Эпиграф нашего урокаТри пути ведут к знаниям:Путь
- 4. Вопросы для контроля1. Какие вещества называются электролитами?
- 5. СамоконтрольСреди веществ, формулы которых приведены: BaCl2,H2SO4, Ca(OH)2,
- 6. Проверь себяКислоты: H2SO4 ↔ 2H+ + SO42-
- 7. Какие реакции мы называем реакциями обмена?1) MgO
- 8. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
- 9. СамоконтрольВ растворе находятся следующие ионы:РО43-, К+, СО32-,
- 10. ТЕМА УРОКАИОННЫЕ УРАВНЕНИЯ
- 11. Цель урока:сформировать понятия: «ионные реакции», «ионные уравнения»;
- 12. Ионные реакции – этореакции между ионами в водных растворах электролитов
- 13. Реакции обмена протекают между ионами, поэтому они
- 14. Если образуется осадок:CuSO4 + 2NaOH
- 15. Если выделяется газ:CaCO3 + 2HNO3
- 16. Если образуется вода:CuO + H2SO4
- 17. Если НЕ образуются осадок, газ, вода, то
- 18. Модельная схема ионообменной реакцииAgClNaClAgNO3
- 19. Правила составления ионных уравнений 1.Простые
- 20. Проверь себяСоставить уравнение между гидроксидом натрия и хлоридом железа(III) в молекулярном и ионном виде
- 21. Алгоритм составления ионных уравнений1. Записать молекулярное уравнение
- 22. Реакция нейтрализацииNaOH + HCl = NaCl + H2O++=++++=
- 23. + + + + + + +
- 24. ФизкультминуткаРуки подняли и покачали – Это деревья
- 25. Попробуй сам1. Подобрать молекулярные уравнения к каждому
- 26. Михаил и Алексей делали домашнее задание. Они
- 27. Внимание! Правильный ответNaOH + HCl
- 28. Внимание! Правильный ответ (продолжение) 4) ZnSO4 +
- 29. Рефлексия Я все понял, могу объяснить другомуПо
- 30. Колдунья с вороном отравили лечебный колодец, в
- 31. Внимание! Правильный ответСаСО3 + 2HCl
- 32. Олененок спешит к друзьям. Он шел долгих
- 33. Внимание! Правильный ответH2SO4 + Ba(OH)2
- 34. Тигренок и крокодил поранились, а у доктора
- 35. Внимание! Правильный ответCu(OH)2 + H2SO4
- 36. Однажды русалка заметила, что ее друзья рыбы
- 37. Внимание! Правильный ответBаСО3 + 2HCl
- 38. Домашнее задание § 37 упр. 2, 5 стр.
- 39. Оцените свою деятельность на урокеСегодня на уроке
- 40. Скачать презентацию
- 41. Похожие презентации
Здравствуйте!Мы рады вас видеть на нашем уроке!У нас все получится!
































Слайд 3
Эпиграф нашего урока
Три пути ведут к знаниям:
Путь размышления
– самый благородный,
Путь подражания – самый легкий,
И путь опыта
– это самый горький.
Слайд 4
Вопросы для контроля
1. Какие вещества называются электролитами?
2.Какие
вещества называются неэлектролитами?
3. Что называется процессом ``электролитической диссоциации''?
4. Какую роль при электролитической диссоциации играет растворитель?
5. Каковы основные положения теории электролитической диссоциации?
6. Что значит сильный или слабый электролит?
7. Дать определение кислот, оснований, солей. Привести примеры.
8. Что такое : а) катионы? , б) анионы?
Слайд 5
Самоконтроль
Среди веществ, формулы которых приведены:
BaCl2,H2SO4, Ca(OH)2, HNO3,
Al2(SO4)3,
выбрать кислоты, соли, основания, дать им названия, написать
уравнения диссоциации.
Слайд 6
Проверь себя
Кислоты: H2SO4 ↔ 2H+ + SO42-
HNO3 ↔ H+ + NO3-
Основания: Са(ОН)2 ↔ Са2+ + 2ОН-
Соли: BaCl2 ↔ Ba2+ + 2Cl-
Al2(SO4)3 ↔ 2Al3+ + 3SO42-
Слайд 7
Какие реакции мы называем реакциями обмена?
1) MgO +
2HC1 => MgCl2 +Н20
2) Cu(OH)2 + 2HN03 => Cu(N03)2
+ 2H203) Na2S04 + BaCl2 => 2NaCl + BaS04↓
Na20 + S03 => Na2S04
Слайд 8
Химические свойства растворов электролитов определяются свойствами тех ионов,
которые они образуют при диссоциации.
Слайд 9
Самоконтроль
В растворе находятся следующие ионы:
РО43-, К+, СО32-, Н+,
ОН-.
Какие вещества были растворены. Дать им названия.
Ответ: К3РО4, К2СО3,
Н3РО4, Н2СО3, КОН
Слайд 11
Цель урока:
сформировать понятия: «ионные реакции», «ионные уравнения»;
научить
составлять полные и сокращенные ионные уравнения реакций, используя алгоритм.
Слайд 13
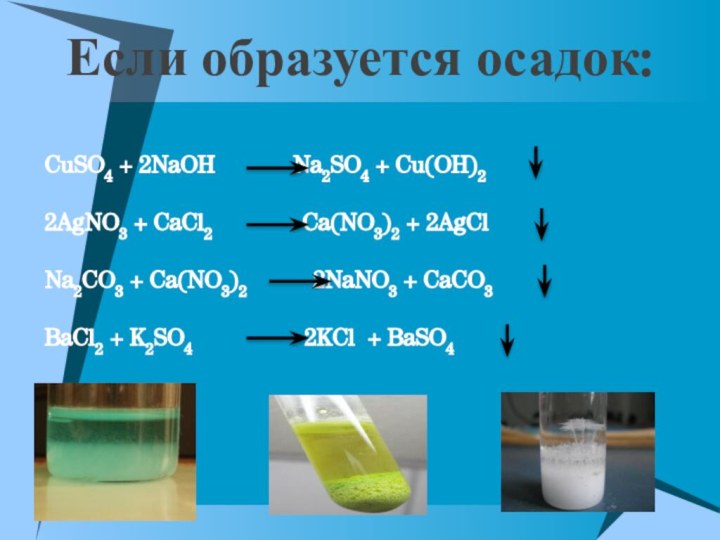
Реакции обмена протекают между ионами,
поэтому они называются
реакциями ионного обмена
Реакции ионного обмена идут до конца в
трех случаяхЕсли образуется
осадок
Если выделяется
газ
Если образуется
вода
***В остальных случаях реакции обмена являются обратимыми
Реакции ионного обмена
Слайд 14
Если образуется осадок:
CuSO4 + 2NaOH
Na2SO4 + Cu(OH)2
2AgNO3 + CaCl2
Ca(NO3)2 + 2AgClNa2CO3 + Ca(NO3)2 2NaNO3 + CaCO3
BaCl2 + K2SO4 2KCl + BaSO4
Слайд 15
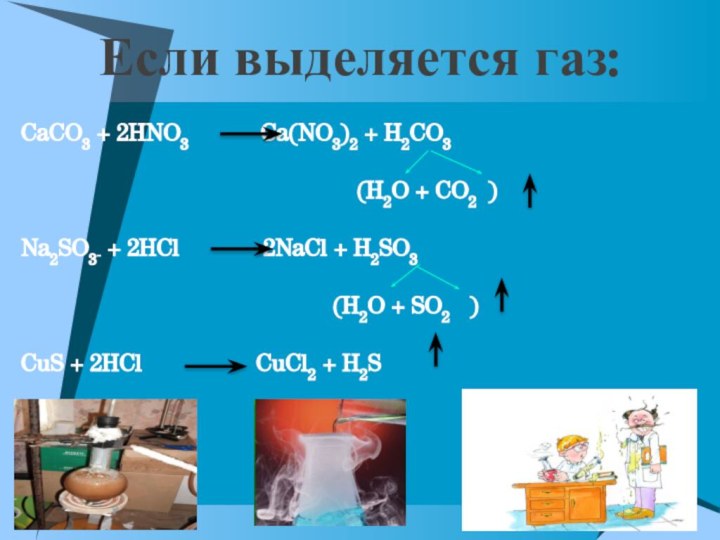
Если выделяется газ:
CaCO3 + 2HNO3
Ca(NO3)2 + H2CO3
(H2O + CO2 )
Na2SO3 + 2HCl 2NaCl + H2SO3
(H2O + SO2 )
CuS + 2HCl CuCl2 + H2S
Слайд 16
Если образуется вода:
CuO + H2SO4
CuSO4 + H2O
Fe(OH)3 + 3HCl
FeCl3 + 3H2ONaOH + HNO3 NaNO3 + H2O
Слайд 17
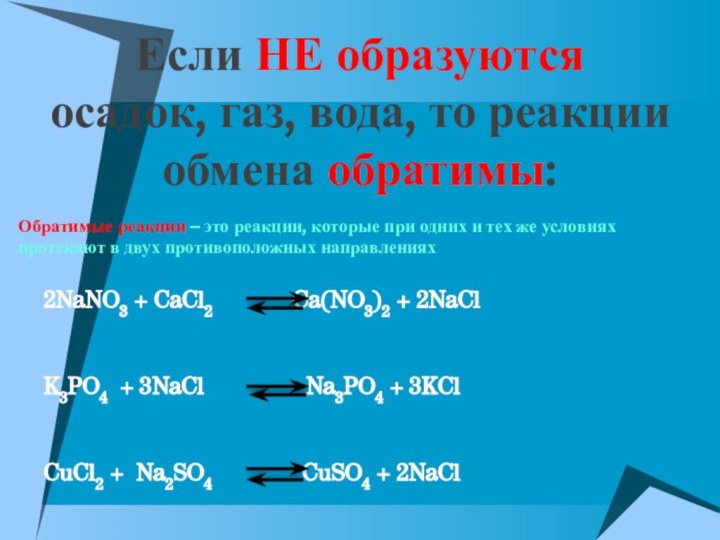
Если НЕ образуются
осадок, газ, вода, то реакции
обмена обратимы:
Обратимые реакции – это реакции, которые при одних
и тех же условиях протекают в двух противоположных направлениях
2NaNO3 + CaCl2 Ca(NO3)2 + 2NaCl
K3PO4 + 3NaCl Na3PO4 + 3KCl
CuCl2 + Na2SO4 CuSO4 + 2NaCl
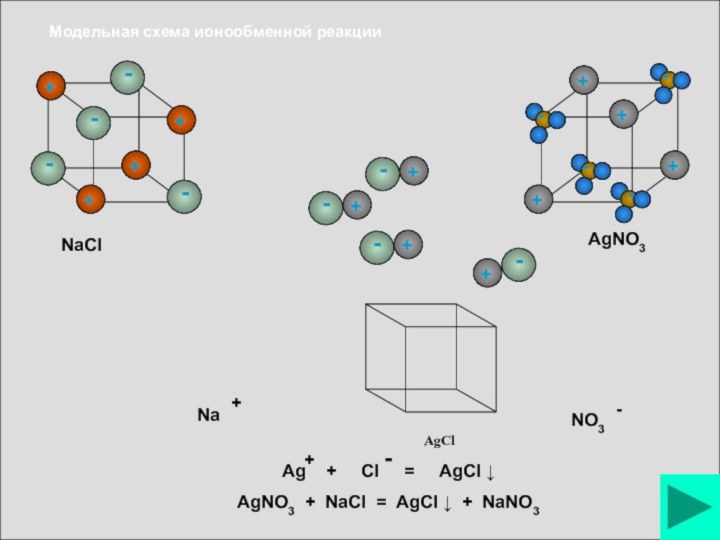
Слайд 19
Правила составления ионных уравнений
1.Простые вещества,
оксиды, а также нерастворимые кислоты, основания и соли не
диссоциируют.2.Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
3.Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
4.Сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части.
Записывая молекулярное уравнение ионного обмена, помним: обмениваются ионы одинакового заряда
Слайд 20
Проверь себя
Составить уравнение между гидроксидом натрия и хлоридом
железа(III) в молекулярном и ионном виде
Слайд 21
Алгоритм составления ионных уравнений
1. Записать молекулярное уравнение реакции
3NaOH +
FeCl3 = Fe(OH)3 + 3NaCl2. С помощью таблицы растворимости определить растворимость каждого вещества.
р р н р
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
3. Составляем полное ионное уравнение. Сильные электролиты записывают в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записывают в виде молекул.
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3 + 3Na+ + 3Cl-
4. Найти одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сократить их слева и справа.
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3 ↓ + 3Na+ + 3Cl-
Составить сокращенное ионное уравнение (выпишите знаки, формулы ионов или веществ, которые приняли участие в реакции).
Fe3+ + 3OH- = Fe(OH)3 ↓
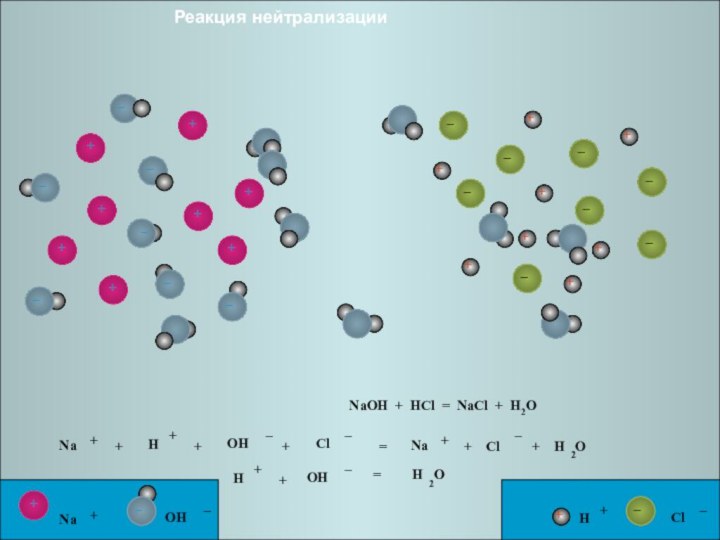
Слайд 23
+
+
+
+
+
+
+
+
+
+
+
+
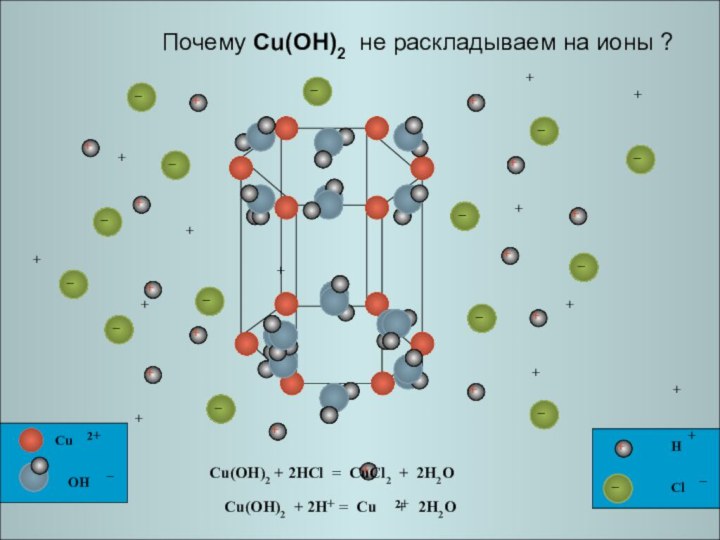
Cu(OH)2 + 2HCl = CuCl2
+ 2H2O Почему Cu(OH)2 не раскладываем на ионы ?
Слайд 24
Физкультминутка
Руки подняли и покачали –
Это деревья в
лесу.
Руки согнули, кисти встряхнули –
Ветер сбивает росу.
В стороны
руки, плавно помашем – Это к нам птицы летят.
Как они тихо садятся, покажем –
Крылья сложили назад.
Слайд 25
Попробуй сам
1. Подобрать молекулярные уравнения к каждому краткому
ионному:
а) СО32- + Са2+ =
СаСО3
б) 3Mg2+ + 2PO43- = Mg3(PO4)2 2. При помощи молекулярных и ионных уравнений ответьте на вопросы:
а) растворы каких солей, присутствующих у вас на столе, надо смешать для получения в осадке йодида свинца?
б) каким способом из NaCl можно получить нитрат натрия?
Слайд 26 Михаил и Алексей делали домашнее задание. Они составили
уравнения реакций, но случайно на лист бумаги пролили чернила.
Помогите ученикам восстановить запись. Составьте к восстановленным уравнениям полные и сокращенные ионные уравнения1) NaOH + HCl NaCl + H2O
2) MgCl2 + Na2SO3 MgSO3 + 2NaCl
3) K2SO3 + HNO3 KNO3 + H2O + SO2
4) ZnSO4 + 2NaOH Zn(OH)2 + Na2SO4
5) Al(OH)3 + 3HNO3 Al(NO3)3 + 3H2O
6) CaCO3 + 2 HCl CaCl2 + H2O + CO2
Слайд 27
Внимание! Правильный ответ
NaOH + HCl
NaCl + H2O
Na+1 + OH-1 + H+1 + Cl-1 Na+1 + Cl-1 + H2OOH-1 + H+1 H2O
2) MgCl2 + Na2SO3 MgSO3 + 2NaCl
Mg+2 + 2Cl-1 + 2Na+1 + SO3-2 MgSO3 + 2Na+1 +2Cl-1
Mg+2 + SO3-2 MgSO3
3) K2SO3 + 2HNO3 2KNO3 + H2O + SO2
2K+1 + SO3-2 + 2H+1 + 2NO3-1 2K+1 + 2NO3-1 + H2O + SO2
SO3-2 + 2H+1 H2O + SO2
Слайд 28
Внимание! Правильный ответ (продолжение)
4) ZnSO4 + 2NaOH
Zn(OH)2 +
Na2SO4Zn+2 + SO4-2 + 2Na+1 + 2OH-1 2Na+1 + SO4-2 + Zn(OH)2
Zn+2 + 2OH-1 Zn(OH)2
5) Al(OH)3 + 3HNO3 Al(NO3)3 + 3H2O
Al(OH)3 + 3H+1 + 3NO3-1 Al+3 + 3NO3-1 + 3H2O
Al(OH)3 + 3H+1 Al+3 + 3H2O
6) CaCO3 + 2 HCl CaCl2 + H2O + CO2
CaCO3 + 2H+1 + 2Cl-1 Ca+2 + 2Cl-1 + H2O + CO2
CaCO3 + 2H+1 Ca+2 + H2O + CO2
Слайд 29
Рефлексия
Я все понял, могу объяснить другому
По данной
теме у меня остались вопросы
Недостаточно понял тему, сам ошибаюсь
Слайд 30 Колдунья с вороном отравили лечебный колодец, в котором
был раствор хлористого кальция, который помогал целому городу. Он
использовался горожанами при отравлениях, кровотечениях, аллергиях. Они превратили раствор СaCl2 в нерастворимый известняк CaCO3. Помогите жителям «расколдовать» колодец, если в вашем распоряжении есть растворы NaCl, Na2CO3, HCl, H2SO4, Zn(NO3)2.
Слайд 31
Внимание! Правильный ответ
СаСО3 + 2HCl
CaCl2 + H2O + CO2
Д.З. Составить полное
и сокращенное ионное уравнениеСлайд 32 Олененок спешит к друзьям. Он шел долгих 3
дня. Ему осталось только перейти реку, но река оказалась
испорчена – она наполнена раствором серной кислоты. Помогите Олененку воссоединиться с друзьями, если в вашем распоряжении есть растворы NaCl, Ba(OH)2 HCl, CuSO4, Ba(NO3)2.
Слайд 33
Внимание! Правильный ответ
H2SO4 + Ba(OH)2
BaSO4 + 2H2O
Д.З. Составить полное и сокращенное
ионное уравнениеСлайд 34 Тигренок и крокодил поранились, а у доктора Айболита
закончились все лекарства. У него в распоряжении есть некоторые
химикаты: NaNO3, CuOH)2 H2SO4, НCl, BaCl2. Он знает, что раствор сульфата меди (II) может оказывать антисептическое, вяжущее, ранозаживляющее действие. Помогите доктору приготовить раствор и вылечить тигренка и крокодила.
Слайд 35
Внимание! Правильный ответ
Cu(OH)2 + H2SO4
CuSO4 + 2H2O
Д.З. Составить полное и сокращенное ионное
уравнениеСлайд 36 Однажды русалка заметила, что ее друзья рыбы перестали
с ней играть и уплывают подальше от ее дома.
Она не могла понять, в чем дело, ведь они не ссорились… И тогда ее мама рассказала ей, что рыбы уплывают, потому что около их дома почти нет растений, и рыбам не хватает кислорода… Русалка подумала, что можно посадить растения, но они будут расти долго… А из старых мудрых книжек она узнала, что можно насытить воду углекислым газом – повышение концентрации СО2 в воде приводит к значительному ускорению в росте растений. В распоряжении русалки оказались: NaOH, ВaCO3, K2SO4, НCl, Ba(NO3)2. помогите русалке получить углекислый газ.
Слайд 37
Внимание! Правильный ответ
BаСО3 + 2HCl
BaCl2 + H2O + CO2
Д.З.
Составить полное и сокращенное ионное уравнение
Слайд 38
Домашнее задание
§ 37 упр. 2, 5 стр. 209
и
не забудьте составить полные и сокращенные ионные уравнения к
заданиям решенным в классе,потому что иначе Ваша помощь сказочным персонажам не будет полной
Слайд 39
Оцените свою деятельность на уроке
Сегодня на уроке мне
было…
- Знания, полученные на уроке, мне пригодятся…
- Сегодня я…
-
Мне было легко…- Мне было сложно…
- О том, что я узнал(а), я расскажу…