Тема: «Азотная кислота»
Цель урока: Рассмотреть свойства азотной кислоты и области ее применения
Слайд 3
План урока:
1. Проверка Д/З (письменная работа);
2. Изучение
нового материала;
3. Закрепление;
4. Подведение итогов;
5. Домашнее задание, его инструктаж.
Слайд 5
Проверка результатов
Задание № 1
Запишите формулу соединения азота и
его название на основании физических свойств
I вариант: Бесцветный газ,
плохо растворим в воде, легко соединяется с кислородом воздуха, образуя бурый газ.
NO – оксид азота (II)
II вариант: Бесцветный газ с характерным резким запахом, хорошо растворим в воде, легче воздуха.
NH3 - аммиак
Слайд 6
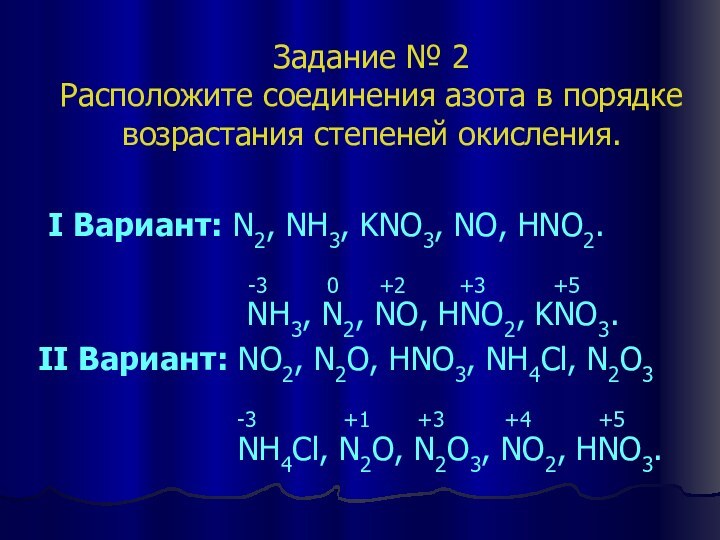
Задание № 2
Расположите соединения азота в порядке возрастания
степеней окисления.
I Вариант: N2, NH3, KNO3, NO, HNO2.
-3 0 +2 +3 +5
NH3, N2, NO, HNO2, KNO3.
II Вариант: NO2, N2O, HNO3, NH4Cl, N2O3
-3 +1 +3 +4 +5
NH4Cl, N2O, N2O3, NO2, HNO3.
Слайд 7
Задание № 3
Составьте уравнения реакций по схеме. Назовите
вещество Х.
I вариант: N2 → X → NH4Cl
X – NH3 (аммиак)
1. N2 + 3H2=2NH3
2. NH3 + HCl = NH4Cl
II Вариант: NO2 → X → NH4NO3
X – HNO3 (азотная кислота)
1.4NO2+2H2O+O2=4HNO3
2. HNO3 + NH3=NH4NO3
Слайд 9
Азотная кислота
HNO3
I. Физические свойства азотной
кислоты;
II. Характеристика кислоты;
III. Химические свойства ;
IV. Применение азотной кислоты.
Слайд 10
I. Физические свойства
азотной кислоты
Агрегатное состояние – жидкость;
Цвет – отсутствует;
Запах – едкий, кислотный;
Растворимость в воде
– хорошая;
«Дымит» на воздухе;
«Особые приметы»:
при хранении на свету разлагается, приобретая желтоватый оттенок:
4HNO3=4NO2↑ + O2↑ + 2H2O
Слайд 11
II. Характеристика HNO3
По основности:
одноосновная
2. По содержанию «О»:
кислородсодержащая
3. По растворимости в воде:
растворимая
4. По стабильности:
нестабильная
5. По летучести:
летучая
6. По степени диссоциации:
сильная
Слайд 12
III. Химические свойства HNO3
Свойства HNO3 как электролита
Диссоциация: HNO3
= H+ + NO3 -
Взаимодействует
А) с оксидами металлов:
CuO + 2HNO3 = Cu(NO3)2 + H2O
CuO + 2H+ = Cu2+ + H2O
Б) с основаниями:
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
В) с солями:
Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
CO32- + 2H+ = CO2 + H2O
Слайд 13
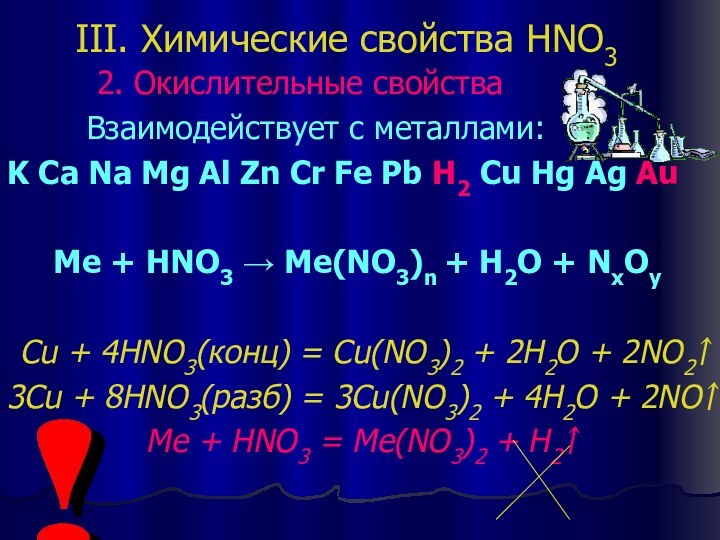
III. Химические свойства HNO3
2. Окислительные свойства
Взаимодействует с металлами:
K
Ca Na Mg Al Zn Cr Fe Pb H2 Cu Hg Ag Au
Ме + HNO3 → Me(NO3)n + H2O + NxOy
Cu + 4HNO3(конц) = Cu(NO3)2 + 2H2O + 2NO2↑
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 4H2O + 2NO↑
Me + HNO3 = Me(NO3)2 + H2↑
Слайд 14
IV. Применение азотной кислоты
HNO3
Слайд 15
Вопросы на закрепление
I. Характерные свойства чистой HNO3:
Твердое
агрегатное состояние;
Хорошая растворимость в воде;
Отсутствие запаха;
Желтый цвет;
Разлагается на свету
с выделением азота;
«Дымит» на воздухе.
Слайд 16
Вопросы на закрепление
II. Назовите вещества, с которыми может
реагировать азотная кислота как электролит:
SO2 H2 ZnO
Ca(OH)2 HCl Na2SiO3 Ag
III. Азотную кислоту применяют для определения примесей в золотых изделиях. Объясните, чем в ряде случаев обуславливается появление бурого газа и голубого раствора при обработке золота кислотой?
Слайд 17
ПОРА ПОДВЕСТИ ИТОГ!
Что я узнал о свойствах азотной
кислоты?
Где применяется азотная кислота?
Слайд 18
Домашнее задание:
Выучить § 27;
Проанализировать записи в
тетради;
Выполнить задания № 3 – 9 стр.
109
(тетрадь с печатной основой).