в главной подгруппе 3 группы.
Порядковый номер элемента –
13Относительная атомная масса – 27
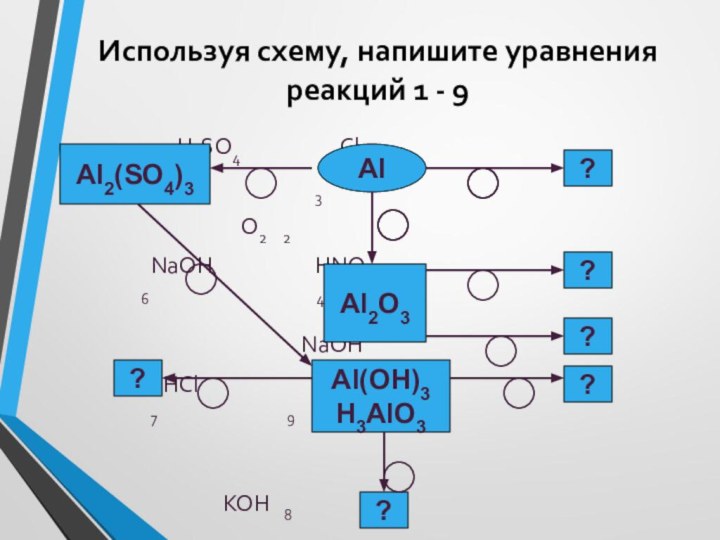
Алюминий – металл, соединения которого обладают амфотерными свойствами.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть