Слайд 4
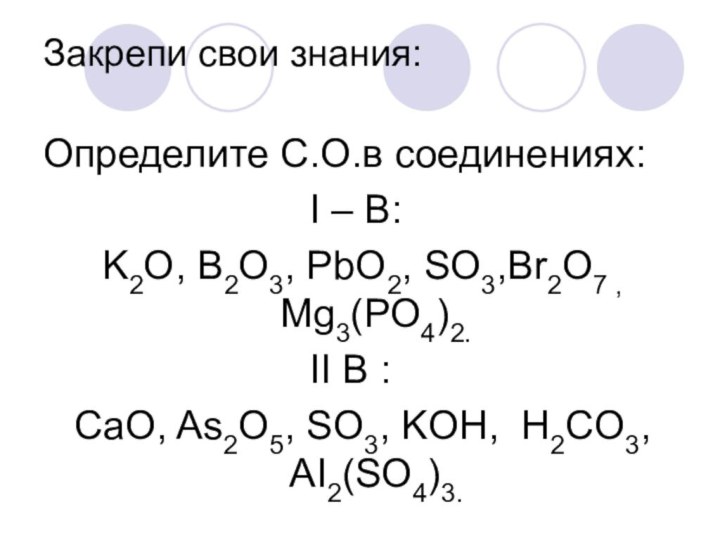
Закрепи свои знания:
Определите С.О.в соединениях:
I
– B:
K2O, B2O3, PbO2, SO3,Br2O7 , Mg3(PO4)2.
II В :
CaO, As2O5, SO3, KOH, H2CO3, AI2(SO4)3.
Слайд 5
ОВР
Реакции, которые протекают с изменением степеней окисления элементов.
Слайд 6
К ОВР относятся:
1.Реакции соединения:
2Cu +O2 = 2CuO
2.Реакции разложения:
C2H6 = 2C + 3H2
3.Реакции замещения:
Cu + 2AgNO3 = 2Ag + Cu(NO3)2
Слайд 7
Определите, является ли реакция ОВР?
0
+2 +6 -2 0
+2 +6 -2
Fe + CuSO4 → Cu + FeSO4
0 0 +2 -2
Ca+ O2 → CaO
2Ca+ O2 = 2 CaO
Слайд 8
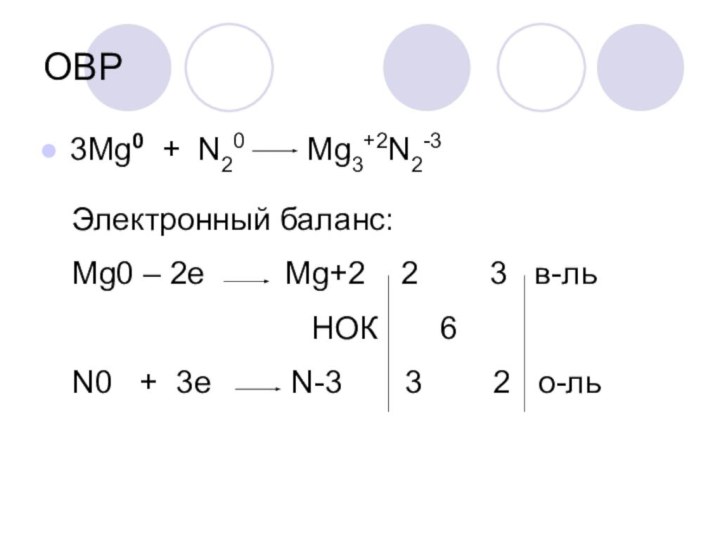
ОВР
3Mg0 + N20 Mg3+2N2-3
Электронный баланс:
Mg0
– 2e Mg+2 2
3 в-ль
НОК 6
N0 + 3e N-3 3 2 о-ль
Слайд 9
Восстановители
Восстановители -
это атомы, молекулы или ионы, которые отдают
электроны.
Процесс отдачи электронов атомами, молекулами или ионами называется окислением.
Слайд 10
Окислители
Окислители -
это атомы, молекулы или ионы, которые
принимают электроны.
Процесс присоединения электронов атомами, молекулами или ионами называется
восстановлением.
Слайд 11
Примеры важнейших восстановителей и окислителей.
Восстановители:
металлы; водород; уголь;
оксид углерода (II) СО; сероводород Н2S; аммиак NH3,' соляная кислота HC1 и т. д.
Окислители:
галогены; азотная НNОз и серная Н2S04 кислоты; перманганат калия КМп04 и др.
Слайд 12
Алгоритм разбора ОВР
1.Составить схему УХР.
2.Определить С.О. всех Х.Э.
3.Подчеркнуть
Х.Э., которые поменяли С.О.
4.Составить электронный баланс, указать окислитель и
восстановитель.
5.Расставить коэффициенты в УХР.
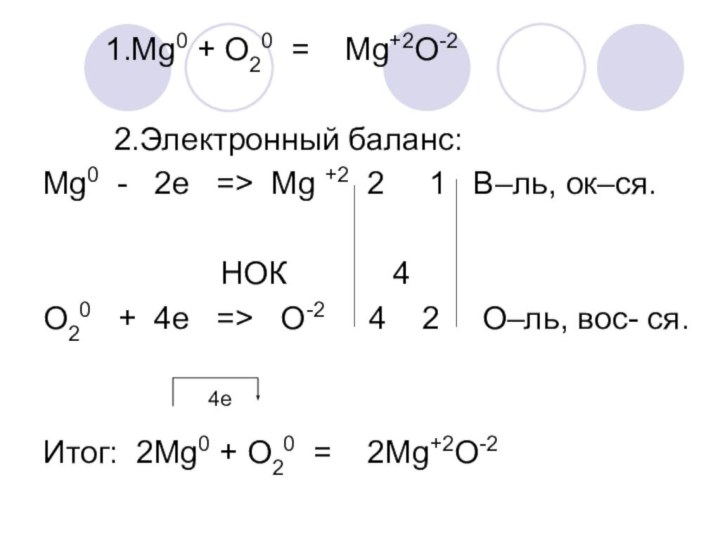
Mg+2O-2
2.Электронный баланс:
Mg0 - 2e => Mg +2 2 1 В–ль, ок–ся.
НОК 4
O20 + 4e => O-2 4 2 О–ль, вос- ся.
4е
Итог: 2Mg0 + O20 = 2Mg+2O-2
Слайд 14
Закрепи свои знания:
Разбери УХР как ОВР:
I – B:
а) S + O2
SO2
б)Fe + HCI FeCI2 + H2
II –B:
а) AI + I2 AII3
б)Fe + CuSO4 FeSO4 + Cu
I.Тест:
1.Какие реакции являются ОВР:
а)замещения
б)обмена
2.Определить С.О. натрия в NaNO3.
а)-1 б) +2 в) +1 г) 0
3.Какие из реакций относятся к ОВР:
а)CaCO3 = CaO + CO2
б)CO2 + 2Mg =2MgO + C
в)Ba(NO3)2 + Na2SO4 =2NaNO3 + BaSO4
г) 2AI + Cr2O3 =AI2O3 + 2Cr
Слайд 16
II.Из следующих утверждений отберите истинные:
а) к ОВР будут
относиться все реакции ионного обмена;
б) все реакции ионного обмена
не будут являться ОВР
в) все реакции замещения являются ОВР;
г) только некоторые реакции замещения являются ОВР;
д) к ОВР реакциям относятся те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество;
е) все реакции разложения и соединения
не являются ОВР.
Слайд 17
Проверка: 1 вариант
Определите С.О.в соединениях:
K+12O-2,B2+3O3-2,Pb+4O2-2 ,
S+6O3-2,Br2+7O7-2 ,
Mg+23(P+5O-24)2.
Слайд 18
Проверка: 2 вариант
Ca+2O-2,As2+5O5-2,S+6O3-2,
K+1O-2H+1, H2+1C+4O3-2,
AI2+3(S+6O4-2)3.
Слайд 19
Проверка: 1 вариант
а)
S0 + O20 S+4O2-2
Электронный баланс:
S0 – 4e => S+4 4 1 В - ль
НОК 4
02 + 4e => 2O-2 4 1 О - ль
б)Fe0 + 2H+CI- Fe+2CI2- + H20
Электронный баланс:
Fe0 – 2e Fe+2 2 1 В - ль
НОК 2
H+ +1e H0 1 2 О - ль
Слайд 20
Проверка: 2 вариант
а) 2AI0 + 3I20 =
2AI+3I3-1
Электронный баланс:
AI0 – 3e => AI+3 3 2 В - ль
НОК 6
I2 + 2е => 2I-1 2 3 О -ль
б)Fe0 + Cu+2S+6O4-2 = Fe+2S+6O4-2 + Cu0
Электронный баланс:
Fe0 - 2е => Fe +2 2 2 В - ль
НОК 2
Cu+2 + 2e=> Cu0 2 2 О - ль
1 –а
2 –в
3 –б, г
II.Выбери правильные утверждения
б, в,
д.
Слайд 22
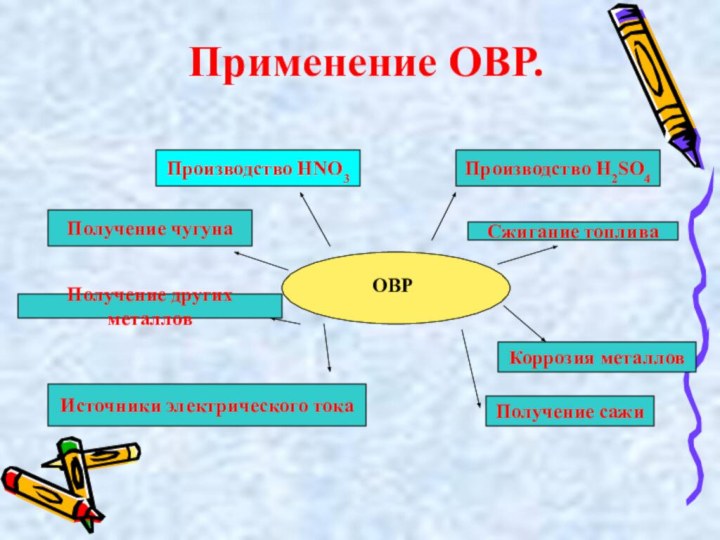
Применение ОВР.
ОВР
Производство H2SO4
Сжигание топлива
Производство HNO3
Коррозия металлов
Получение сажи
Получение чугуна
Получение
других металлов
Источники электрического тока