- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Кислоты (8 класс)
Содержание
- 2. Кислоты
- 3. КислотыМы познакомились с раствором хлороводорода в воде
- 4. КислородсодержащиеБескислородные кислотыАзотная кислота HNO3.Азотистая кислота HNO2.Серная кислота
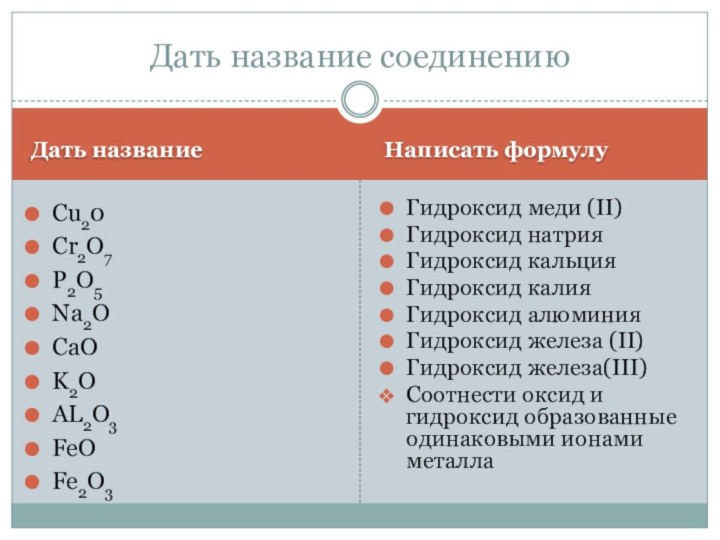
- 5. Кислоты – сложные вещества, молекулы которых состоят
- 6. С.о. атома неметалла в кислотном остатке Например,
- 7. Азотная – H+1N+5O3-2Азотистая – H+1N+3O3-2Серная – H2+1S+6O4-2Сернистая
- 8. Основность кислотыЧисло атомов водорода в кислоте характеризует
- 9. Основность кислотыДвухосновные кислоты – кислоты с двумя
- 10. Основность кислотыТрехосновные кислоты – кислоты с тремя
- 11. Свойства кислотХорошо растворимы в воде, кроме кремниевойКислые
- 12. Техника безопасностиПри попадании кислоты на кожу или
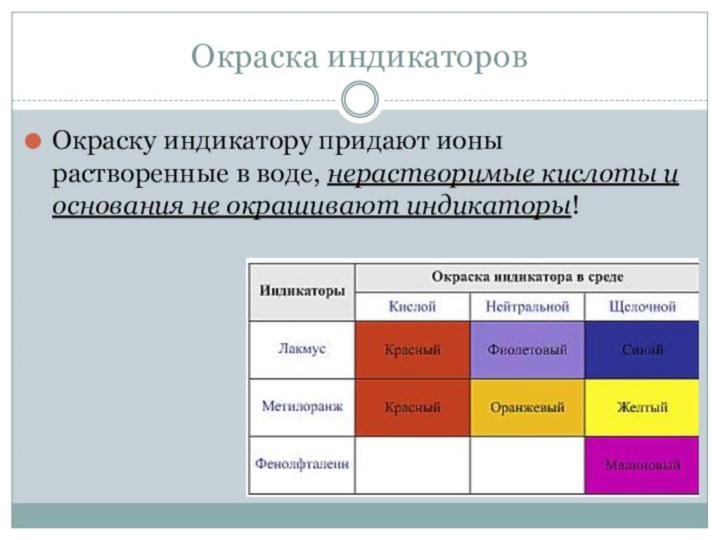
- 13. Окраска индикаторовОкраску индикатору придают ионы растворенные в воде, нерастворимые кислоты и основания не окрашивают индикаторы!
- 14. Выводы1. Кислоты – сложные соединения, в состав
- 15. Скачать презентацию
- 16. Похожие презентации
Кислоты












Слайд 3
Кислоты
Мы познакомились с раствором хлороводорода в воде HCL
– соляной кислотой.
(соединения состоящие из 2-ух видов атомов), третьим элементом как правило является кислород О2 .
Слайд 4
Кислородсодержащие
Бескислородные кислоты
Азотная кислота HNO3.
Азотистая кислота HNO2.
Серная кислота H2SO4.
Сернистая
кислота H2SO3.
Угольная кислота H2CO3.
Кремниевая кислота H2SiO3.
Фосфорная кислота H3PO4.
Хлороводородная кислота
HCl.Фтороводородная кислота HF.
Бромоводородная кислота HBr.
Иодоводородная кислота HI.
Сероводородная кислота H2S.
Кислоты
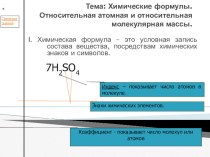
Слайд 5 Кислоты – сложные вещества, молекулы которых состоят из
атомов водорода и кислотного остатка.
H
(NO3)Составим алгоритм определения с. о. атома неметалла, образующего кислотный остаток в молекуле кислоты:
1. Следует помнить! Сумма степеней окисления атомов химических элементов в соединении равна нулю. С. о. кислорода –2, с.о. водорода +1.
2. Неизвестную с. о. элемента в формуле кислоты обозначаем +х.
3.Находим сумму степеней окисления всех химических элементов в формуле кислоты и приравниваем ее к нулю.
4. Решаем уравнения с одним неизвестным и вычисляем х.
Слайд 6
С.о. атома неметалла в кислотном остатке
Например, нужно
сравнить с. о. серы в серной и сернистой кислотах.
H2+1S+X
O4–2,(+1)・2 + (+х) + (–2) ・ 4 = 0,
+х = +6.
С. о. серы в серной кислоте +6.
H2+1S+хO3–2,
(+1) ・ 2 + (+х) + (–2) ・ 3 = 0,
+х = +4.
С. о. серы в сернистой кислоте +4.
Слайд 7
Азотная – H+1N+5O3-2
Азотистая – H+1N+3O3-2
Серная – H2+1S+6O4-2
Сернистая –
H2+1S+4O3-2
Угольная – H2+1C+4O3-2
Кремниевая – H2+1Si+4O3-2
Фосфорная – H3+1P+5O4-2
N2+5O5
N2+3O3
S+6O3
S+4O2
C+4O2
Si+4O2
P2+5O5
Кислота
Соответствующий оксид неметалла
По формулам кислот можно определить заряд иона кислотного остатка, который всегда отрицательный и равен числу атомов водорода в кислоте.
Слайд 8
Основность кислоты
Число атомов водорода в кислоте характеризует основность
кислоты.
Одноосновные кислоты – кислоты с одним атомом водорода, заряд
иона кислотного остатка которых равен 1–.Азотная кислота H(NO3)–.
Азотистая кислота H(NO2)–.
Хлороводородная кислота H(Cl)–.
Фтороводородная кислота H(F)–.
Бромоводородная кислотаH(Br)–.
Иодоводородная кислота H(I)–.
Слайд 9
Основность кислоты
Двухосновные кислоты – кислоты с двумя атомами
водорода, заряд иона кислотного остатка которых равен 2–.
Серная кислота
H2(SO4)2–Сернистая кислота H2(SO3)2–
Угольная кислота H2(CO3)2–
Кремниевая кислота H2(SiO3)2–
Сероводородная кислота H2(S)2–
Слайд 10
Основность кислоты
Трехосновные кислоты – кислоты с тремя атомами
водорода, заряд иона кислотного остатка которых равен 3–
Фосфорная кислота
H3(PO4)3–В водных растворах бескислородные кислоты образуют простые ионы (например, Cl–, S2-), а кислородсодержащие кислоты сложные ионы (например, SO42–, NO3– )
Слайд 11
Свойства кислот
Хорошо растворимы в воде, кроме кремниевой
Кислые на
вкус (пробовать нельзя!!! опасно для жизни!!!)
Органические и неорганические (учебник)
Слайд 12
Техника безопасности
При попадании кислоты на кожу или одежду
немедленно сообщить педагогу
Промыть участок кожи проточной водой
Обработать пораженное место
раствором питьевой содыПри разбавлении кислоты водой, образуется много тепла и кислота разбрызгивается, поэтому наливать можно кислоту в воду тонкой струйкой по стеклянной палочке
Слайд 13
Окраска индикаторов
Окраску индикатору придают ионы растворенные в воде,
нерастворимые кислоты и основания не окрашивают индикаторы!
Слайд 14
Выводы
1. Кислоты – сложные соединения, в состав которых
входятатомы водорода и кислотный остаток.
2. По составу кислоты делятся
на кислородсодержащие и бескислородные.3. По основности кислоты делятся на одноосновные, двухосновные и трехосновные.
4. Кислоты по происхождению бывают органическими и неорганическими и имеют огромное значение в природе и жизни человека.
5. В растворах кислот кислотная среда, которая определяется индикаторами.
6. При работе с кислотами следует соблюдать правила ТБ и ОТ.