- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Химические свойства классов соединений (повторение)
Содержание
- 2. Проверка домашнего заданияОсуществите превращения:Ca
- 3. Свойства оксидовОксидыОсновные(оксиды металлов)Кислотные(оксиды неметаллов)Амфотерные(оксиды переходныххимических элементов)
- 4. Свойства оксидовОКСИДОсновныйКислотныйВодаЩелочьКислотаСОЛЬВодаВодаЩелочьВодаКислота
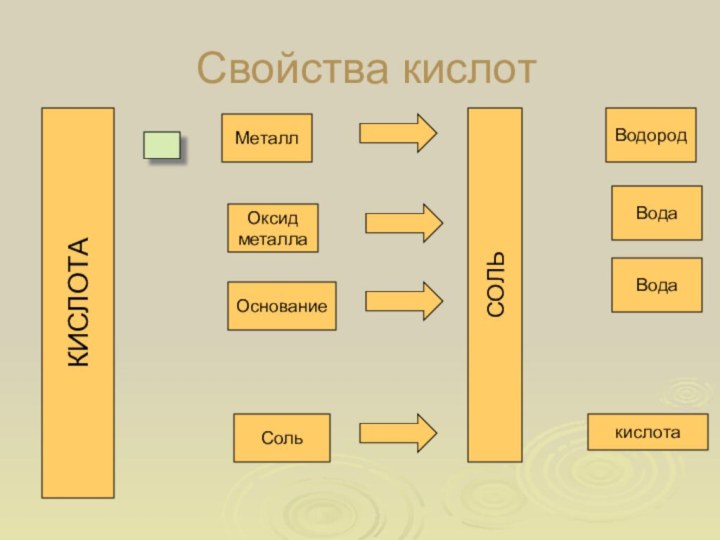
- 6. Свойства кислотКИСЛОТАМеталлОксид металлаОснованиеСольСОЛЬВодаВодакислотаВодород
- 8. Свойства основанийОСНОВАНИЕЩЕЛОЧЬНЕРАСТВОРИМОЕОксид неметаллакислотаСолькислотаСОЛЬВодаОснованиеВодаВодаВодаОксид металла
- 10. Свойства солейСольМеталлкислотаЩелочьСоль 1Соль Металл 1Кислота 1ОснованиеСоль 2
- 12. Составление ионных уравнений
- 13. 1. Записать молекулярное уравнение реакцииДаны растворы хлорида
- 14. 2. Подчеркнуть формулы электролитов (формулы кислот, оснований,
- 15. FeCl3KOHFe(OH)3KCl
- 16. РРРН
- 17. 3. Написать полное ионное уравнение реакции.ЗАПОМНИТЬ!!!В ионных
- 18. 4. Для составления сокращённого ионного уравнения надо
- 19. Задание: Напишите молекулярные и ионные уравнения для
- 20. Скачать презентацию
- 21. Похожие презентации
Проверка домашнего заданияОсуществите превращения:Ca CaO Ca(OH)2 Ca3(PO4)2Si SiO2 H2SiO3 Fe2(SO4)3
















Слайд 2
Проверка домашнего задания
Осуществите превращения:
Ca CaO
Ca(OH)2 Ca3(PO4)2
SiO2 H2SiO3 Fe2(SO4)3
Слайд 3
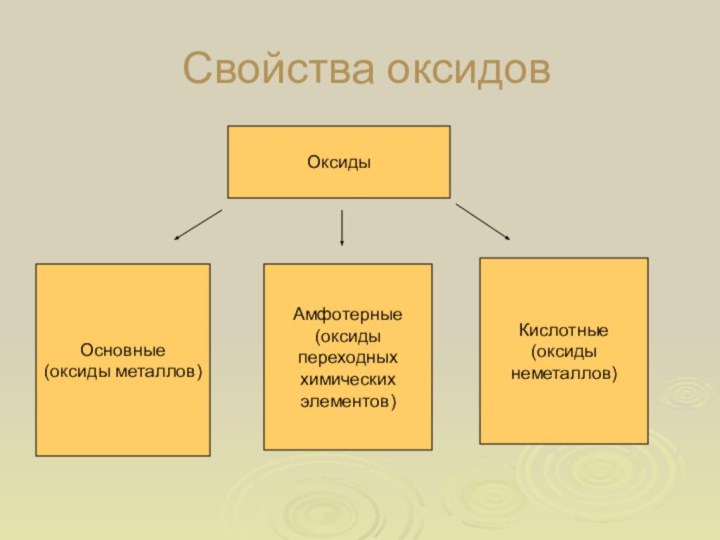
Свойства оксидов
Оксиды
Основные
(оксиды металлов)
Кислотные
(оксиды
неметаллов)
Амфотерные
(оксиды
переходных
химических
элементов)
Слайд 8
Свойства оснований
ОСНОВАНИЕ
ЩЕЛОЧЬ
НЕРАСТВОРИМОЕ
Оксид
неметалла
кислота
Соль
кислота
СОЛЬ
Вода
Основание
Вода
Вода
Вода
Оксид
металла
Слайд 13
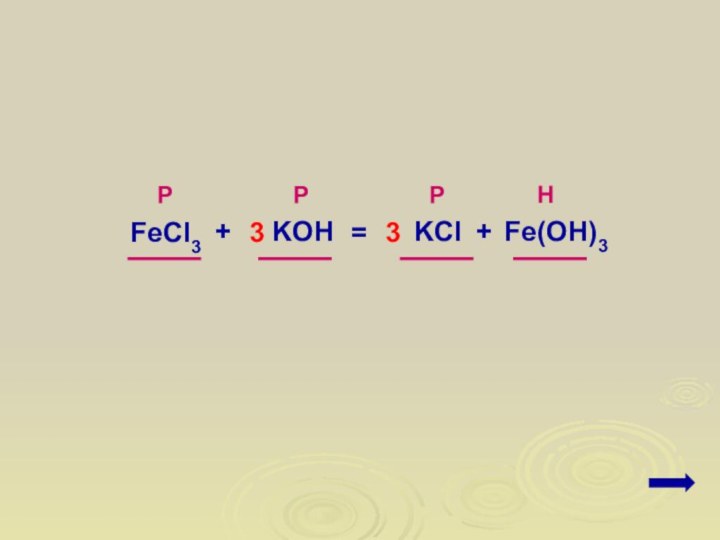
1. Записать молекулярное уравнение реакции
Даны растворы хлорида железа(III)
и гидроксида калия. Написать молекулярное и ионные уравнения реакции
между этими растворами.FeCl3
+
+
KOH
KCl
Fe(OH)3
=
3
3
расставить коэффициенты
Слайд 14
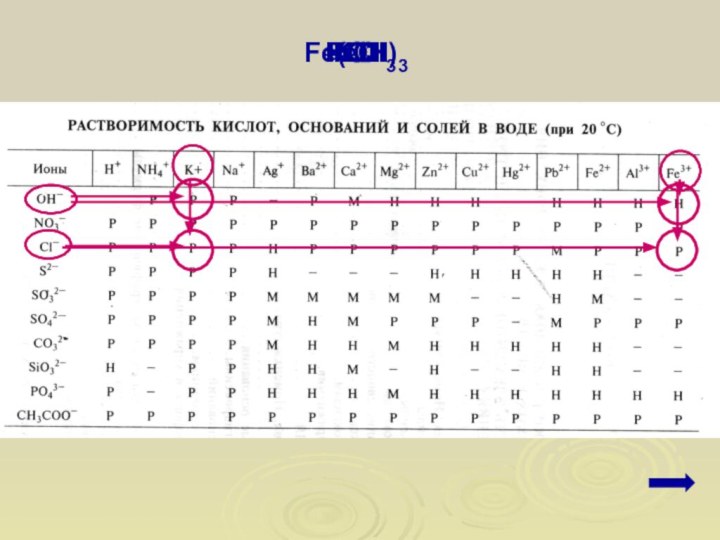
2. Подчеркнуть формулы электролитов (формулы кислот, оснований, солей
Используя
таблицу растворимости определить растворимость электролитов и записать результат над
формулами (Р, М, Н).
Слайд 17
3. Написать полное ионное уравнение реакции.
ЗАПОМНИТЬ!!!
В ионных уравнениях
формулы электролитов
1) растворимых в воде всегда записываются в диссоциированном
виде;2) нерастворимых в воде всегда записываются в молекулярном виде;
3) малорастворимых в воде слева записываются в диссоциированном виде, а справа – в молекулярном.
Fe3+
+
+
K+
K+
Fe(OH)3
=
3
3
Cl-
+
+
OH-
Cl-
3
3
+
3
FeCl
+
+
KOH
KCl
Fe(OH)3
=
3
3
Р
Р
Р
Н
3
Необходимо учитывать индексы у ионов и коэффициенты в уравнении реакции.
Слайд 18 4. Для составления сокращённого ионного уравнения надо найти
одинаковые ионы справа и слева от знака равенства и
вычеркнуть их.Fe3+
+
+
K+
K+
Fe(OH)3
=
3
3
Cl-
+
+
OH-
Cl-
3
3
+
3
5. Записать уравнение без вычёркнутых ионов.
Fe3+
Fe(OH)3
=
+
OH-
3
Слайд 19 Задание: Напишите молекулярные и ионные уравнения для следующих
реакций.
а) КОН + FeSO4 →
б) CuCl2 + H2S →
в) HNO3 +
NaOH → г) СаСO3 + НС1 →
д) Ba(NO3)2 + НСl →
е) Na2CO3 + КСl →





























