- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Алюминий
Содержание
- 2. Al Выполнил: преподаватель химии Безносова М.Ю.АлюминийОГБОУ НПО Профессиональное училище №6 г. Зима
- 3. Из истории открытия В
- 4. Цели урока:Изучить свойства металлов 3 А группы
- 5. Al 13Алюминий (лат. (лат. Aluminium(лат. Aluminium) 38226,98153s2 3p1
- 6. Al 13Алюминий (лат. Aluminium) 38226,98153s2 3p1Был впервые
- 7. Al 13Алюминий (лат. (лат. Aluminium(лат. Aluminium) 38226,98153s2
- 8. Al 13Алюминий (лат. (лат. Aluminium(лат. Aluminium) 38226,98153s2 3p1Атомная масса элемента
- 9. Al 13Алюминий (лат. (лат. Aluminium(лат. Aluminium) 38226,98153s2 3p1 Электронная конфигурация элемента +13Al 2е 8ē 3ē
- 10. Схема расположения электронов на энергетических подуровнях+13Al 1s2
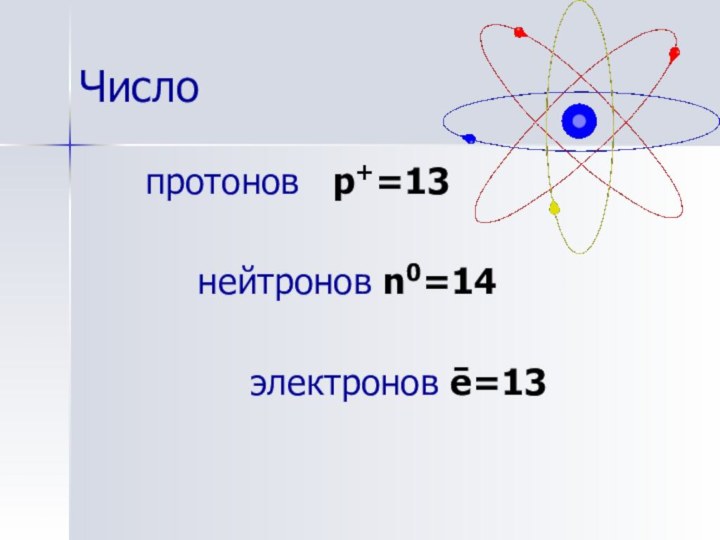
- 11. Числопротонов p+=13 нейтронов n0=14 электронов ē=13
- 12. Al – типичный металлСхема образования вещества
- 13. Физические свойства вещества Al – серебристо-белый металл, пластичный,
- 14. Химические свойства вещества Al активный металл восстанавливает
- 15. Алюминий реагирует: 1. 2Al+3O2 =
- 16. Получение веществаАлюминий получают электролизом раствора глинозема в
- 17. Применение Al
- 18. Ряд факторов применения алюминия:Алюминий – самый распространенный
- 19. Скачать презентацию
- 20. Похожие презентации
Al Выполнил: преподаватель химии Безносова М.Ю.АлюминийОГБОУ НПО Профессиональное училище №6 г. Зима

















Слайд 3
Из истории открытия
В период
открытия алюминия - металл был дороже золота. Англичане хотели
почтить богатым подарком великого русского химика Д.И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая - из алюминия. Чашка из алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не только учёных, но и промышленников и даже императора Франции.
Слайд 4
Цели урока:
Изучить свойства металлов 3 А группы на
примере алюминия.
Дать характеристику элемента по его положению в
периодической системе химических элементов. На основе строения атома рассмотреть его физические и химические свойства, указать области применения алюминия.
Ответить на вопрос: « Почему алюминий называют металлом будущего?»
Слайд 6
Al
13
Алюминий
(лат. Aluminium)
3
8
2
26,9815
3s2 3p1
Был впервые получен датским
физиком Х.К. Эрстедом в 1825 г. Название этого элемента
происходит от латинского алюмен, так в древности назывались квасцы, которые использовали для крашения тканей. Латинское название, вероятно, восходит к греческому «халмэ» - рассол, соляной раствор.
Слайд 7
Al
13
Алюминий
(лат. (лат. Aluminium(лат. Aluminium)
3
8
2
26,9815
3s2 3p1
Порядковый номер.
Химический элемент III группы главной подгруппы 3-го периода.
Слайд 9
Al
13
Алюминий
(лат. (лат. Aluminium(лат. Aluminium)
3
8
2
26,9815
3s2 3p1
Электронная
конфигурация элемента +13Al 2е 8ē 3ē
Слайд 10
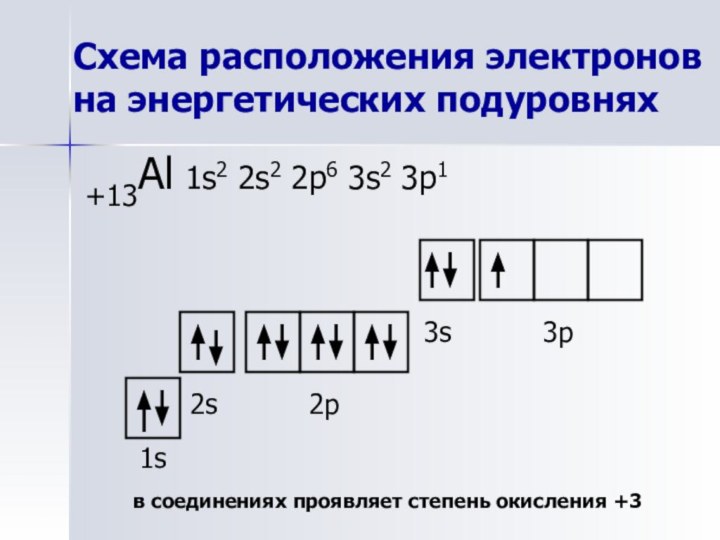
Схема расположения электронов на энергетических подуровнях
+13Al 1s2 2s2
2p6 3s2 3p1
1s
2s
2p
3s
3p
в соединениях проявляет степень окисления +3
Слайд 12
Al – типичный металл
Схема образования вещества
Al 0- 3ē ↔ Al+3
Тип химической связи -металлическая
Тип кристаллической
решетки – кубическая гранецентрированная
Слайд 13
Физические свойства вещества
Al – серебристо-белый металл, пластичный, легкий,
хорошо проводит тепло и электрический ток, обладает хорошей ковкостью,
легко поддаётся обработке, образует лёгкие и прочные сплавы.ρ=2,7 г/см3
tпл.=6600С
Слайд 14
Химические свойства вещества
Al активный металл восстанавливает все
элементы, находящиеся справа от него в электрохимическом ряду напряжения
металлов, простые вещества – неметаллы. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта защитной оксидной плёнкой Al2 O3
Слайд 15
Алюминий реагирует:
1. 2Al+3O2 = 2Al2O3 +
Q – покрывается пленкой оксида, но в мелкораздроблен-ном виде
горит с выделением большого количества теплоты.2. 2Al + 3Cl2 = 2 AlCl3 (Br2, I3) – на холоде
3. 2Al + 3S = Al2S3 - при нагревании
4. 4Al + 3С = Al4С3 - при нагревании
5. Алюминотермия – получение металлов: Fe, Cr, Mn, Ti, W и другие, например:
3Al + 3Fe3O4 = 4Al2O3 + 9Fe
Слайд 16
Получение вещества
Алюминий получают электролизом раствора глинозема в расплавленном
криолите (Na3AIF6), электролизом расплава AlCl3 (расходуется около 16 кВт·час
на 1 кг Al)Электролиз: Al2O3 при 9500С в расплаве криолита: На катоде: Al3+ + 3e = Al0
Слайд 18
Ряд факторов применения алюминия:
Алюминий – самый распространенный металл
земной коры. Его ресурсы практически неисчерпаемы.
Обладает высокой коррозионной стойкостью
и практически не нуждается в специальной защите.Высокая химическая активность алюминия используется в алюминотермии.
Малая плотность в сочетании с высокой прочностью и пластичностью его сплавов делает алюминий незаменимым конструкционным материалом в самолетостроений и способствует расширению его применения в наземном и водном транспорте, а также в строительстве.
Относительно высокая электропроводность позволяет заменять им значительно более дорогую медь в электротехнике.