Слайд 2
Природные оксиды
1) Руды железа – красный (Fe2O3), бурый
(Fe2O3*nH2O), и магнитный (Fe3O4) железняки;
2) SiO2 – песок, кварц,
кремнезем;
3) Al2O3* nH2O – глина.
В основном из оксидов состоит земная кора – литосфера;
Из оксида водорода Н2О состоит водная оболочка Земли – гидросфера;
В состав атмосферы входит углекислый газ СО2.
Слайд 3
По агрегатному состоянию все оксиды делят на:
1) Твердые
– SiO2, CuO, Fe2O3 CaO, BaO (преимущественно оксиды металлов)
2)
Жидкие – H2O, SO3
3) Газообразные – CO2 , SO2 ,NO2 ,NO (преимущественно оксиды неметаллов)
Оксид алюминия (глинозём) –
Слайд 7
Бесцветное вещество, без вкуса и запаха, плотность 1
г/см3, температура кипения 1000С , температура плавления (замерзания) –
00С.
Слайд 8
По составу и свойствам все оксиды можно разделить
:
ОСНОВНЫЕ - оксиды металлов с валентностью меньше (IV)
Li2O, K2O, MgO, FeO, CuO, Cu2O, Al2O3
BaO, MnO, NiO, CrO .
КИСЛОТНЫЕ – oксиды НЕМЕТАЛЛОВ и металлов с валентностью больше (IV)
CO2 , N2O5 , SO2, P2O5 , SO3 CrO3,Mn2O7.
Слайд 9
Основные оксиды
1.
Соответствуют основаниям:
Na2O – NaOH, K2O –
KOH,
MgO – Mg(OH)2, CaO – Ca(OH)2,
FeO – Fe(OH)2, Fe2O3 – Fe(OH)3.
2. Взаимодействуют с кислотами с образованием соли и воды:
Na2O + H2SO4 = Na2SO4 + H2O
CaO + 2HCl = CaCl2 + H2O
Слайд 10
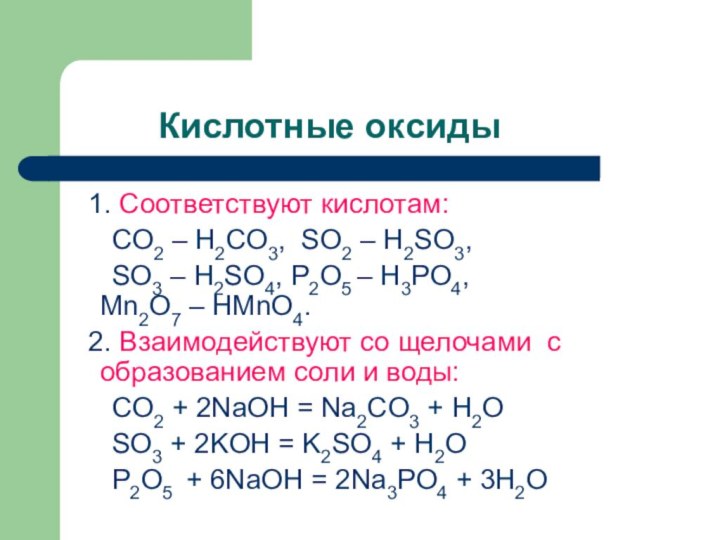
Кислотные оксиды
1.
Соответствуют кислотам:
CO2 – H2CO3, SO2 –
H2SO3,
SO3 – H2SO4, P2O5 – H3PO4, Mn2O7 – HMnO4.
2. Взаимодействуют со щелочами с образованием соли и воды:
CO2 + 2NaOH = Na2CO3 + H2O
SO3 + 2KOH = K2SO4 + H2O
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
Слайд 11
Общие химические свойства
1. Взаимодействуют с водой:
Na2O + H2O = 2NaOH – ЩЕЛОЧЬ
SO3
+ H2O = H2SO4 – КИСЛОТА
2. Взаимодействуют друг с другом:
CaO + CO2 = CaCO3
Na2O + SO3 = Na2SO4
3K2O + P2O5 = 2K3PO4
Слайд 12
Способы получения оксидов
Горение :
1. Простых веществ:
S + O2 = SO2
C + O2 = CO2
4Al + 3O2 = 2 Al2O3
2. Cложных веществ:
CH4 +2O2 = CO2 + 2H2O
2ZnS + 3O2 = 2ZnO + 2SO2
Слайд 13
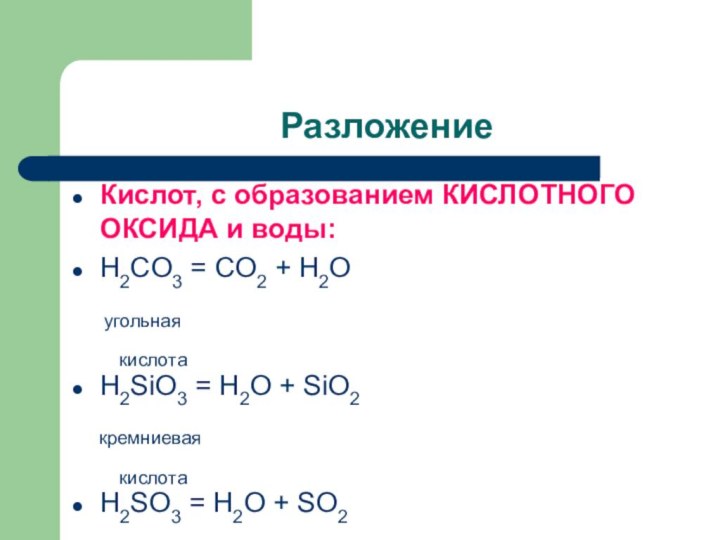
Разложение
Кислот, с образованием КИСЛОТНОГО ОКСИДА и
воды:
H2CO3 = CO2 + H2O
угольная
кислота
H2SiO3 = H2O + SiO2
кремниевая
кислота
H2SO3 = H2O + SO2
сернистая кислота
Слайд 14
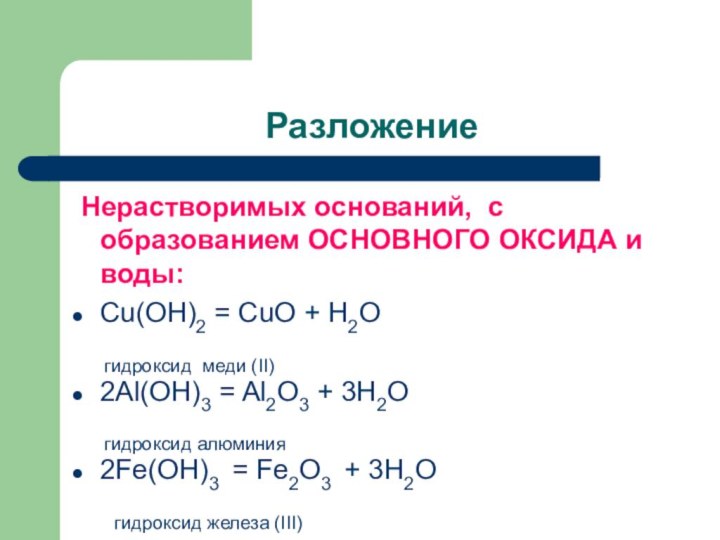
Разложение
Нерастворимых оснований, с образованием ОСНОВНОГО ОКСИДА и
воды:
Cu(OH)2 = CuO + H2O
гидроксид меди (II)
2Al(OH)3
= Al2O3 + 3H2O
гидроксид алюминия
2Fe(OH)3 = Fe2O3 + 3H2O
гидроксид железа (III)
Слайд 15
Разложение
Солей, с образованием ОСНОВНОГО и КИСЛОТНОГО оксида:
CaCO3
= CaO + CO2
карбонат кальция
MgSiO3 = MgO + SiO2
силикат магния
BaCO3 = BaO + CO2
карбонат бария
Слайд 16
Задание
Составьте формулы оксидов:
Оксид марганца(VII)
Оксид хрома(VI)
Оксид серы(IV)
Оксид алюминия
Оксид кальция
Оксид хлора(III)
Оксид азота(V)
Оксид углерода (IV)
Слайд 17
Из предложенного перечня веществ выпишите формулы основных и
кислотных оксидов:
Ca(OH)2 , Na2O , HNO3 , CaO
, Cu(OH)2 , BaO , FeCl3 , CaSO4 , Cr2O3 , HCl , CuO , NaOH , H2SO4 , PbO , Fe(OH)3 , K2O , H2S , MgO , KOH , Mg(NO3)2 , H2O , AgCl , CO2 AgNO3 , N2O5, SO2, P2O5. Mn2O7 . Все оксиды назовите.
Задание
Дайте название веществу.
Определите валентность каждого элемента
в веществе.
Вычислите относительную молекулярную массу вещества.
Вычислите массовую долю кислорода в веществе.
Определите массовые отношения элементов в веществе.
MgO, H2O, K2O, SO3, CO2 , СаО
Слайд 19
Решите задачи:
Какому количеству вещества соответствуют 22 грамма оксида
углерода (IV)? Какое число молекул содержится в данной массе?
Рассчитайте
массу и число молекул содержащихся в 2 моль оксида серы(IV).
Какую массу имеют 12,04*1023 молекул кислорода?
Оксид трёхвалентного элемента имеет относительную молекулярную массу 160. Определите элемент.