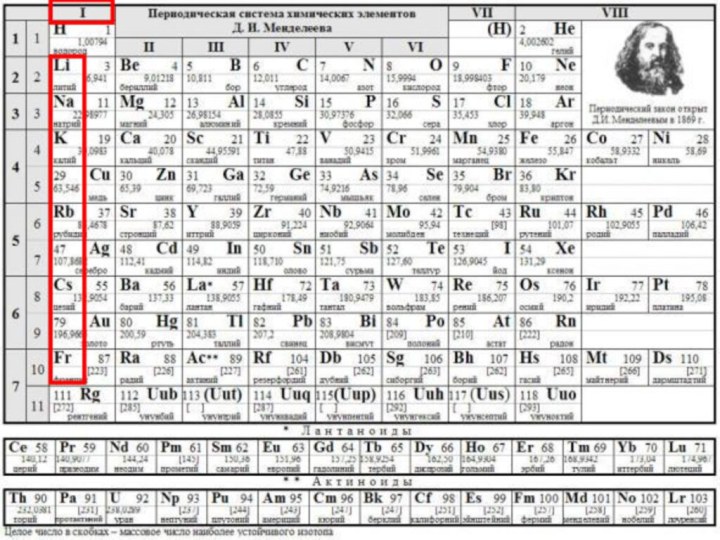
Периодической системы химических элементов Д.И. Менделеева, повторить основные закономерности
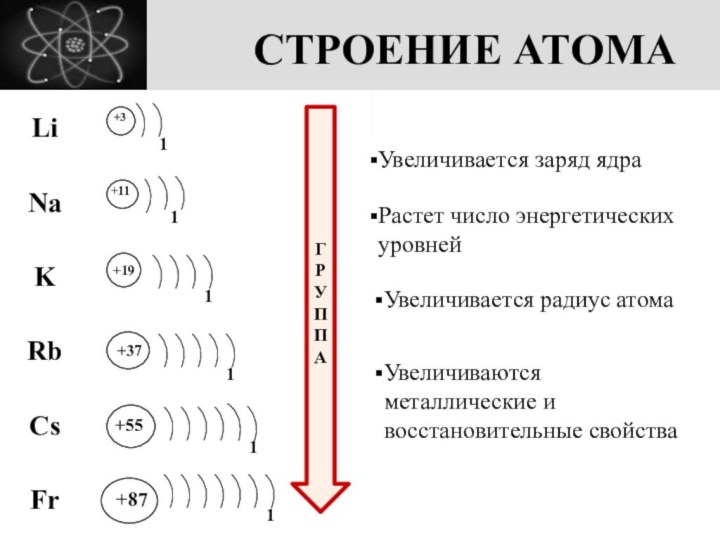
изменения свойств элементов по вертикали (в группе), металлическую связь и кристаллическую решетку, физические свойства металловЦЕЛЬ УРОКА:
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть













ЦЕЛЬ УРОКА:
При обычных условиях этот металл жидкий -
C r
O s
F e
H g
Самый тугоплавкий металл -
W
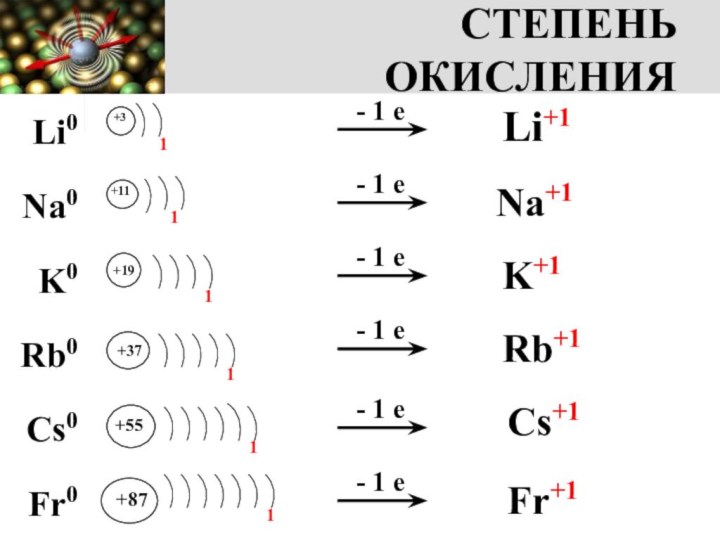
+1
+1
+1
+1
+1
+1
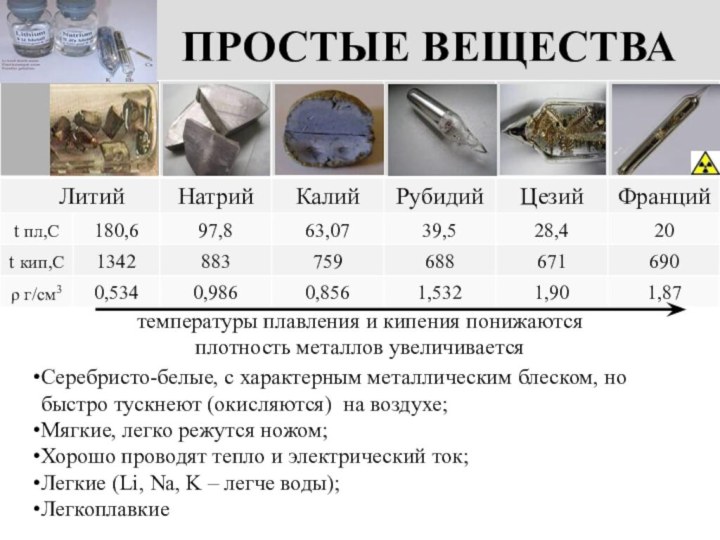
температуры плавления и кипения понижаются
плотность металлов увеличивается
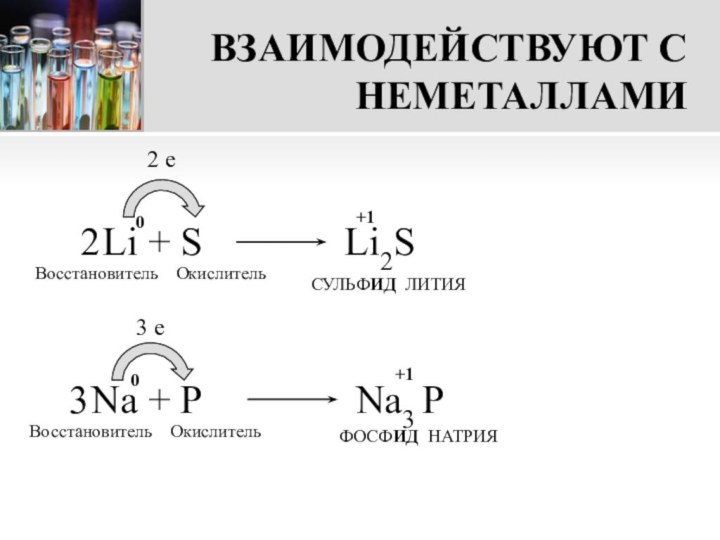
Образуют соединения с ионной связью и ионной кристаллической решеткой
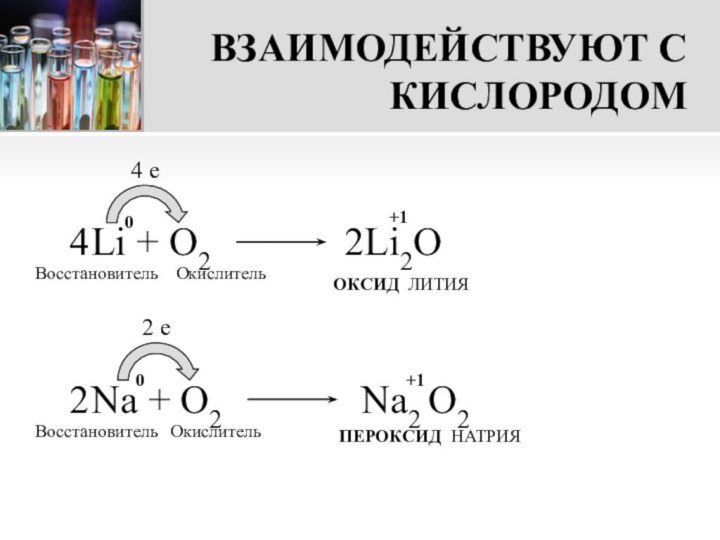
ПЕРОКСИД НАТРИЯ
Na O O Na
+1
-1
-1
+1
На этой реакции основано применение пероксида натрия для получения кислорода на подводных лодках и для регенерации воздуха в закрытых помещениях.
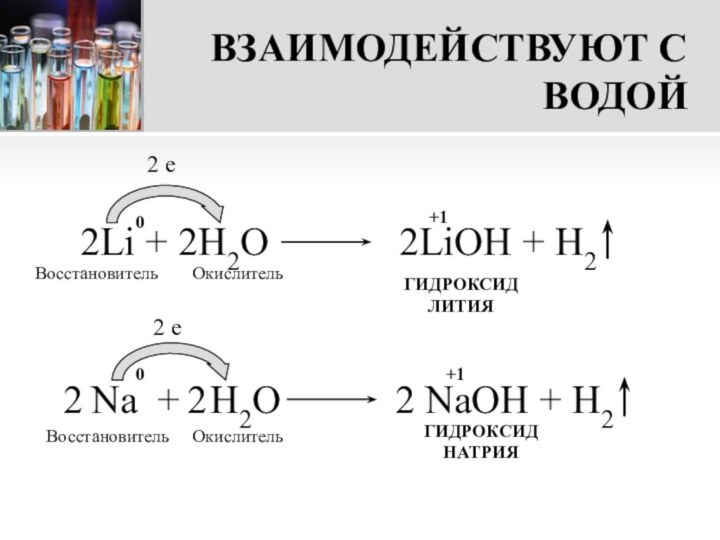
Так как гидроксиды металлов I группы главной подгруппы образуют щелочи, то их групповое название – ЩЕЛОЧНЫЕ МЕТАЛЛЫ
+1
0
Na + H2О
2 NaOH + H2
2
2
0
+1
2 e
Беречь от воды
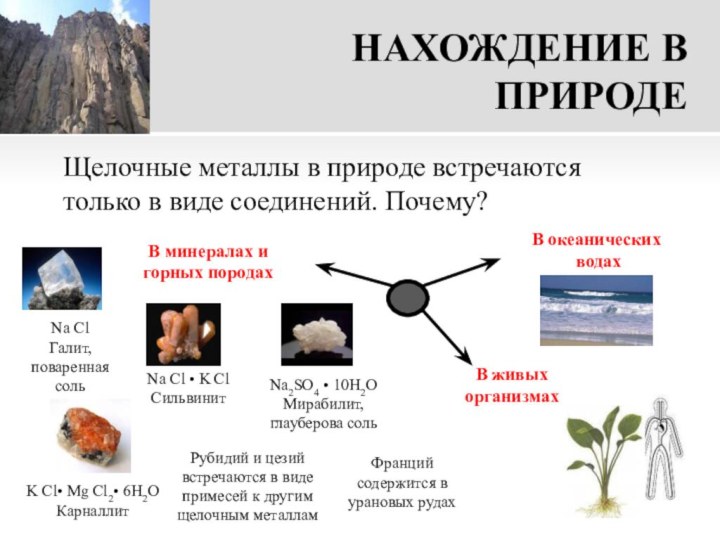
K Cl• Mg Cl2• 6H2O
Карналлит
Na2SO4 • 10H2O
Мирабилит, глауберова соль
В океанических
водах
В минералах и горных породах
В живых организмах
Рубидий и цезий встречаются в виде примесей к другим щелочным металлам
Франций содержится в урановых рудах
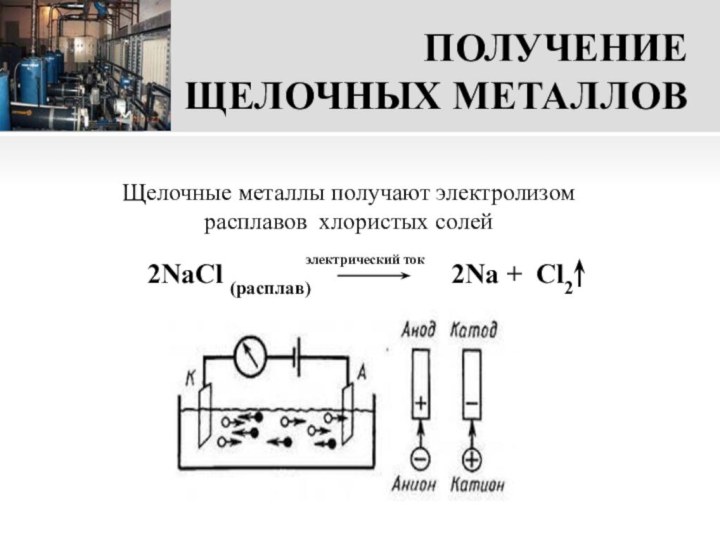
Щелочные металлы получают электролизом расплавов хлористых солей
электрический ток
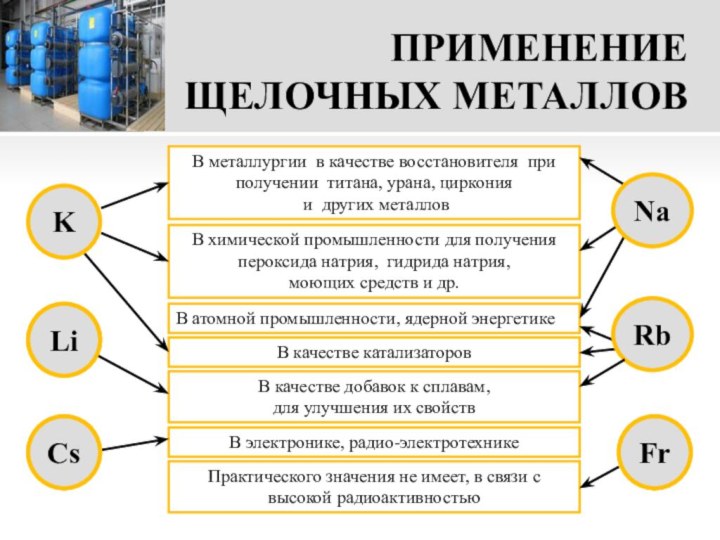
В качестве добавок к сплавам,
для улучшения их свойств
В атомной промышленности, ядерной энергетике
Практического значения не имеет, в связи с высокой радиоактивностью
В качестве катализаторов
В электронике, радио-электротехнике
Na
Rb
Fr
K
Li
Cs
a) Cs
a) Li
a) Fr
a) K
3. При взаимодействии с кислородом образует пероксид
a) Ca
a) Na
a) Li
a) Mg
4. Степень окисления щелочных металлов
a) +2
a) +1
a) +3
a) +4
Б) Заряд ядра + 37
В) Самый легкий металл
Г) Общее число электронов в атоме 19
Д) Входит в состав поваренной соли