Слайд 2
Цели:
Обобщить и систематизировать знания о щелочноземельных металлах
Уметь характеризовать
элементы по положению в периодической таблице
Знать физические и химические
свойства
применение соединений щелочноземельных металлов
Слайд 3
Положение в периодической таблице.
В периодической системе находятся
в главной подгруппе II группы.
Являются сильными восстановителями, отдают 2
ē, во всех соединениях проявляют степень окисления +2.
Общая конфигурация внешнего энергетического уровня nS²
Mg +12 2ē, 8ē, 2ē
Ca +20 2ē, 8ē, 8 ē, 2ē
Sr +38 2ē, 8ē, 18 ē, 8ē, 2ē
Ba +56 2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē
Слайд 4
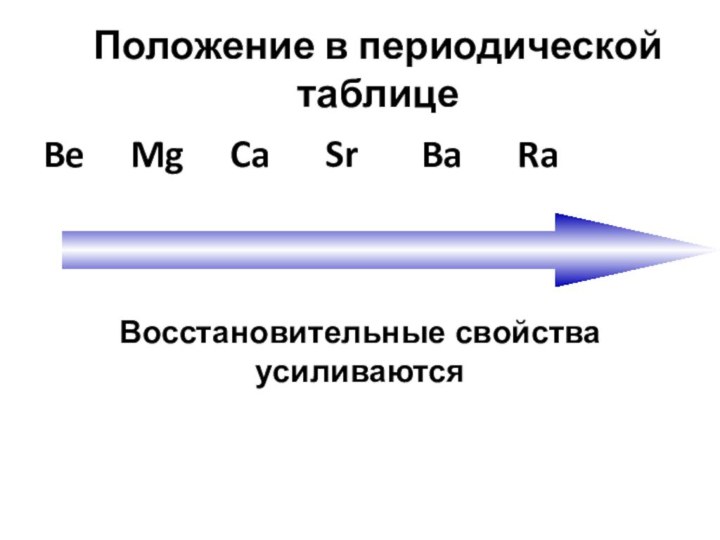
Положение в периодической таблице
Be Mg
Ca Sr Ba
Ra
Восстановительные свойства усиливаются
Слайд 5
Строение атома
+4 ) )
+12 ) ) )
+20 )
) ) )
+38 ) ) ) ) )
+56 )
) ) ) ) )
Ве
Mg
Ca
Sr
Ba
2
2
2
2
2
Слайд 6
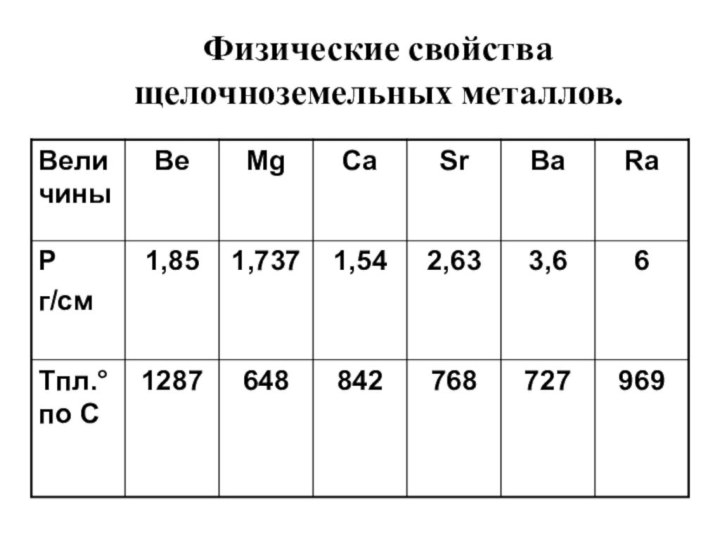
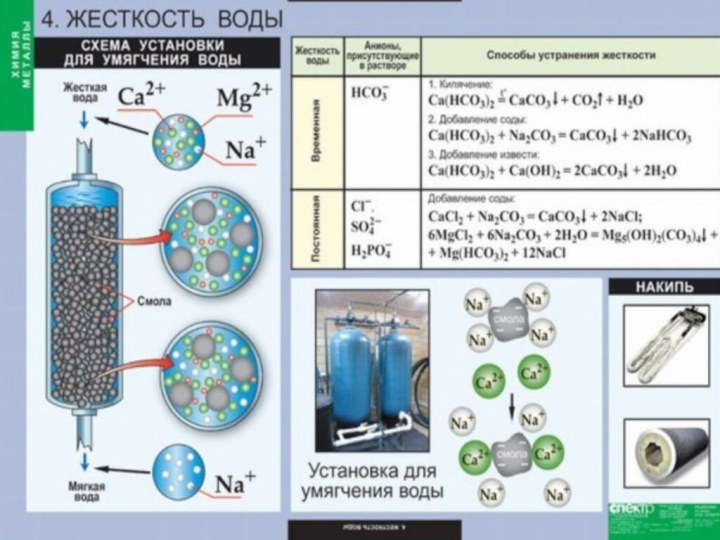
Физические свойства щелочноземельных металлов.
Слайд 7
Физические свойства
цвет пламени
þ
t плавления
1,74г/см3 651 С0
1,54г/см3 851С0
2,63г/см3 770С0
3,76г/см3 710С0
Mg
Ca
Sr
Ba
Слайд 8
Нахождение в природе
Бериллий: 3BeO • AlO3 • 6SiO2
– берилл
Магний: MgCO3 – магнезит
KCl • MgSO4 • 3H2O
– каинит
KCl • MgCl2 • 6H2O – карналлит
Кальций: CaCO3 • MgCO3 – доломит
CaCO3 – кабонат(известняк, мрамор, мел.)
Ca3(PO4)2 – апатит, фосфат кальция
CaSO4 • 2H2O – гипс
2CaSO4. H2O-алебастр
CaF2 – плавиковый шпат (флюорит)
Стронций: SrSO4 – целестин
SrCO3 – стронцианит
Барий: BaSO4 – барит
BaCO3 – витерит
Слайд 9
Химические свойства
1. С простыми веществами(неметаллами)
2Me0 +O2 →
2Me+2O-2 - оксид
Me0 +H2 → Me+2H2 -
гидрид
Me0 +Cl02 → Me+2Cl2 - хлорид
Me0 +S0 → Me+2S-2 - сульфид
«2. Со сложными веществами
Me0 +2HCl → Me+2Cl2 + H2
Me0 +2HOH → Me+2(OH)2 +Н2
Слайд 10
Соединения щелочноземельных
металлов
Оксиды щелочноземельных металлов
–МеО, имеют основный характер, легко реагируют с оксидами неметаллов
с образованием соответствующих солей.
Слайд 11
CaCO3
Карбонат кальция – одно
из самых распространённых на Земле соединений. Его содержат горные
породы – мел, мрамор, известняк.
Слайд 12
Ca3(PO4)2
Входит в состав
фосфоритов и апатитов, а также в состав костей и
зубов. В организме взрослого человека содержится 1 кг Са в виде фосфата кальция.
Слайд 13
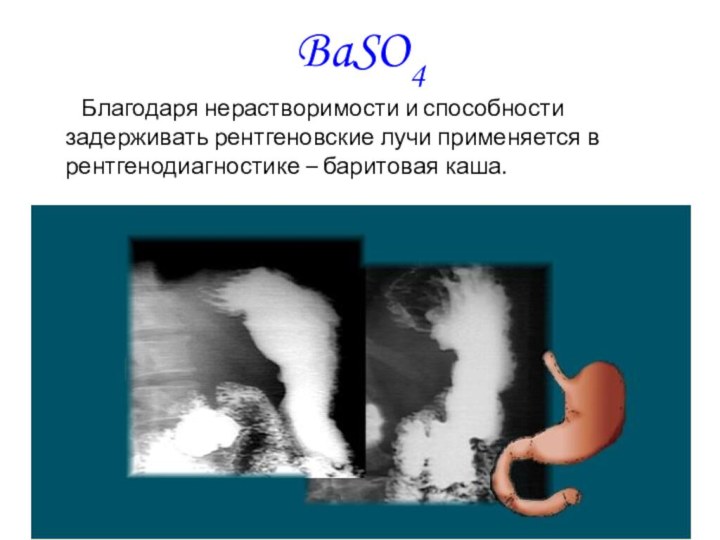
BaSO4
Благодаря нерастворимости и
способности задерживать рентгеновские лучи применяется в рентгенодиагностике – баритовая
каша.
Слайд 14
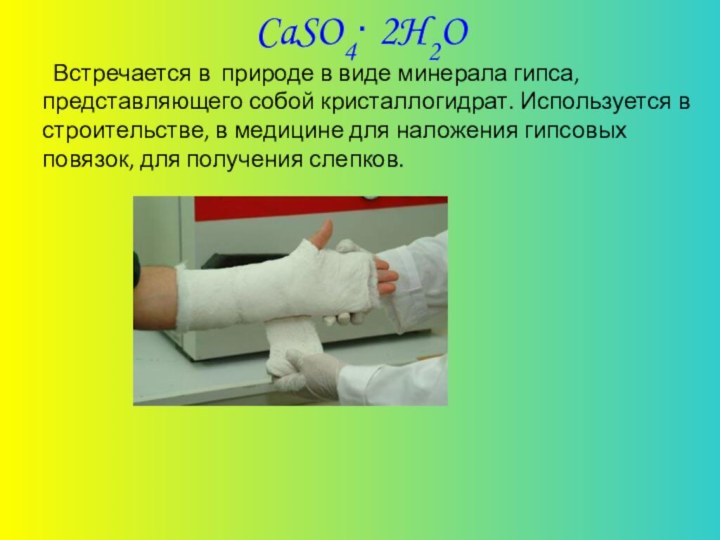
CaSO4∙ 2H2O
Встречается в
природе в виде минерала гипса, представляющего собой кристаллогидрат. Используется
в строительстве, в медицине для наложения гипсовых повязок, для получения слепков.
Слайд 15
MgCO3
Широко применяется в производстве
стекла, цемента, кирпича, а также в металлургии для перевода
пустой породы в шлак.