- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Алюминий – крылатый металл. Этому металлу принадлежит будущее
Содержание
- 2. «Открытие алюминия»В 1825 г. датский физик Ханс Кристиан
- 3. «Серебро из глины»Немецкий учёный Ф. Велер (1827
- 4. «Электролитический способ» В 1886 году
- 5. Траектория исследования:Формулировка проблемыВыдвижение гипотезыФормулировка цели и задач
- 6. Проблемный вопрос: «Алюминий – металл будущего?»
- 7. Характеристика алюминияAlХими-ческийэлемент Простое вещество
- 8. Характеристика алюминияПоложе-ние в ПССтроение атомаПримене- ниеAlХими-ческийэлементНахождение в природе Простое веществоФизич. св-ваХимич. св-ваПолуче-ниеИстория открытия
- 9. Цель и задачи исследования:Ответить на вопрос: «
- 10. Положение алюминия в ПСХЭ Д.И.Менделеева. Строение атома.Порядковый
- 11. Положение алюминия в ПСХЭ Д.И.Менделеева. Строение атома.Порядковый
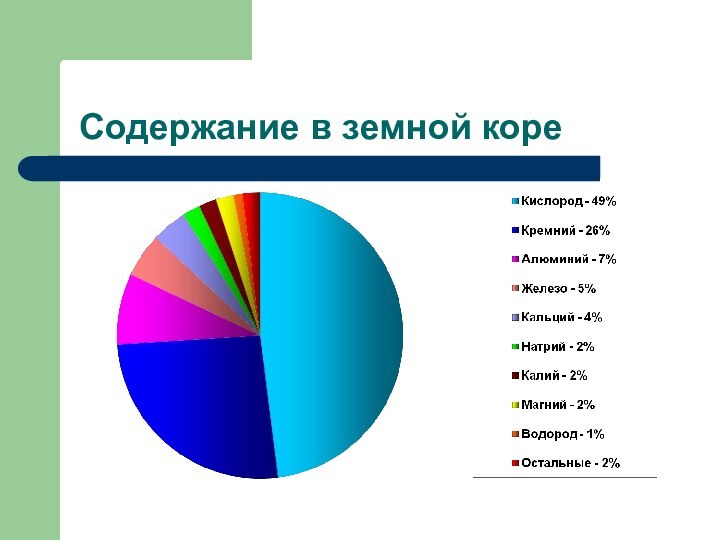
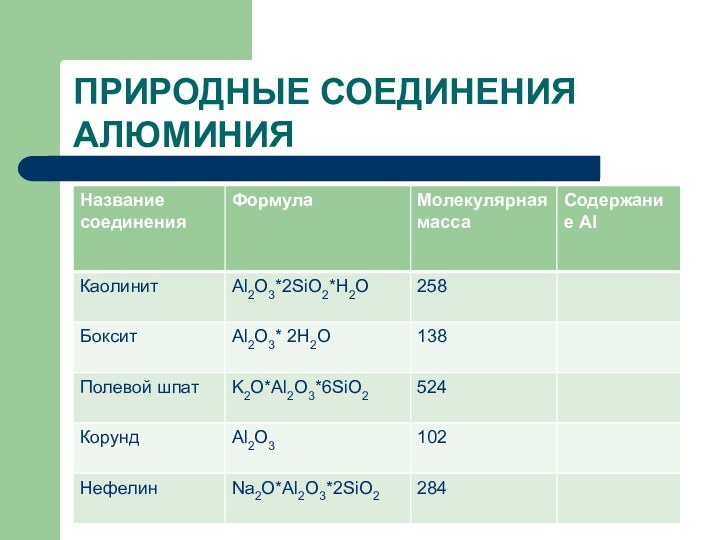
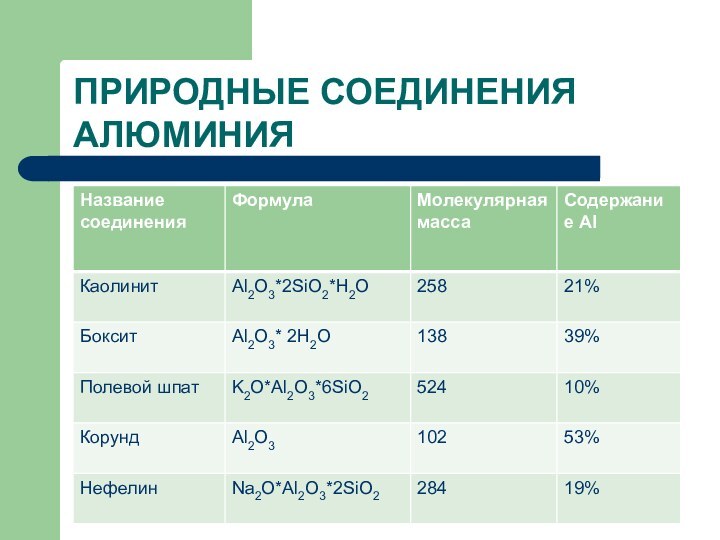
- 12. Содержание в земной коре
- 13. ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ
- 14. ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ
- 15. Физические свойства
- 16. В чём причины физических свойств алюминия? Металл
- 17. Химические свойстваC н е м е
- 19. 2Al + 6HCl = 2AlCl3 + 3H2↑2Al
- 20. Химические свойстваАлюминий - очень активный металл.В реакциях
- 21. Применение алюминия
- 22. Скачать презентацию
- 23. Похожие презентации
«Открытие алюминия»В 1825 г. датский физик Ханс Кристиан Эрстед был первым, кому удалось, подобно неизвестному мастеру Древнего Рима, получить относительно чистый алюминий; поскольку сообщение об этом было опубликовано в малоизвестном датском журнале и не сразу стало известно













Слайд 3
«Серебро из глины»
Немецкий учёный Ф. Велер (1827 г.)
получил алюминий при нагревании хлорида алюминия со щелочными металлами:
калием и натрием.А.Сент-Клер Девиль.
Впервые получил алюминий промышленным способом (1855г.).
Слайд 4
«Электролитический способ»
В 1886 году Поль
Эру французский инженер-химик запатентовал открытие способа получения алюминия
Чарльз Мартин
Холл
американский ученый
Слайд 5
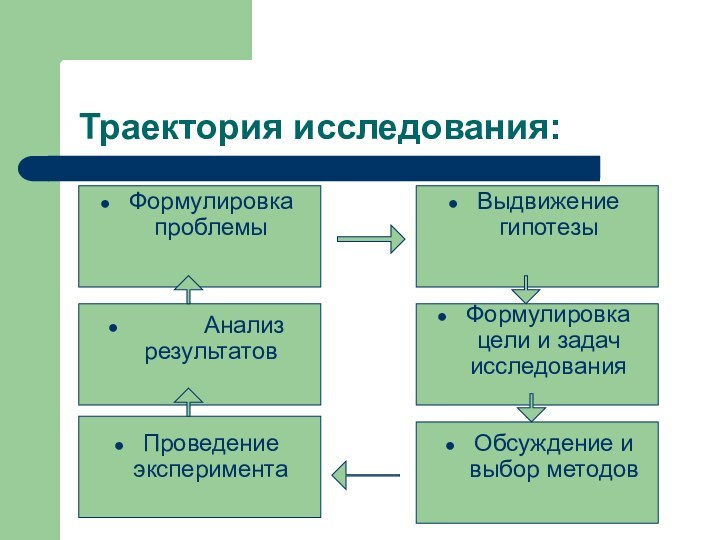
Траектория исследования:
Формулировка проблемы
Выдвижение гипотезы
Формулировка цели и задач исследования
Проведение
эксперимента
Обсуждение и выбор методов
Анализ
результатов
Слайд 8
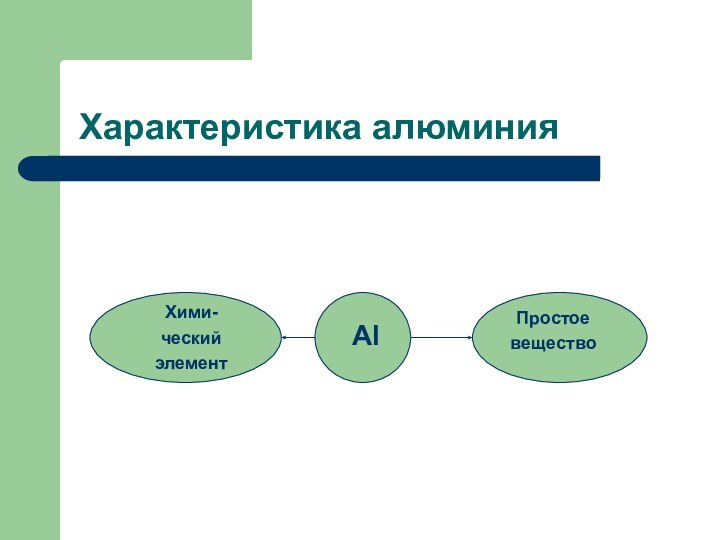
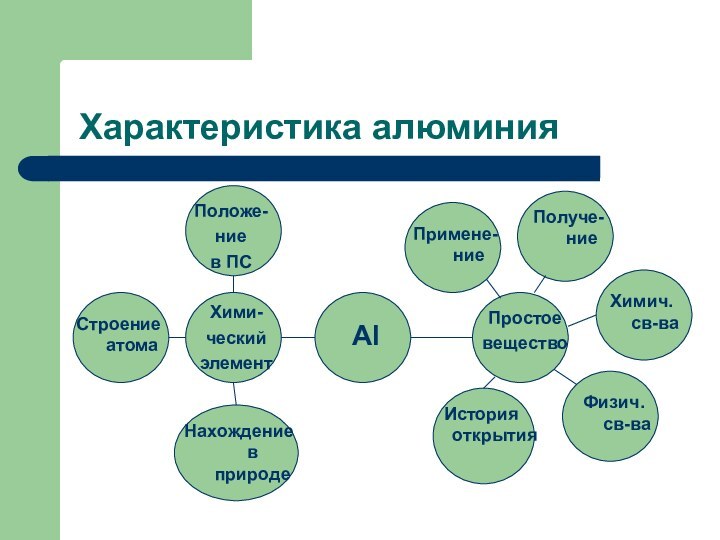
Характеристика алюминия
Положе-
ние
в ПС
Строение атома
Примене- ние
Al
Хими-
ческий
элемент
Нахождение в природе
Простое
вещество
Физич. св-ва
Химич. св-ва
Получе-ние
История открытия
Слайд 9
Цель и задачи исследования:
Ответить на вопрос: « Почему
алюминий называют металлом будущего?»
Дать характеристику элемента по его положению
в периодической системе химических элементов. На основе строения атома рассмотреть его физические и химические свойства, указать области применения алюминия.
Слайд 10
Положение алюминия в ПСХЭ Д.И.Менделеева. Строение атома.
Порядковый номер
13 .
Алюминий - элемент III группы,
главной подгруппы.Заряд ядра атома алюминия равен +13.
В ядре атома алюминия 13 протонов.
В ядре атома алюминия 14 нейтронов.
В атоме алюминия 13 электронов.
Атом алюминия имеет 3 энергетических уровня.
Электронная оболочка имеет строение 2е, 8е, 3е.
На внешнем уровне в атоме 3 электронов.
Степень окисления атома в соединениях равна +3 .
Простое вещество алюминий является металлом.
Слайд 11
Положение алюминия в ПСХЭ Д.И.Менделеева. Строение атома.
Порядковый номер
13 .
Алюминий - элемент III группы,
главной подгруппы.Заряд ядра атома алюминия равен +13.
В ядре атома алюминия 13 протонов.
В ядре атома алюминия 14 нейтронов.
В атоме алюминия 13 электронов.
Атом алюминия имеет 3 энергетических уровня.
Электронная оболочка имеет строение 2е, 8е, 3е.
На внешнем уровне в атоме 3 электронов.
Степень окисления атома в соединениях равна +3 .
Простое вещество алюминий является металлом.
Слайд 16
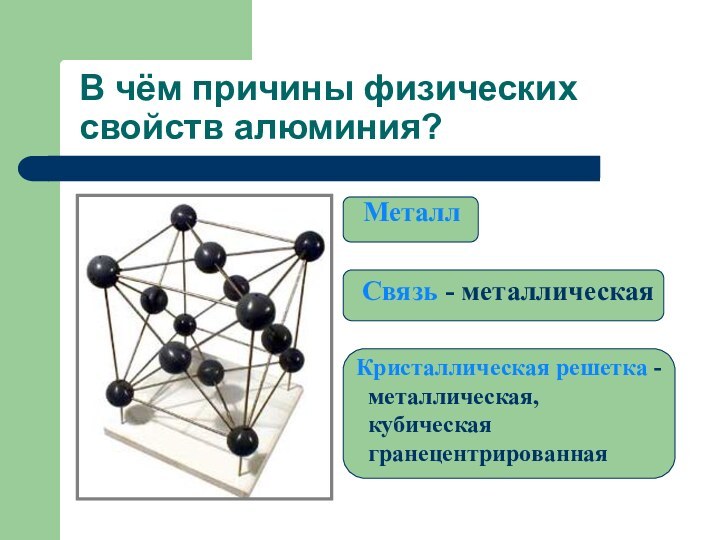
В чём причины физических свойств алюминия?
Металл
Связь - металлическая
Кристаллическая решетка -
металлическая,
кубическая гранецентрированная
Слайд 17
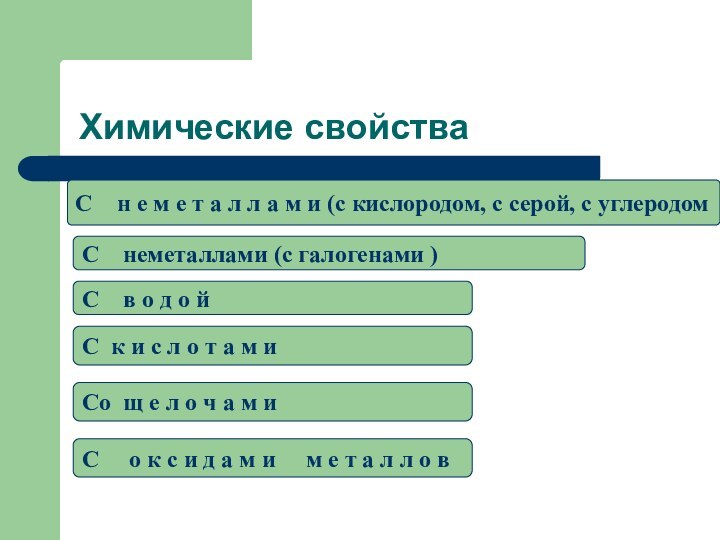
Химические свойства
C н е м е т
а л л а м и (c кислородом, с
серой, с углеродомC неметаллами (c галогенами )
C в о д о й
C к и с л о т а м и
Cо щ е л о ч а м и
C о к с и д а м и м е т а л л о в
Слайд 19
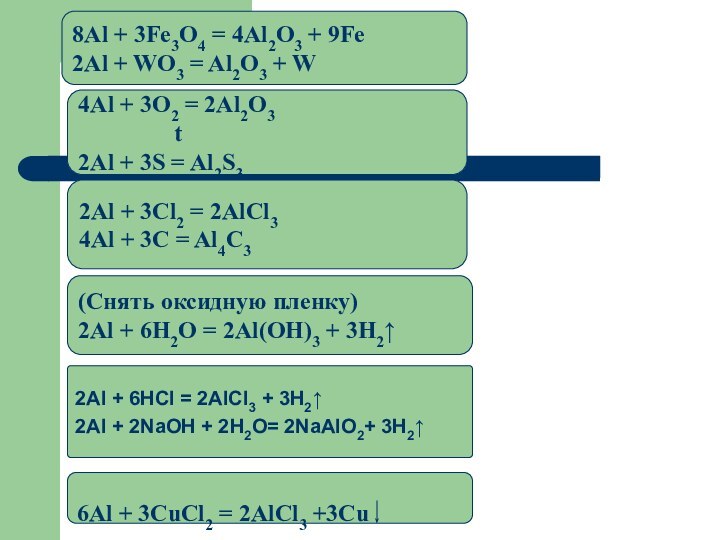
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al +
2NaOH + 2H2O= 2NaAlO2+ 3H2↑
(Снять оксидную пленку)
2Al + 6H2O
= 2Al(OH)3 + 3H2↑2Аl + 3Cl2 = 2AlCl3
4Al + 3C = Al4C3
4Аl + 3O2 = 2Al2O3
t
2Al + 3S = Al2S3
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + WO3 = Al2O3 + W
6Al + 3CuCl2 = 2AlCl3 +3Cu
Слайд 20
Химические свойства
Алюминий - очень активный металл.
В реакциях он
проявляет восстановительные свойства.
Реагирует с простыми веществами – неметаллами.
Восстанавливает металлы,
стоящие в электрохимическом ряду напряжения справа от него.« Пассивность» алюминия связана с наличием оксидной пленки.





























