- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Многообразие форм углерода и его соединений. Круговорот углерода в природе
Содержание
- 2. Цели:Представить для ознакомления различные виды природного и искусственного углерода и его соединений. Раскрыть особенности его круговорота.
- 3. Задачи:Ознакомиться со строением углерода;Выяснить, какие аллотропные видоизменения
- 4. Строение углерода (положение в периодической системе) Углерод
- 5. АллотропияПоговорим о простом веществе углерод, вернее, о
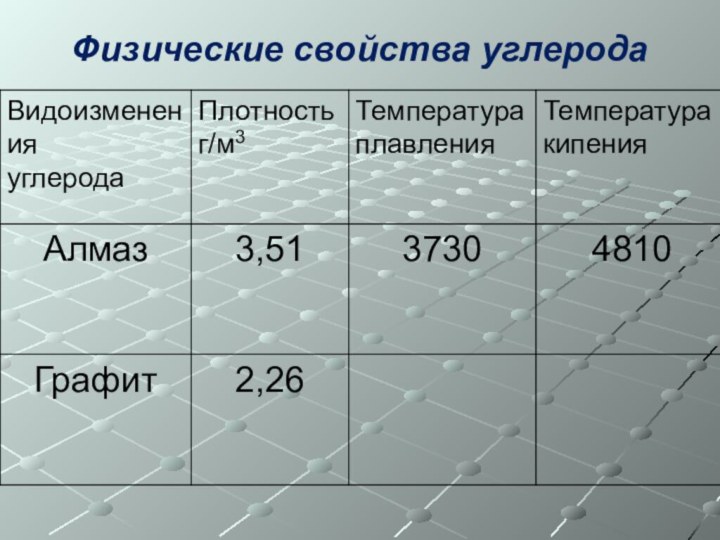
- 6. Аллотропия углерода. Его физические свойстваКакими же бывают
- 7. Графит непрозрачен, имеет темно-серый, почти черный цвет
- 8. Алмаз – самый твердый природный минерал ,не
- 9. Эти атомы размещены вокруг него на одинаковых расстояниях. Отшлифованный алмаз называют бриллиантом.Алмаз(бриллиант)
- 10. Наиболее ценные алмазы не имеют окраски. Камни,
- 11. Физические свойства углерода
- 12. Углерод может еще существовать в других формах,
- 13. Открытие новых форм углерода типа фуллеренов, нанотрубок
- 14. Соединения углерода1)Оксиды1.Окись углерода (СО)- моноксид или угарный
- 15. Как известно, атомы в соединениях стремятся иметь
- 16. СО-сильный восстановитель. Его используют в качестве газообразного
- 17. 2.Диоксид углерода(СО2) - углекислый газ. Образуется в
- 18. Так же СО2 встречается и в твердом
- 19. 2)Кислоты Угольная кислота(Н2СО3).Структурная фомула:Н
- 20. Угольную кислоту получают растворением оксида углерода(СО2)
- 21. Такая реакция происходит при получении газированной воды.
- 22. Углекислота в свободном виде не существует, так
- 23. 3)СолиКарбонат кальция - самая распространенная соль. Углекислота
- 24. Скелеты корненожек состоят из углекислого кальция, и
- 25. Из карбоната кальция образованы также створки раковины
- 26. 1.Устрица 2.Морской еж 3.Известняк с остатками кораллов 4.Археоциатовый известняк
- 27. Итак, в свободном состоянии углерод встречается в
- 28. Применение соединений углерода в промышленностиУглерод применяется как:Горючее
- 29. Растворители для лаковЧетыреххлористый углерод для огнетушителейБензин для моторов
- 30. Круговорот углеродаУглерод достаточно широко распространен в природе.
- 31. Газообразные соединения углерода выделяются в процессе вулканической деятельности.CО2
- 32. В виде различных карбонатов углерод содержится в отложениях (осадках), в известняках и в почве. СO2
- 33. Углерод сконцентрирован в природном топливе (уголь, нефть и природный газ).СО2
- 34. В виде растворенных углекислых солей, диоксида и других соединений углерод содержится в воде. CО2
- 35. Углерод является основным составным элементом всех органических
- 36. Подобным же образом этот газ выделяется в
- 37. Соединения углерода(органические вещества) переносятся водой и становятся
- 38. СО2Грибы, бактерии (разложение)
- 39. Скачать презентацию
- 40. Похожие презентации
Цели:Представить для ознакомления различные виды природного и искусственного углерода и его соединений. Раскрыть особенности его круговорота.




































Слайд 2
Цели:
Представить для ознакомления различные виды природного и искусственного
углерода и его соединений. Раскрыть особенности его круговорота.
Слайд 3
Задачи:
Ознакомиться со строением углерода;
Выяснить, какие аллотропные видоизменения углерода
существуют;
В каких соединениях встречается углерод;
Как применяет его человек;
Круговорот углерода
в природе;Роль углерода в жизни человека.
Слайд 4
Строение углерода (положение в периодической системе)
Углерод –
элемент, находящийся в IV-ой группе главной подгруппы Периодической системы
Д.И.Менделеева. Его молекулярная масса приблизительно равна 12.
Слайд 5
Аллотропия
Поговорим о простом веществе углерод, вернее, о тех
простых веществах, которые могут образовать атомы углерода. Такое явление
и называют аллотропией.
Слайд 6
Аллотропия углерода. Его физические свойства
Какими же бывают аллотропные
видоизменения углерода? У углерода 2 основных аллотропа :
Углерод
Алмаз Графит
Слайд 7 Графит непрозрачен, имеет темно-серый, почти черный цвет с
металлическим блеском. Хорошо проводит электрический ток. Это мягкий минерал
из которого изготавливают грифели для карандашей, токосъемники электрического транспорта. Мельчайшие кристаллики графита образуют древесный уголь.Кристаллическая решетка графита
Слайд 8 Алмаз – самый твердый природный минерал ,не проводит
электрического тока. Особая твердость алмаза обусловлена тем, что в
его кристаллической решетке, каждый атом углерода связан с четырьмя другими атомами.Кристаллическая решетка алмаза
Слайд 9 Эти атомы размещены вокруг него на одинаковых расстояниях.
Отшлифованный алмаз называют бриллиантом.
Алмаз(бриллиант)
Слайд 10 Наиболее ценные алмазы не имеют окраски. Камни, имеющие
коэффициент преломления такой же, как у воды, называются алмазами
чистой воды.Бриллианты
Слайд 12 Углерод может еще существовать в других формах, к
которым относятся древесный уголь, кокс и газовая сажа. Все
они являются неочищенными формами углерода, иногда их называют аморфными формами, а раньше считали, что это третье аллотропное видоизменение углерода.Слайд 13 Открытие новых форм углерода типа фуллеренов, нанотрубок и
наночастиц, позволило по новому взглянуть на химию углерода. Углеродные
наноструктуры обладают высокой прочностью, электро- и теплопроводимостью, низким коэффициентом термического расширения.Нанотрубки
Слайд 14
Соединения углерода
1)Оксиды
1.Окись углерода (СО)- моноксид или угарный газ.
Ядовитый бесцветный газ, немного легче воздуха. Образуется при неполном
сгорании топлива, например, в печах двигателя. Из-за этого газа люди могут отравиться и умереть(угоревшие люди).Слайд 15 Как известно, атомы в соединениях стремятся иметь восьмиэлектронную
структуру. Третья ковалентная связь, как предполагают, донорно-акцепторная, где кислород-донор(одну
из свободных электронных пар дает углероду).С О
C О
Слайд 16 СО-сильный восстановитель. Его используют в качестве газообразного топлива,
во многих реакциях органического синтеза, а главное, в металлургии
при получении металлов из руд.Слайд 17 2.Диоксид углерода(СО2) - углекислый газ. Образуется в природе
при окислении органических веществ. В больших количествах он выделяется
из вулканических трещин и из вод минеральных источников. А главное, мы его выдыхаем.Слайд 18 Так же СО2 встречается и в твердом агрегатном
состоянии-сухой лед.
Структурная формула:
О
C
О
Все связи ковалентные полярные.
Слайд 19
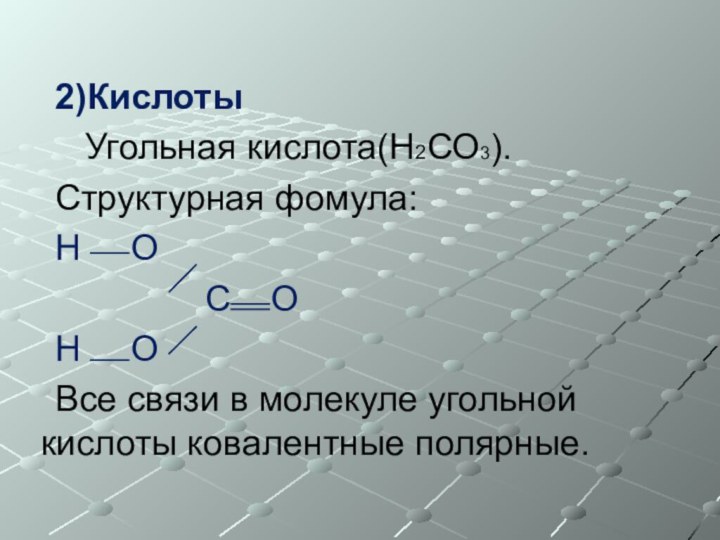
2)Кислоты
Угольная кислота(Н2СО3).
Структурная фомула:
Н О
С
ОН О
Все связи в молекуле угольной кислоты ковалентные полярные.
Слайд 20 Угольную кислоту получают растворением оксида углерода(СО2) в
воде.
СО2 Н2О Н2СО3
Так
как Н2СО3 очень непрочное соединение, то эта реакция обратима.[5]
Слайд 21 Такая реакция происходит при получении газированной воды. В
результате этого же процесса в природе образуются минеральные воды,
например «Нарзан», в которых кроме СО2, содержатся различные соли.Слайд 22 Углекислота в свободном виде не существует, так как
она разлагается на воду и углекислый газ. Она незначительно
диссоциирует на ионы и поэтому является очень слабой кислотой. Раствор углекислоты входит в состав разных напитков.Газированная Аква-Минерале
Слайд 23
3)Соли
Карбонат кальция - самая распространенная соль. Углекислота сохранилась
в пластах земли в виде мела, мрамора и известняков
(СаСО3). В них содержатся микроскопические ископаемые организмы. Это остатки известковых скелетов микроскопических организмов- корненожек.Слайд 24 Скелеты корненожек состоят из углекислого кальция, и после
смерти из них образуются горные породы. Скелеты многих других
живых организмов состоят из карбоната кальция. Они также встречаются в известняках.Известняк
Слайд 25 Из карбоната кальция образованы также створки раковины моллюсков.
Жемчуг - тоже карбонат кальция.
Браслет из перламутра
Цепочка из жемчуга
Слайд 27 Итак, в свободном состоянии углерод встречается в виде
алмаза и графита, в виде многочисленных соединений. Соединения углерода
очень распространены. Кроме ископаемого угля, в недрах земли, находятся большие скопления нефти.
Слайд 28
Применение соединений углерода в промышленности
Углерод применяется как:
Горючее для
двигателей
Сырье для получения взрывчатых веществ
Искусственные жиры для получения мыла
Смазка
для машинСырье для производства каучука
Ацетилен для сварки и рубки металлов
Сырье для анилиновых красителей
Слайд 30
Круговорот углерода
Углерод достаточно широко распространен в природе. В
атмосфере Земли содержится приблизительно 0,34% СО2. В природе происходит
непрерывный процесс разрушения одних углеродосодержащих веществ и образования других.Слайд 32 В виде различных карбонатов углерод содержится в отложениях
(осадках), в известняках и в почве.
СO2
Слайд 34 В виде растворенных углекислых солей, диоксида и других
соединений углерод содержится в воде.
CО2
Слайд 35 Углерод является основным составным элементом всех органических веществ.
В виде углекислого газа из атмосферы в процессе фотосинтеза
он попадает в тела растений.В составе различных органических веществ проходит по пищевым цепям и в процессе дыхания всех организмов вновь выделяется в атмосферу в виде СО2.
CО2
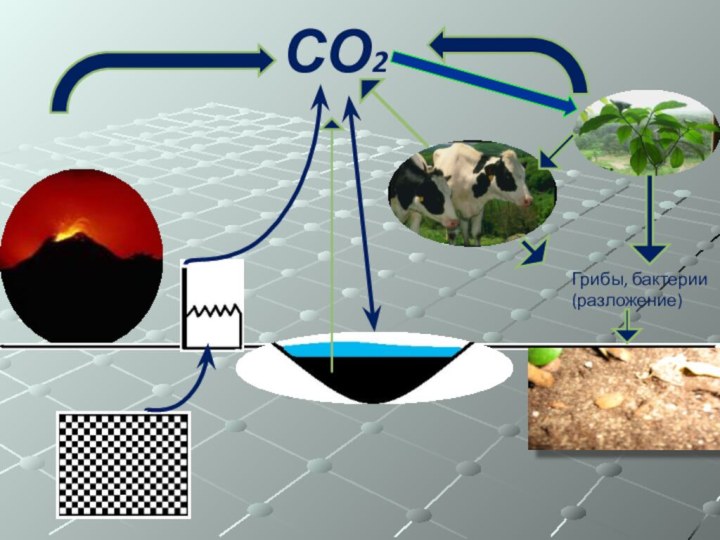
Слайд 36 Подобным же образом этот газ выделяется в процессе
разложения –тления, гниения. Это –биологические процессы. В результате схема
биологических процессов выглядит так:СО2
Грибы, бактерии (разложение)
Слайд 37 Соединения углерода(органические вещества) переносятся водой и становятся составной
частью осадков на дне моря, которые благодаря газообразовательным процессам
вновь возвращаются на поверхность, а затем выветриваются.СО2





























