Слайд 2
Это вещество было описано арабским химиком в VIII
веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик
мудрости», а с ХV века это вещество добывалось для производственных целей
- Благодаря этому веществу русский учёный В.Ф. Петрушевский в 1866 году впервые получил динамит.
Это вещество является компонентом ракетного топлива, его использовали для двигателя первого в мире советского реактивного самолёта БИ – 1
Это вещество – прародитель большинства взрывчатых веществ (например, тротила, или тола)
- Это вещество в смеси с соляной кислотой растворяет платину и золото, признанное «царём» металлов. Сама смесь, состоящая из 1-ого объёма этого вещества и 3-ёх объёмов соляной кислоты, называется «царской водкой».
Слайд 3
Её величество
Азотная кислота
Яконюк Вера Сергеевна
учитель химии МОУ Знаменская СОШ
Урок химии 9класс
Слайд 4
СОДЕРЖАНИЕ:
Историческая справка
Строение
Получение.Лабороторный способ
Промышленный способ
Физические свойства
Химические свойства.Общие с другими
кислотами
Химические свойства.Специфические
Таблица
Применение
Слайд 5
Впервые азотную кислоту получили алхимики, нагревая смесь селитры
и железного купороса:
4KNO3 + 2(FeSO4 · 7H2O) (t°) →
Fe2O3 + 2K2SO4 + 2HNO3↑ + NO2↑ + 13H2O
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
KNO3 + H2SO4(конц.) (t°) → KHSO4 + HNO3↑
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды
Историческая справка
Слайд 6
Опытным путем доказано, что двойная связь
равномерно распределена между двумя атомами кислорода. Степень окисления азота
в азотной кислоте равна +5, а валентность (обратите внимание) равна четырем, ибо имеются только четыре общие электронные пары. Связь – ковалентная полярная.
Кристаллическая решетка – молекулярная
Строение
Слайд 7
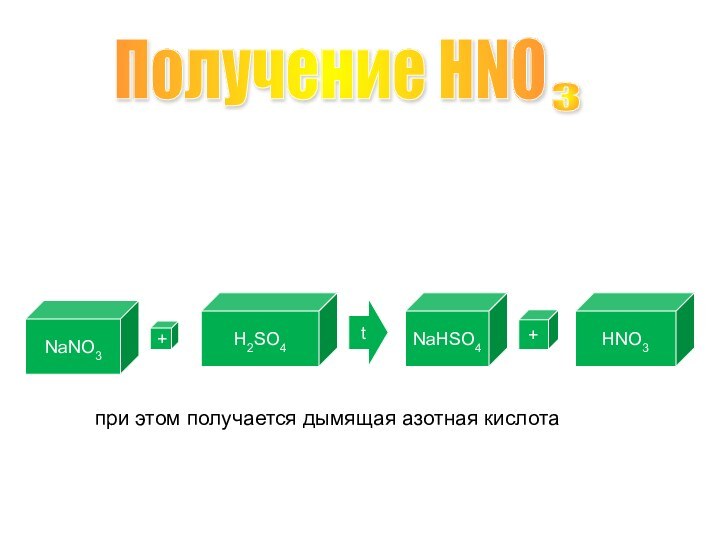
Получение HNO
3
Лабороторный способ получения:
NaNO3
+
H2SO4
t
NaHSO4
+
HNO3
при этом получается дымящая азотная кислота
Слайд 8
Промышленный способ
1. Окисления аммиaка в NO в присутствии
платино-родиевого
катализатора:
4NH3 + 5O2 = 4NO + 6H2O
3. Поглощения
NO2 водой в присутствии кислорода:
4NO2 + 2H2O + O2= 4HNO3
Массовая доля HNO3 составляет около 60%
2. Окисления NO в NO2 на холоду под давлением (10 ат):
2NO + O2 = 2NO2
Слайд 9
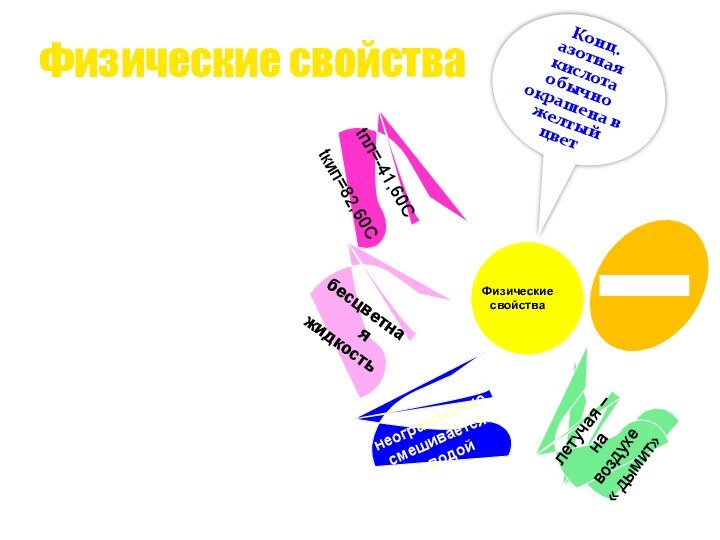
Физические свойства
Физические
свойства
бесцветная
жидкость
tпл=-41,60C
tкип=82,60C
неограниченно
смешивается
с
водой
летучая –
на воздухе
« дымит»
Конц. азотная
кислота обычно окрашена в желтый цвет,
Слайд 10
Исследования (задания по группам):
(Повторение ПТБ!).
1 группа: провести реакцию раствора азотной кислоты и
оксида
меди (II), записать уравнение реакции, определить ее тип
2 группа: получить нерастворимое основание Cu(OH)2;
провести реакцию раствора азотной кислоты и гидроксида
меди (II); записать уравнение реакции, определить ее тип
3 группа: провести реакцию растворов азотной кислоты и
карбоната натрия, записать уравнение реакции, определить
ее тип
Для всех: провести реакцию растворов азотной кислоты и
Гидроксида калияв присутствии фенолфталеина,
записать уравнение реакции, определить ее тип
Слайд 11
Группа №1 CuO + 2 HNO3 =
Cu(NO3)2 + H2O -
реакция ионного обмена, необратимая
CuO + 2H+ + 2 NO3- = Cu2+ + 2 NO3- + H2O
CuO + 2H+ = Cu2+ + H2O
Группа №2 CuCl2 + 2 NaOH = Cu(OH)2↓ + 2 NaCl
(получение нерастворимого основания)
Cu(OH)2 ↓+ 2 HNO3 = Cu(NO3)2 + 2 H2O -
реакция ионного обмена, необратимая
Cu(OH)2 ↓ + 2H+ + 2 NO3- = Cu2+ + 2 NO3- + 2 H2O
Cu(OH)2↓ + 2H+ = Cu2+ + 2 H2O
Признак реакции – растворение голубого осадка Cu(OH)2
Группа №3 2 HNO3 + Na2CO3 = 2 NaNO3 + H2O + CO2 ↑ -
реакция ионного обмена, необратимая
2 H+ + 2NO3- + 2 Na+ + CO3 2- = 2 Na+ +NO3- + H2O + CO2↑
2 H+ + CO3 2- = H2O + CO2 ↑
Признак реакции – характерное «вскипание».
Слайд 12
Общие с другими кислотами:
1. Сильный электролит, хорошо
диссоциируют на ионы
HNO3 -> H+ +NO3-
Изменяет окраску
индикатора.
2. Реагирует с основными оксидами
СuO+2 HNO3 -> Cu(NO3)2 +H2O
3. Реагирует с основаниями
HNO3 + KOH -> KNO3 + H2O
4. Реагирует с солями более летучих кислот
Na2CO3 + 2HNO3 -> 2NaNO3 +H2CO3
cухая / \
H2O CO2
При нагревании и под
действием света разлагается
4HNO3 = 2H2O + 4NO2 + O2
Реагирует с неметаллами
С + 4HNO3(конц.) = CO2↑ + 4NO2↑ + 2H2O
S+6HNO3(60%) =H2SO4+6NO2↑+ 2H2O
S+2HNO3(40%) =H2SO4+2NO ↑
P+5HNO3(60%) =H3PO4+5NO2↑+ H2O
P+ 5HNO3(30%)+2H2O =3H3PO4+5NO ↑
NO неMe + HNO3 NO2
.
АЗОТНАЯ КИСЛОТА ОКИСЛЯЕТ НЕМЕТАЛЛЫ
Слайд 14
Взаимодействие азотной кислоты с металлами изучено довольно хорошо,

т.к. конц. HNO3 используется в качестве окислителя ракетного топлива.
Смысл заключается в том, что продукты реакции зависят от двух факторов:
1) концентрация азотной кислоты;
2) активность металла
Комбинацией этих двух параметров и определяется состав продуктов реакции.
Что может быть?
а) металл может вступать в реакцию, а может не вступать (не реагировать вообще, пассивироваться);
б) состав газов смешанный (как правило выделяется не один газообразный продукт, а смесь газов, иногда какой-то газ преобладает над другими);
в) обычно водород в этих процессах не выделяется (есть исключение, когда на практике доказывается, что Mn + разб. HNO3 действительно выделяется газ водород)
Главное правило: Чем активнее металл и чем разбавленнее азотная кислота, тем глубже идёт восстановление азотной кислоты (крайний вариант - восстановление до амммиака NH3, точнее до NH4NO3 ; здесь процесс воссстановления N{+5} + 8e ----> N{-3} ). Возможны промежуточные варианты восстановления до NO2, NO, N2O, N2
Общая схема процесса:
HNO3 + Me ---> соль азотной кислоты (нитрат) + продукт восстановления азотной кислоты + H2O
Слайд 15
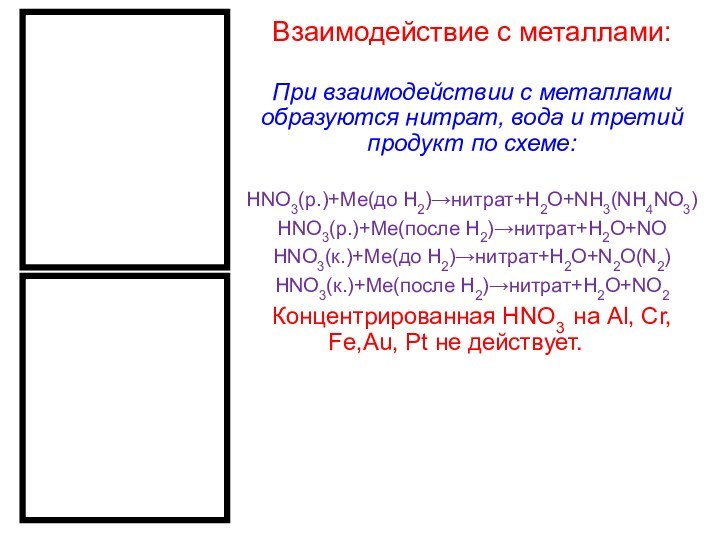
Взаимодействие с металлами:
При взаимодействии с металлами образуются нитрат,
вода и третий продукт по схеме:
HNO3(р.)+Me(до H2)→нитрат+H2O+NH3(NH4NO3)
HNO3(р.)+Me(после H2)→нитрат+H2O+NO
HNO3(к.)+Me(до H2)→нитрат+H2O+N2O(N2)
HNO3(к.)+Me(после
H2)→нитрат+H2O+NO2
Концентрированная HNO3 на Al, Cr, Fe,Au, Pt не действует.
Слайд 16
P.S концентрированная HNO3 >60%
разбавленная HNO3
= 30-60%
очень разбавленная HNO3 < 30%
на
холоде: железо, хром, алюминий пассивирует
Взаимодействие с металлами
Слайд 17
Применение Азотной кислоты:
- производство азотных и комбинированных
удобрений,
-взрывчатых веществ (тринитротолуола и др.),
-органических красителей.
-как
окислитель ракетного топлива.
- В металлургии Азотная кислота применяют для травления и растворения металлов, а также для разделения золота применяют для травления и растворения металлов, а также для разделения золота и серебра.
Слайд 18
Действие на организм
Вдыхание паров Азотная кислота приводит
к отравлению, попадание Азотная кислота (особенно концентрированной) на кожу
вызывает ожоги. Предельно допустимое содержание Азотная кислота в воздухе промышленных помещений равно 50 мг/м3 в пересчёте на N2O5 Концентрированная Азотная кислота при соприкосновении с органическими веществами
вызывает пожары и взрывы
Слайд 19
Проверь себя:
Степень окисления азота в HNO3 а)-3 б)0
в)+5 г)+4
При хранении на свету HNO3 а) краснеет
б) желтеет в) остается бесцветной
При взаимодействии с металлами азотная кислота является: а)окислителем, б)восстановителем, в)и тем, и другим.
Азотная кислота в растворе не реагирует с веществом, формула которого:
а) CO2 ; б) NaOH; в) Al(OH)3 ; г) NH3 .
Царская водка- это а)концентрированный спирт б)3 объема HCl и 1 объем HNO3
в) концентрированная азотная кислота
Слайд 21
вывод:
1. Азотной кислоте характерны общие свойства
кислот:
реакция на индикатор, взаимодействие с оксидами металлов,
гидроксидами,
солями более слабых кислот
обусловленные наличием в молекулах иона Н+;
2. Сильные окислительные свойства азотной кислоты
обусловлены строением ее молекулы;
При ее взаимодействии с металлами
никогда не образуется водород,
а образуются нитраты, оксиды азота
или другие его соединения (азот, нитрат аммония)
и вода в зависимости от концентрации кислоты и активности металла;
3. Сильные окислительные способности HNO3
широко применяются для получения различных важных
продуктов народного хозяйства (удобрения, лекарства, пластики и т.д.)
Слайд 22
Домашнее задание:
§26 упр 4,5 Творческое задание
–презентация история открытия азотной кислоты. Применение азотной кислоты