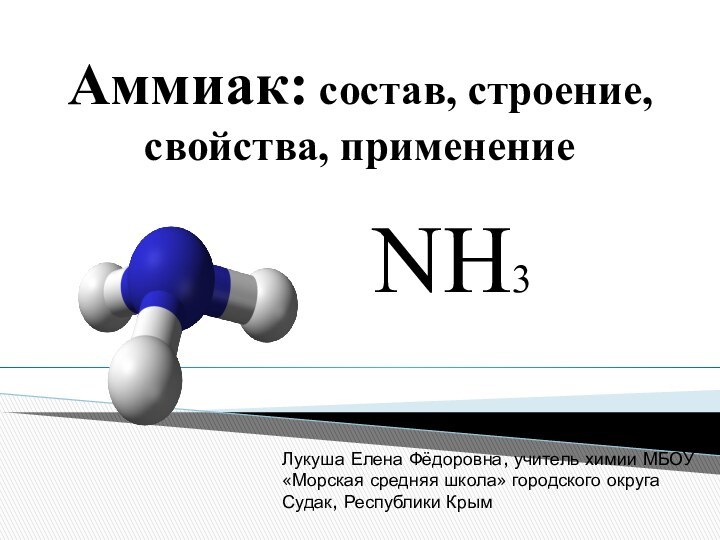
Аммона в Северной Африке, находящемуся на перекрестке караванных путей.
В очень жарком климате мочевина (NH2)2CO, разлагается особенно быстро.
Одним из основных продуктов разложения и является аммиак.
Оазис «Аммон»
в Северной Африке
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть























Оазис «Аммон»
в Северной Африке
Бог Аммон в образе барана
1781-1852 г.