- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Определение солей аммония
Содержание
- 2. УРОК-ПРЕЗЕНТАЦИЯ «СОЛИ АММОНИЯ» Цель урока:Показать
- 3. ХОД УРОКА:
- 4. ч Третья группа свойств солей аммония – это
- 6. Получение аммония Он образуется в результате
- 7. Соли аммония Катион аммония NH4+ играет
- 8. Получение солей аммония Соли
- 9. Физические свойства солей аммония.Все соли аммония –
- 10. Химические свойства солей аммония.Имеют все свойства солей.Хлорид
- 11. Применение солей аммония:Производство минеральных удобренийПроизводство азотной кислотыПолучение
- 12. Скачать презентацию
- 13. Похожие презентации
УРОК-ПРЕЗЕНТАЦИЯ «СОЛИ АММОНИЯ» Цель урока:Показать учащимся, что все соли аммония получают взаимодействием аммиака и соответствующих кислот , обладают всеми свойствами солей. Обратить внимание на качественную реакцию с щелочами , в результате - выделяется аммиак











Слайд 3
ХОД УРОКА:
Объяснение нового материала.
1.Физические свойства солей аммония:
Все соли аммония - твёрдые кристаллические вещества, хорошо растворимые в воде, могут иметь различную окраску.
2.Химические свойства:
а) Они обладают всеми свойствами солей, т.к. есть кислотный остаток и по кислотному остатку проявляют качественные реакции на анионы.
б) Все соли аммония реагируют со щелочами при нагревании с выделением газа- NH3
Пример: NH4CL + NaOH = NH3 + H2O + NaCL
ИЛИ В СОКРАЩЁННОМ ВИДЕ:
NH+4 + OH - = NH3 + H2O
Эта реакция является качественной на все соли аммония!
Слайд 4
ч
Третья группа свойств солей аммония – это их
способность разлагаться при нагревании с выделением газообразного аммиака.
НАПРИМЕР: NH4 CL = NH3 + HCLПОСЛЕ ИЗУЧЕНИЯ СВОЙСТВ СОЛЕЙ АММОНИЯ ИДЕТ ПРОСМОТР ПРЕЗЕНТАЦИИ, ПОДГОТОВЛЕННОЙ УЧЕНИКОМ 9А КЛАССА Жауровым Максимом
Слайд 5
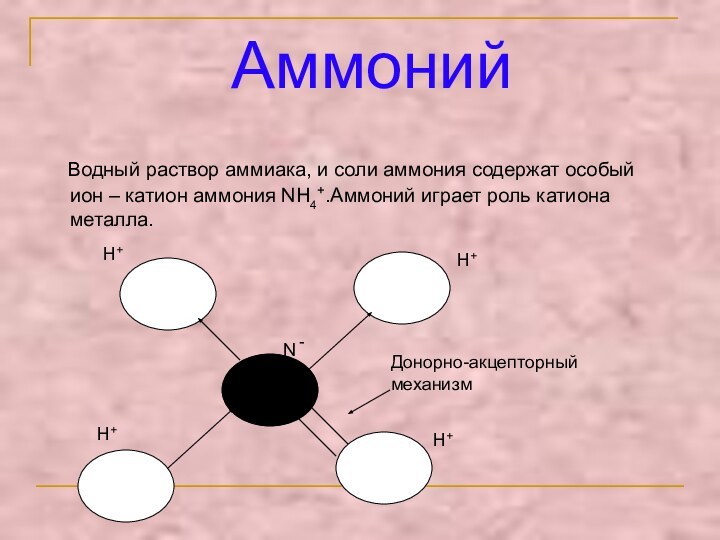
Аммоний
Водный раствор аммиака, и соли аммония содержат особый
ион – катион аммония NH4+.Аммоний играет роль катиона металла.N -
H+
H+
H+
H+
Донорно-акцепторный механизм
Слайд 6
Получение аммония
Он образуется в результате того,
что атом азота имеет свободную электронную пару, за счёт
которой формируется еще одна ковалентная связь.H H
H N : H+ H N H
H H
Слайд 7
Соли аммония
Катион аммония NH4+ играет роль
катиона металла и он образует с кислотными остатками соли:
NH4NO3 – нитрат аммония или аммиачная селитра(NH4)2SO4 – сульфат аммония
NH4CL – хлорид аммония
Слайд 8
Получение солей аммония
Соли аммония
получают при взаимодействии аммиака с кислотами
Пример:2NH3 + H2SO4 = (NH4)2SO4
Слайд 9
Физические свойства солей аммония.
Все соли аммония – твёрдые
кристаллические вещества
Хорошо растворимые в воде
Практически все свойства схожи со
свойствами щелочных металлов, в первую очередь на соли калия (К+)Все соли аммония различно окрашены
Слайд 10
Химические свойства солей аммония.
Имеют все свойства солей.
Хлорид и
сульфат аммония реагирует соответственно с нитратом серебра
NH4CL + AgNO3 NH4NO3 + AgCLКарбонат аммония взаимодействует с кислотами. (NH4)2CO3 + 2HCL 2NH4CL + H2O + CO2
Соли аммония реагируют с щелочами при нагревании. NH4CL + NaOH = NH3 + H2O + NaCL
Качественная реакция (разложения) NH4CL = NH3 + HCL