- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Урок Теория электролитической диссоциации
Содержание
- 3. Майкл Фараде́й (22 сентября 1791, Лондон —
- 6. Для объяснения электропроводности растворов и расплавов солей,
- 7. Представления о диссоциации электролитов получили развитие в
- 8. Основные положения теории ТЭД
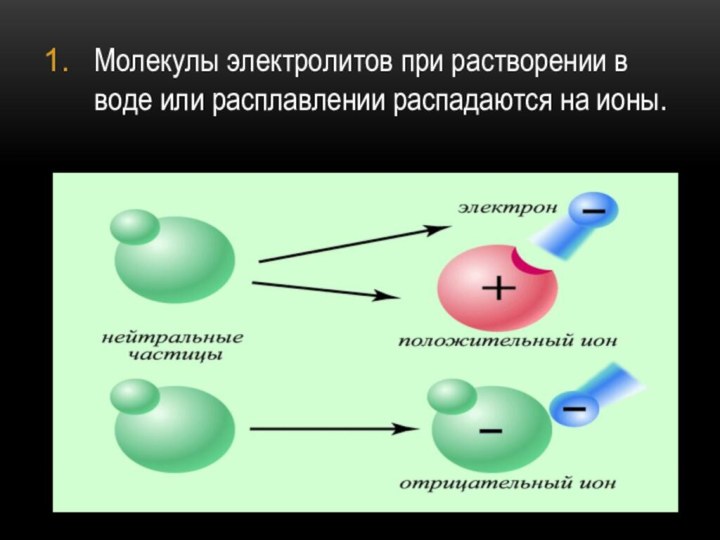
- 9. Молекулы электролитов при растворении в воде или расплавлении распадаются на ионы.
- 11. 2. Причиной диссоциации электролита в водном растворе
- 12. Механизм электролитической диссоциации
- 14. 3. Под действием электрического тока положительно заряженные
- 16. Степень электролитической диссоциации. Сильные и слабые электролиты.
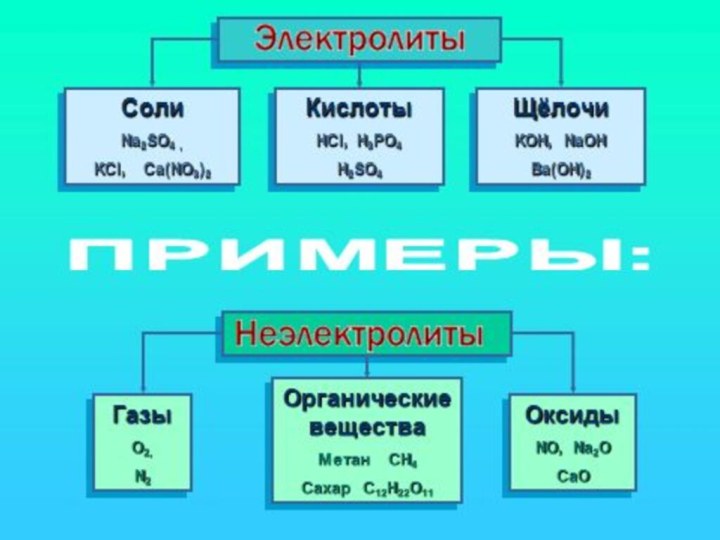
- 21. Классы неорганических веществ с точки зрения ТЭД
- 22. КислотыСложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металлов и кислотных остатков.
- 24. Классификация кислот по числу атомов водорода в
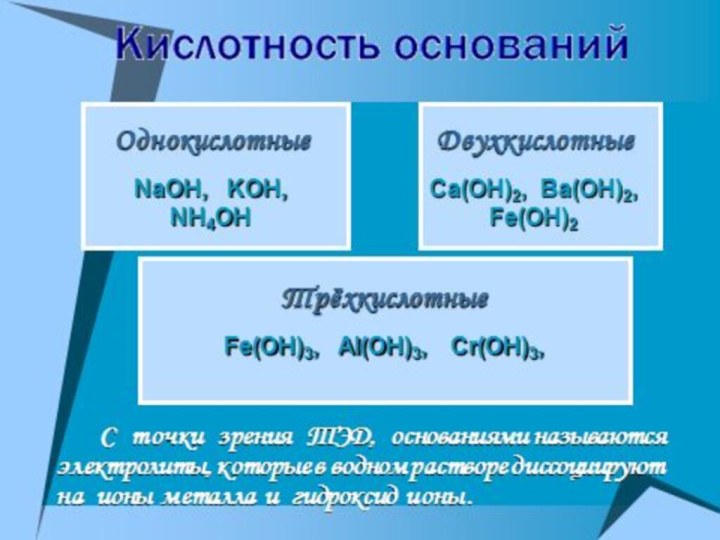
- 27. ОснованияЭто сложные вещества, состоящие из ионнов металлов и гидроксид-ионов
- 30. СолиСложные вещества, состоящие из ионов металлов и кислотного остатка
- 34. Условия протекания реакции ионного обмена Реакции в
- 35. Проверь свои знанияЗадание 1*Вещества, растворы которых проводят
- 38. Скачать презентацию
- 39. Похожие презентации
Майкл Фараде́й (22 сентября 1791, Лондон — 25 августа 1867, Лондон) — английский физик-экспериментатор и химик. В первой половине 19 в. М. Фарадей ввел понятие об электролитах и неэлектролитах.



































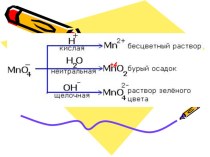
Слайд 6 Для объяснения электропроводности растворов и расплавов солей, кислот,
оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации
(1887 г.). Процесс появления гидратированных ионов в водном растворе называется электролитической диссоциацией (С. Аррениус, 1887 г.) .Слайд 7 Представления о диссоциации электролитов получили развитие в работах
русских химиков И.А.Каблукова и В.А. Кистяковского. Они применили к объяснению
процесса электролитической диссоциации химическую теорию растворов Д.И. Менделеева.Слайд 11 2. Причиной диссоциации электролита в водном растворе является
его гидратация, т.е. взаимодействие электролита с молекулами воды и
разрыв химической связи в нем.Диссоциация – процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (диссоциация, ионизация) и соединение ионов в молекулы (ассоциация, моляризация)
Слайд 14 3. Под действием электрического тока положительно заряженные ионы
движутся к отрицательному полюсу источника тока – катоду, поэтому
их называют катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока – аноду, поэтому их называют анионами.
Слайд 22
Кислоты
Сложные вещества, молекулы которых состоят из атомов водорода,
способных замещаться на атомы металлов и кислотных остатков.
Слайд 34
Условия протекания реакции ионного обмена
Реакции в растворах электролитов
протекают до конца если:
Образуется или растворяется осадок;
Выделяется газ;
Образуется малодиссоциирующее
вещество (например Н2О)
Слайд 35
Проверь свои знания
Задание 1
*Вещества, растворы которых проводят электрический
ток, называют …
*Процесс распада электролита на ионы называют
… *Вещества, растворы которых не проводят электрический ток, называют …
*Отношение числа частиц, распавшихся на ионы, к общему числу растворенных частиц называют …