- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Белки - 4. Обмен сложных белков. Нуклеопротеиды
Содержание
- 2. Содержание:1.Переваривание и всасывание нуклеопротеидов2.Метаболизм пуринов и пиримидинов3.Репликация
- 3. Сложные белки- нуклеопротеиды содержат в
- 4. Дезоксирибонуклеопротеид представляет собой хроматин, в котором молекула ДНК связывает между собой гистоны
- 6. Переваривание и всасывание нуклеопротеидов Как известно, большая
- 7. Поступающие с пищей нуклеопротеины разрушается панкреатическими ферментами,
- 8. Этому способствует кислая среда желудка.
- 9. В кишечнике, как правило, образуются 3'-фосфат нуклеотиды,
- 10. Нуклеозиды, которые обычно
- 13. В клетках некоторых тканей, в
- 14. Рибоза 1-Ф и рибоза 5-Ф в
- 15. Пуриновые и пиримидиновые основания также
- 16. В клетке существует интенсивно обмениваемый
- 17. Тканевые пурины и пиримидины, которые
- 18. Используется лишь очень небольшое количество пищевых пуринов, а основная масса поступивших с пищей пуринов распадается.
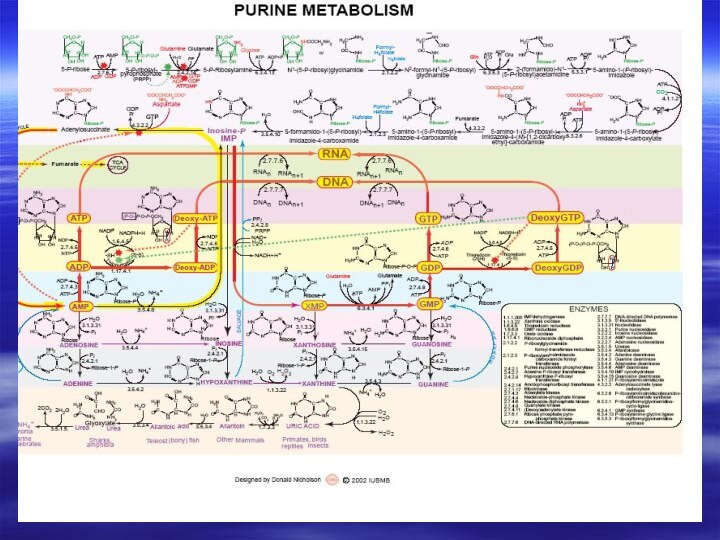
- 19. Катаболизм пуринов и пиримидинов не
- 20. например, конечный продукт катаболизма пуринов
- 21. Метаболизм пуриновых и пиримидиновых нуклеотидов
- 22. Одно из важных направлений использования
- 23. Нуклеотиды выполняют ряд важных функций в клетке. Они являются источниками энергии,
- 24. ATP - наиболее известный и обычно используемый источник энергии для многих процессов.
- 25. ГТФ используется в синтезе белкак, глюкозы, а также в некоторых других реакциях.
- 26. УТФ - источник энергии для активирования глюкозы
- 27. AMФ - часть структуры некоторых коферментов (НАД+ , НАДФ+ , кофермента A).
- 28. И, конечно, нуклеотиды – основные структурные элементы нуклеиновых кислот и субстраты для синтеза.
- 29. Большинство клеток способно синтезировать нуклеотиды
- 30. В дополнение к способности синтезировать
- 31. Генетические дефекты некоторых ферментов
- 32. Многие производные нуклеотидов нашли применение в
- 39. Нуклеотиды- это наиболее сложные метаболиты. Их биосинтез
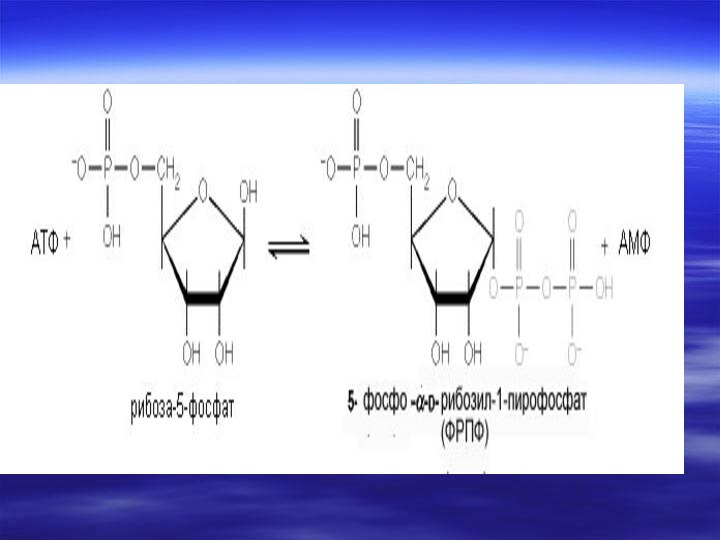
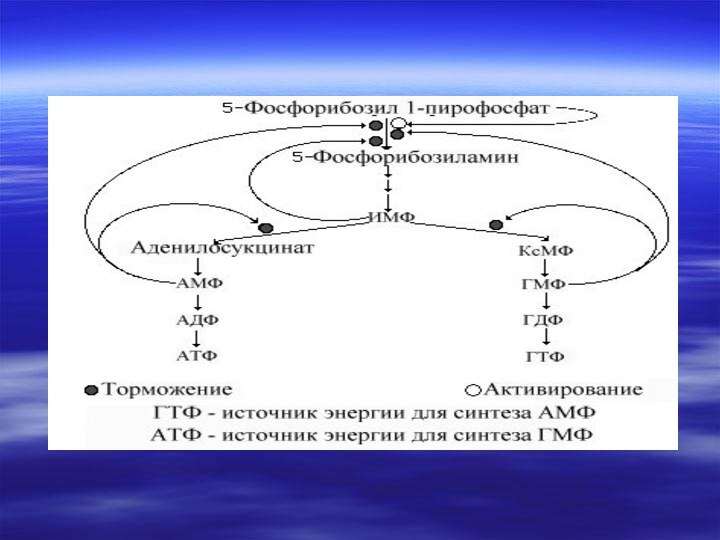
- 40. В организме человека около 90 % пуриновых оснований снова превращается в нуклеозидмонофосфаты, связываясь с Фосфорибозилдифосфатом (PRPF).
- 41. Путь « спасения»- повторное включение пуринов Аденин
- 44. Деградация пуринов В организме человека пурины
- 45. ГМФ распадается в две стадии до
- 46. АМФ дезаминируется, образуя ИМФ, далее
- 47. На каждой стадии реакций в субстрат
- 49. Расщепление пуринов у человека заканчивается на стадии
- 50. При ее избыточных количествах или нарушении катаболизма,
- 51. В большинстве случаев гиперурикемия
- 52. Для лечения гиперурикемии применяют аллопуринол ( структурный аналог м.к.) -ингибитор ксантиноксидазы.
- 53. Патохимия пуринового обмена
- 54. Подагра-хроническое заболевание на фоне гиперурикемии
- 55. При синдроме Леха-Нихана- полная потеря активности GGFRT.
- 56. Дефект аденозиндезаминазы выявляется во многих
- 57. Недоразвиты тимус и лимфатические узлы. Торможение р-ций дезаминирования увеличивает конц. аденозина и дезоксиаденозина
- 58. Дефект аденозиндезаминазы выявляется во многих тканях, но патологические последствия развиваются главным образом в лимфоцитах.
- 59. Недоразвиты тимус и лимфатические узлы. Торможение р-ций дезаминирования увеличивает конц. аденозина и дезоксиаденозина.
- 60. Последний и особенно dATF токсичны для лимфоцитов,
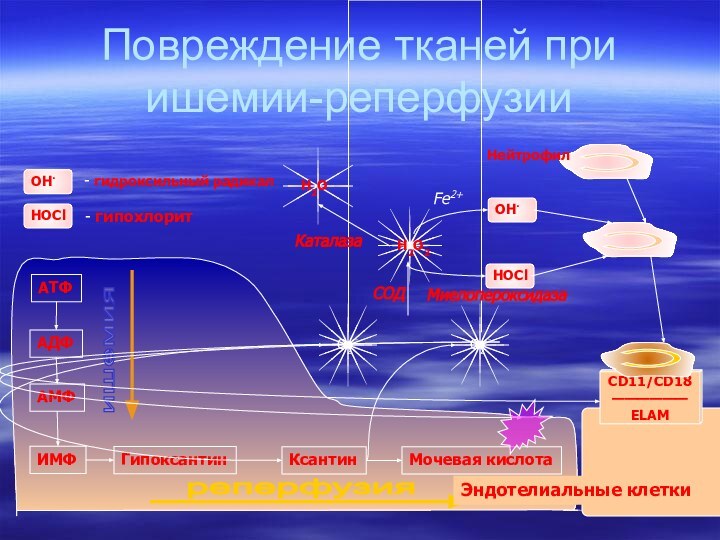
- 61. Распад пуринов и перекисные процессыГенерация активных форм кислорода при ишемии-реперфузии
- 62. Ишемия. Распад АТФ до гипоксантинапрекращение кровотока
- 63. Повреждение тканей при ишемии-реперфузииСОДКаталазаМиелопероксидазаFe2+Эндотелиальные клетки
- 64. Реперфузия. Окисление гипоксантина до мочевой кислотыПосле
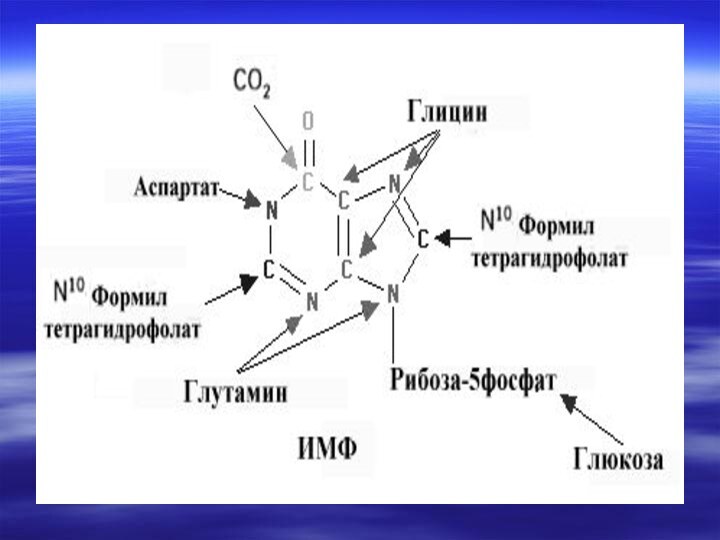
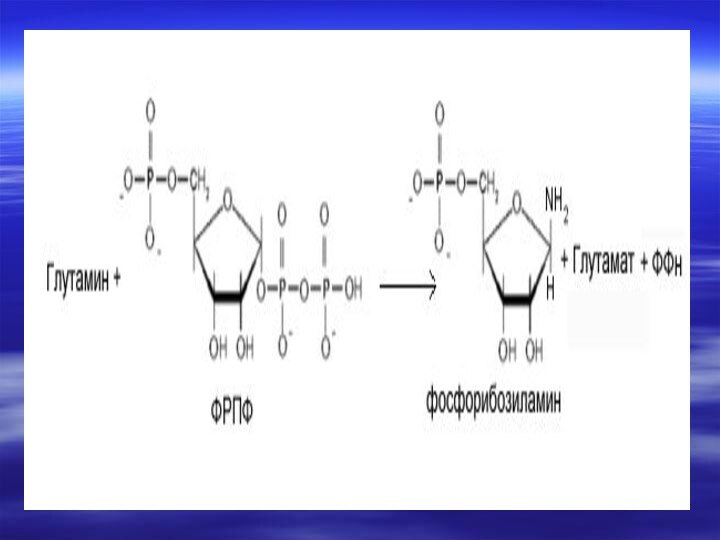
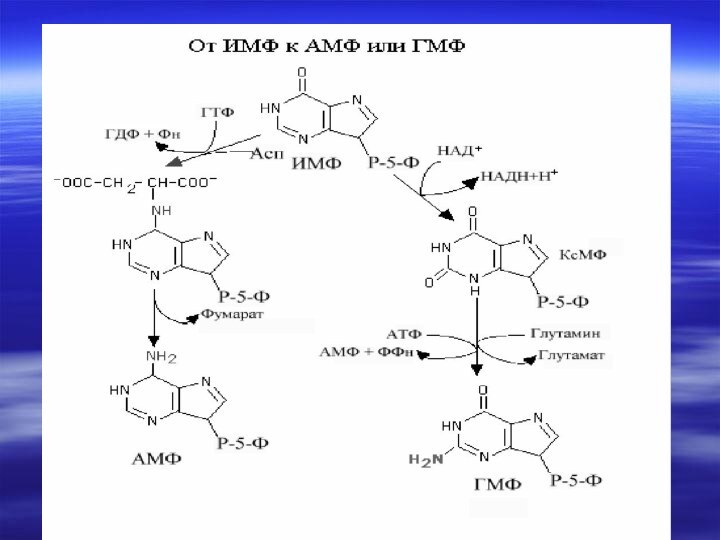
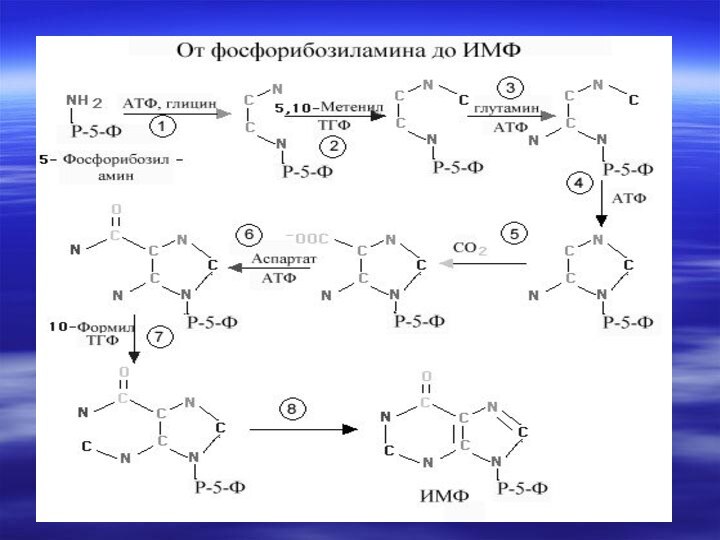
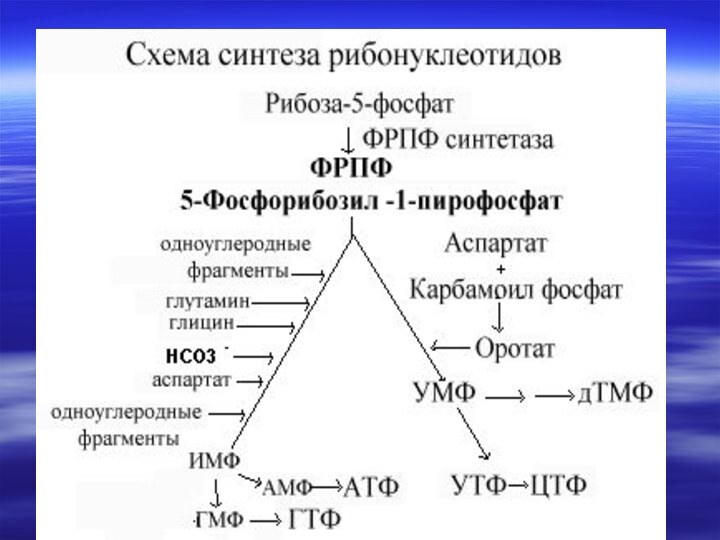
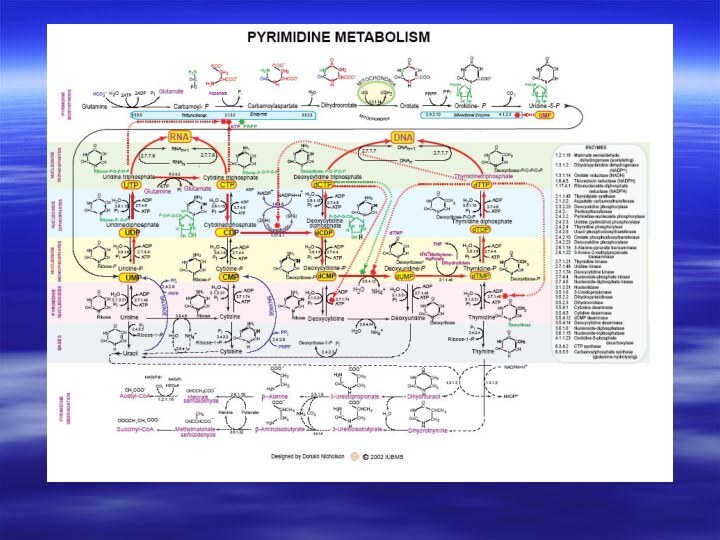
- 66. Центральным промежуточным продуктом биосинтеза предшественников НК является
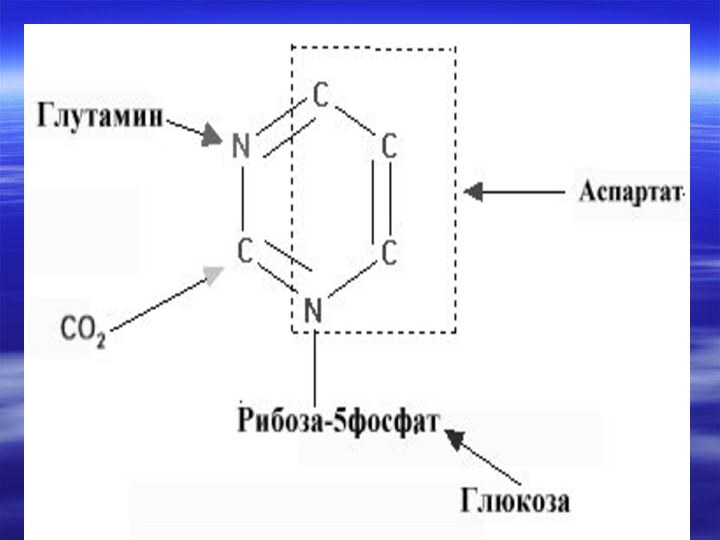
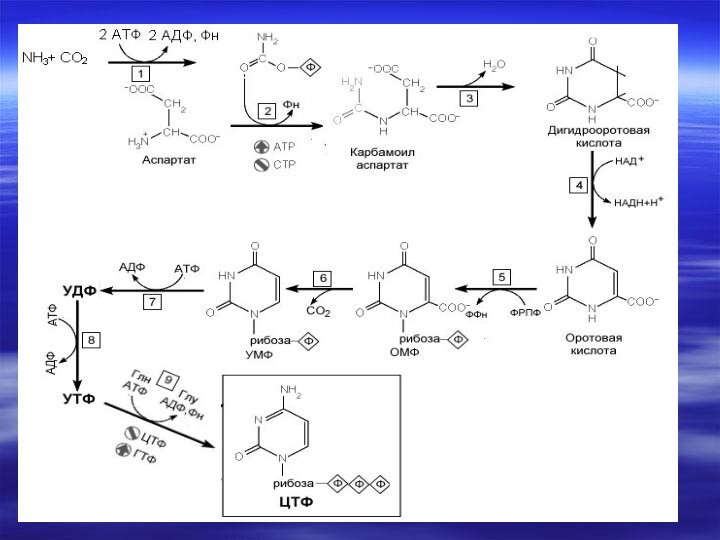
- 67. Непосредственным предшественником при синтезе пиримидиновых колец является карбомоилфосфат, который образуется из Глу и НСО3- и аспартата.
- 70. Реакции 1,2,3 протекают в
- 71. Последняя декарбоксилируется тем же ферментом,
- 72. Биосинтез пиримидиновых оснований протекает сложнее, чем
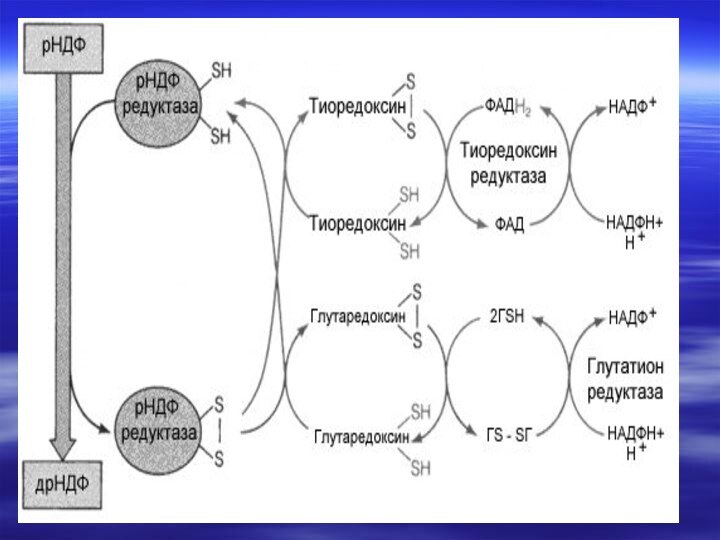
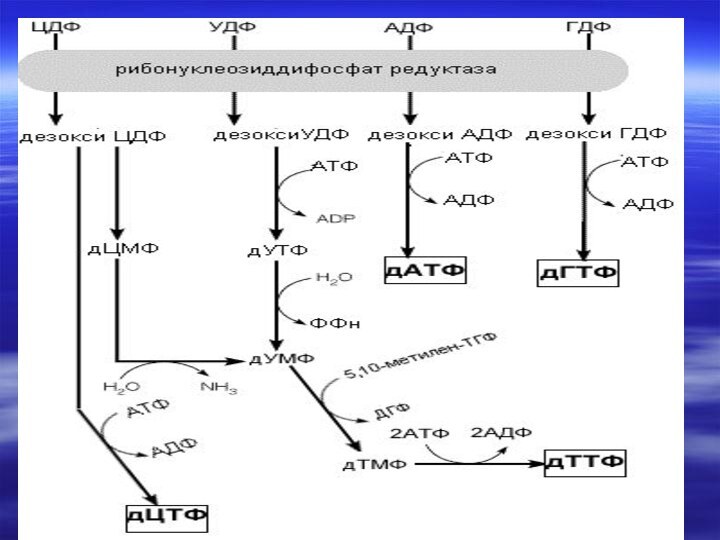
- 73. Биосинтез дезоксирибонуклеотидов2′- дезоксирибоза –структурный элемент ДНК, не
- 76. дУМФ+ Метилен-Н4-фолат ----?
- 77. Синтез дезоксирибонуклеотидов в покоящихся клетках практически не
- 78. Ингибиторы синтеза дезоксирибонуклеотидов делают невозможной репликацию ДНК
- 79. 5-фторурацил- структурный аналог тимидиловой кислоты, ингибирует фермент и блокирует биосинтез ДНК.
- 80. Однако на опухолевые ткани они действуют сильнее,
- 83. Скачать презентацию
- 84. Похожие презентации
Содержание:1.Переваривание и всасывание нуклеопротеидов2.Метаболизм пуринов и пиримидинов3.Репликация ДНК, стадии.Альтернативный сплайсинг.4. Регуляция экспрессии генов иммуноглобулинов.5.Патология обмена азотистых оснований и НК
































































Слайд 2
Содержание:
1.Переваривание и всасывание нуклеопротеидов
2.Метаболизм пуринов и пиримидинов
3.Репликация ДНК,
стадии.Альтернативный сплайсинг.
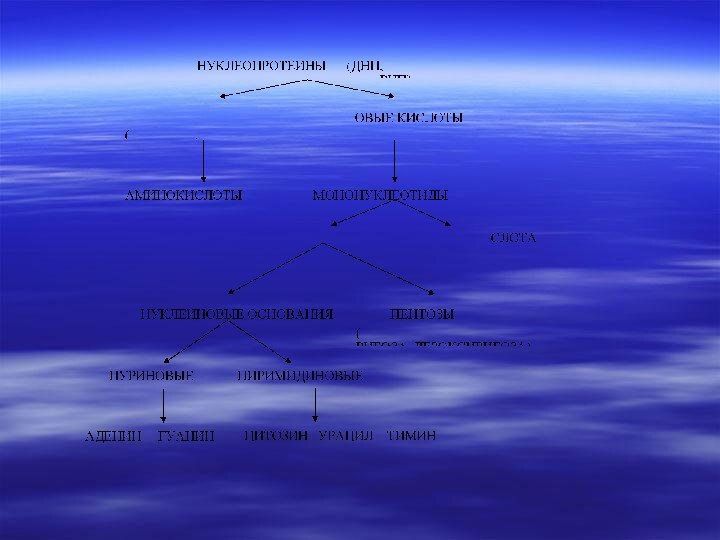
и НКСлайд 3 Сложные белки- нуклеопротеиды содержат в своем
составе нуклеиновые кислоты и белок.
Рибонуклеопротеидами являются рибосомы,
содержащие в своем составе молекулу РНК и белок.
Слайд 4
Дезоксирибонуклеопротеид представляет собой хроматин, в
котором молекула ДНК связывает между собой гистоны
Слайд 6
Переваривание и всасывание нуклеопротеидов
Как известно, большая часть нуклеиновых
кислот в клетке связана с белком в форме нуклеопротеиновых.
компонентовСлайд 7 Поступающие с пищей нуклеопротеины разрушается панкреатическими ферментами, а
нуклеопротеины ткани - лизосомальными ферментами. Вначале происходит диссоциация компонентов
нуклеопротеинов на белки и нуклеиновые кислоты.Слайд 8 Этому способствует кислая среда желудка. Белки
затем включаются в обмен вместе с другими белками пищи,
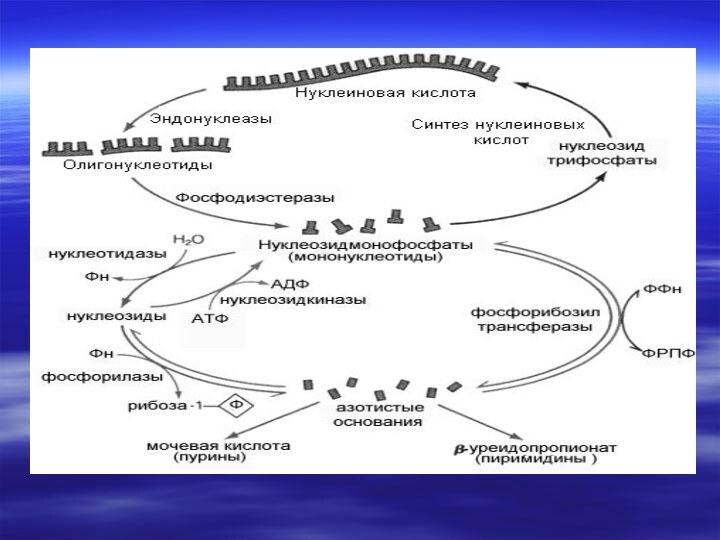
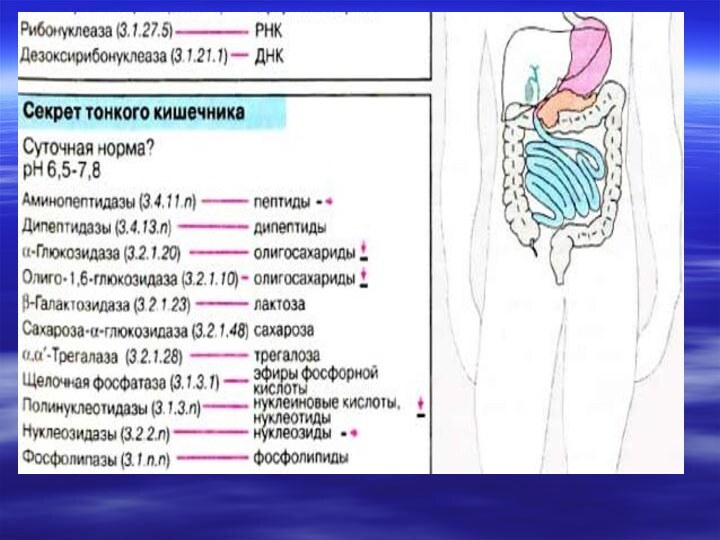
а нуклеиновые кислоты гидролизуются нуклеазами сока поджелудочной железы (РНКазами и ДНКазами), с образованием смеси полинуклеотидов. Далее в процесс включаются полинуклеотидазы и фосфодиэстеразы (эндонуклеазы) кишечника. Они довершают гидролиз нуклеиновых кислот до мононуклеотидов.Слайд 9 В кишечнике, как правило, образуются 3'-фосфат нуклеотиды, а
под влиянием лизосомальных полинуклеотидаз образуются биологически важные 5'- фосфат
нуклеотиды. Нуклеотиды гидролизуются нуклеотидазами, с образованием нуклеозидов и Фн.
Слайд 10
Нуклеозиды, которые обычно рассматриваются
как конечный продукт переваривания нуклеиновых кислот в кишечнике, всасываются.
Слайд 13 В клетках некоторых тканей, в том
числе и клетках кишечника, нуклеозиды подвергаются фосфоролизу нуклеозид
фосфорилазами, с образованием оснований и рибозы 1-Ф (или дезоксирибозы 1-P).Слайд 14 Рибоза 1-Ф и рибоза 5-Ф в цитозоле
находятся в равновесии и могут быть вновь использованы для
синтеза нуклеотидов или вступают в неокислительную часть пенозофосфатного пути.Слайд 15 Пуриновые и пиримидиновые основания также или
распадаются далее до конечных продуктов или используются повторно для
синтеза нуклеотидов.Слайд 16 В клетке существует интенсивно обмениваемый пул
рибонуклеотидов и РНК. Молекулы ДНК и пул дезоксирибонуклеотидов обменивается
значительно медленнее.Слайд 17 Тканевые пурины и пиримидины, которые не
попадают в пути повторного использования, обычно распадаются и продукты
их распада выделяются.Слайд 18 Используется лишь очень небольшое количество пищевых пуринов, а
основная масса поступивших с пищей пуринов распадается.
Слайд 19
Катаболизм пуринов и пиримидинов не сопровождается
значительным высвобождением энергии в сравнении с обменом аминокислот, однако
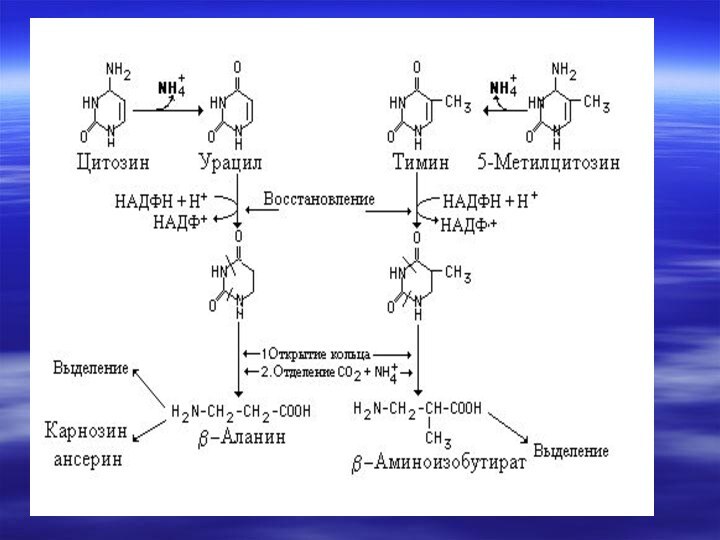
некоторые продукты распада выполняют определенные физиологические функции,Слайд 20 например, конечный продукт катаболизма пуринов у
человека мочевая кислота, может служить антиоксидантом, продукт катаболизма пиримидина,
b– аланин используется всинтезе активных пептидов мозга и мышц
Слайд 22 Одно из важных направлений использования аминокислотного
фонда клеток - синтез пиримидиновых и пуриновых нуклеотидов.
Слайд 26 УТФ - источник энергии для активирования глюкозы и
галактозы, а ЦТФ - для реакций с участием липидов.
Слайд 28 И, конечно, нуклеотиды – основные структурные элементы
нуклеиновых кислот и субстраты для синтеза.
Слайд 29 Большинство клеток способно синтезировать нуклеотиды для
удовлетворения своей потребности в них, и поэтому поступления нуклеотидов,
нуклеозидов, или азотистых оснований с пищей не требуются.Слайд 30 В дополнение к способности синтезировать нуклеотиды
de novo, многие клетки обладают возможностями использования продуктов распада
нуклеиновых кислот, таких как нуклеозиды или свободные основания для синтеза нуклеотидов.Слайд 31 Генетические дефекты некоторых ферментов этого
пути проявляются в форме заболеваний нервной системы и суставов.
Слайд 32 Многие производные нуклеотидов нашли применение в медицинской
практике для подавления роста опухолевых клето к, лечения СПИДа,
подагрыСлайд 39 Нуклеотиды- это наиболее сложные метаболиты. Их биосинтез требует
много времени и затрат энергии. Поэтому они могут
разрушаться не полностью, и в основном снова участвуют в биосинтезе. Это относится к пуриновым основаниям-аденину и гуанину.Слайд 40 В организме человека около 90 % пуриновых оснований
снова превращается в нуклеозидмонофосфаты, связываясь с Фосфорибозилдифосфатом (PRPF).
Слайд 41
Путь « спасения»- повторное включение пуринов
Аденин +
фосфорибозилдифосфат(ФРДФ)----?
АМФ + Н4Р2О7Гуанин + ФРДФ--?АМФ + Н4Р2О7 Гипоксантин + ФРДФ---?
ИМФ+ Н4Р2О7
Слайд 44
Деградация пуринов
В организме человека пурины распадаются
до мочевой кислоты и в такой форме выводятся с
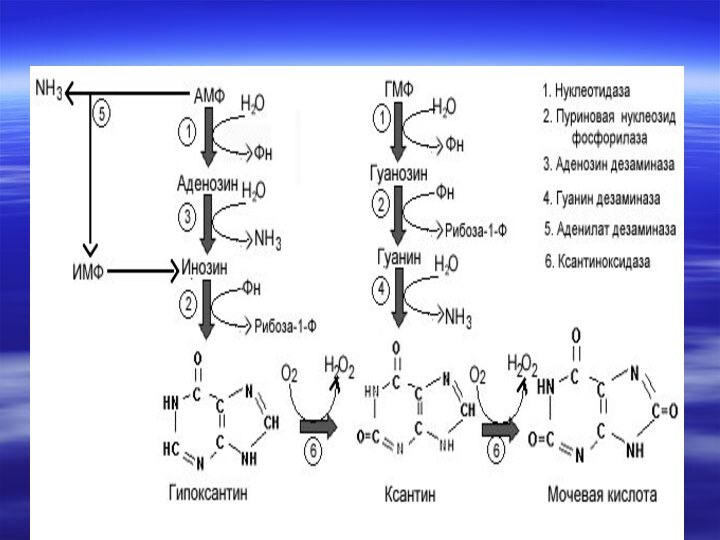
мочой. Пуриновое кольцо при этом остается незатронутым.Слайд 45 ГМФ распадается в две стадии до гуанозина,
а затем до гуанина. Гуанин дезаминируется, образуя другое пуриновое
кольцо - ксантинСлайд 46 АМФ дезаминируется, образуя ИМФ, далее гипоксантин.
Один и тот же фермент- ксантиноксидаза, превращает гипоксантин
в ксантин, а последний в мочевую кислоту.Слайд 47 На каждой стадии реакций в субстрат вводится
оксогруппа окислением молекулярным кислородом. Другим продуктом реакций является токсичная
перекись водорода, которая удаляется пероксидазами.Слайд 49 Расщепление пуринов у человека заканчивается на стадии образования
мочевой кислоты. М.К. очень плохо растворима в воде.
Слайд 50 При ее избыточных количествах или нарушении катаболизма, концентрация
ее в крови увеличивается, и как следствие происходит отложение
кристаллов кислоты в органах. Отложение м.к. в суставах является причиной сильных болей при подагре.Слайд 51 В большинстве случаев гиперурикемия связана
с нарушением выведения мочевой кислоты почками. Неблагоприятным фактором является
высокое содержание пуринов в пище ( мясная диета).Слайд 52 Для лечения гиперурикемии применяют аллопуринол ( структурный аналог
м.к.) -ингибитор ксантиноксидазы.
Слайд 54 Подагра-хроническое заболевание на фоне гиперурикемии и
острых приступов артрита -частичная потеря активности фермента-GGFRT-гипоксантингуанинфосфорибозилтрансферазы.
Слайд 55
При синдроме Леха-Нихана- полная потеря активности GGFRT.
Комбинированный иммунодефицит (Т и В клетки), гипоурикемия, дезоксиаденозинурия- происходит
потеря активности фермента -аденозиндезаминазыСлайд 56 Дефект аденозиндезаминазы выявляется во многих тканях,
но патологические последствия развиваются главным образом в лимфоцитах.
Слайд 57 Недоразвиты тимус и лимфатические узлы. Торможение р-ций
дезаминирования увеличивает конц. аденозина и дезоксиаденозина
Слайд 58 Дефект аденозиндезаминазы выявляется во многих тканях, но патологические
последствия развиваются главным образом в лимфоцитах.
Слайд 59 Недоразвиты тимус и лимфатические узлы. Торможение р-ций дезаминирования
увеличивает конц. аденозина и дезоксиаденозина.
Слайд 60 Последний и особенно dATF токсичны для лимфоцитов, вызывают
угнетение активности рибонуклеотидредуктазы и уменьшение синтеза dNTF и DNK
Слайд 61
Распад пуринов и перекисные процессы
Генерация активных форм кислорода
при ишемии-реперфузии
Слайд 62
Ишемия.
Распад АТФ до гипоксантина
прекращение кровотока (ишемия) сопровождается
гипоксией;
распад АТФ начинает преобладать над его синтезом:
АТФ
АДФ
АМФ
ИМФ
Гипоксантин
аденилатдезаминаза
нуклеозидфосфорилаза
Слайд 63
Повреждение тканей при ишемии-реперфузии
СОД
Каталаза
Миелопероксидаза
Fe2+
Эндотелиальные клетки
Слайд 64
Реперфузия. Окисление
гипоксантина до мочевой кислоты
После восстановления кровотока
(реперфузия) в ткани начинает поступать кислород;
окисление гипоксантина до мочевой
кислоты сопровождается образованием активных форм кислорода:Гипоксантин
Ксантин
Мочевая кислота
H2O+O2
H2O2
ксантиноксидаза
H2O+O2
H2O2
ксантиноксидаза





























