- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Урок химии в 11 классе по теме Вода
Содержание
- 2. Вода в природеВода – самое распространенное на
- 3. Общие запасы свободной воды на Земле составляют
- 4. Однако запасы пресной воды, пригодной для питья
- 5. В организме человека вода составляетоколо 65% от
- 6. Строение молекулыМолекула Н2О имеет угловое строение, угол
- 8. Химические свойстваВ роли окислителя вода взаимодействует:С сильнейшими
- 9. В роли восстановителя вода взаимодействуетС таким сильнейшим
- 10. :О—Н + :О—Н
- 11. Гидратация- это присоединение воды к веществуРеакции гидратацииа)
- 12. Гидролизом называется процесс разложения веществ в результате
- 13. б) Гидролиз карбидов металловОдин из способов получения
- 14. д) Гидролиз галогенпроизводных бензола
- 15. ж) Гидролиз ди- и полисахаридовмногоступенчатый процесс конечным
- 16. Скачать презентацию
- 17. Похожие презентации







Слайд 3
Общие запасы свободной воды на Земле
составляют 1,4
млрд км3
Почти столько же воды находится в
физически
и химически связанном состоянии, например в
природных кристаллогидратах:
глауберовой соли Na2SO4·10H2O ,
бокситах Al2O3·nH2O и т.д.
Слайд 4
Однако запасы пресной воды,
пригодной для питья
и
бытовых нужд, весьма ограничен.
Поэтому в настоящее
время охрана
водных ресурсов и очистка сточных вод стали наиболее
актуальными проблемами,
стоящими перед человечеством.
Однако запасы пресной воды,
пригодной для питья
и бытовых нужд, весьма ограничен.
Поэтому в настоящее
время охрана водных ресурсов и очистка
сточных вод стали наиболее
актуальными проблемами,
стоящими перед человечеством.
Слайд 5
В организме человека вода составляет
около 65% от массы
тела.
70%
находится
внутри клеток
7%
находится
внутри кровеносных
сосудов
и в составе
плазмы
крови23%
составляет
межклеточная вода
При продолжительности жизни 70 лет
человек потребляет около 25 т воды
Слайд 6
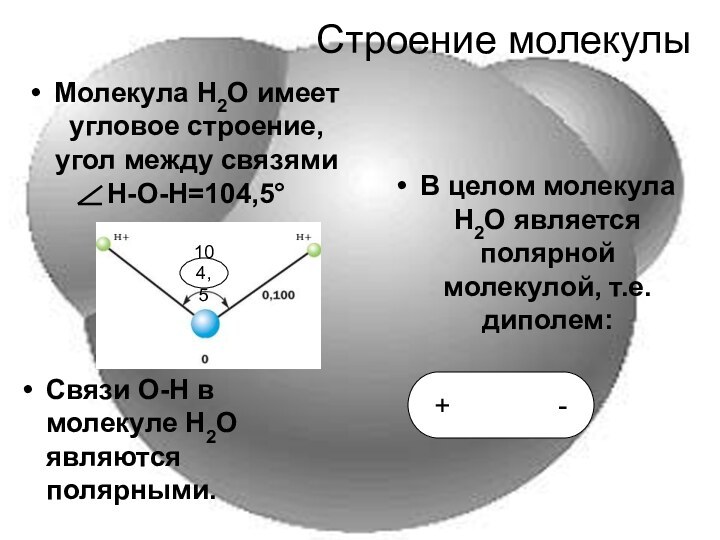
Строение молекулы
Молекула Н2О имеет угловое строение, угол между
связями
Н-О-Н=104,5°Связи О-Н в молекуле Н2О являются полярными.
В целом молекула Н2О является полярной молекулой, т.е. диполем:
+ -
Слайд 8
Химические свойства
В роли окислителя вода взаимодействует:
С сильнейшими восстановителями-
щелочными и щелочноземельными металлами. (при обычной температуре)
2Na + 2H2O = 2 NaOH + H2 ↑Са + 2Н2О = Са(ОН)2 + Н2 ↑
С наименее активными металлами при нагревании
Mg + 2H2O = Mg(OH)2 + H2 ↑
3Fe + 4H2O = Fe3O4 + 4H2 ↑
С гидридами щелочных и щелочноземельных металлов
NaH + H2O = NaOH + H2
Окислительно-восстановительные свойства.
0
+1
+1
0
-1
+1
0
+1
0
t°
t°
Слайд 9
В роли восстановителя вода взаимодействует
С таким сильнейшим окислителем,
как фтор
2F2 + 2H2O =
4HF + O2При температуре выше 1000°С водяной пар разлагается на водород и кислород, т.е происходит внутримолекулярный окислительно-восстановительный процесс:
+1 -2 0 0
2Н2О 2Н2+ О2
t°
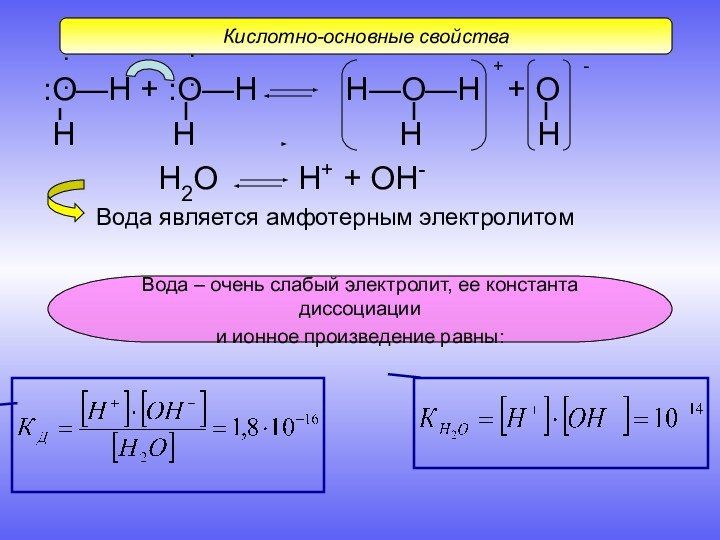
Слайд 10 :О—Н + :О—Н Н—О—Н
+ О
Н
Н Н НН2О Н+ + ОН-
Вода является амфотерным электролитом
Кислотно-основные свойства
. .
. .
+
-
Вода – очень слабый электролит, ее константа диссоциации
и ионное произведение равны:
Слайд 11
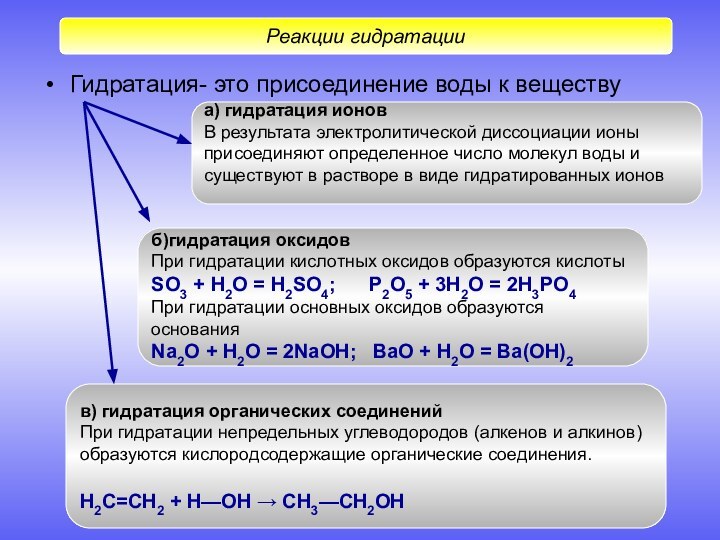
Гидратация- это присоединение воды к веществу
Реакции гидратации
а) гидратация
ионов
В результата электролитической диссоциации ионы
присоединяют определенное число
молекул воды и существуют в растворе в виде гидратированных ионов
б)гидратация оксидов
При гидратации кислотных оксидов образуются кислоты
SO3 + H2O = H2SO4; P2O5 + 3H2O = 2H3PO4
При гидратации основных оксидов образуются основания
Na2O + H2O = 2NaOH; BaO + H2O = Ba(OH)2
в) гидратация органических соединений
При гидратации непредельных углеводородов (алкенов и алкинов)
образуются кислородсодержащие органические соединения.
Н2С=СН2 + Н—ОН → СН3—СН2ОН
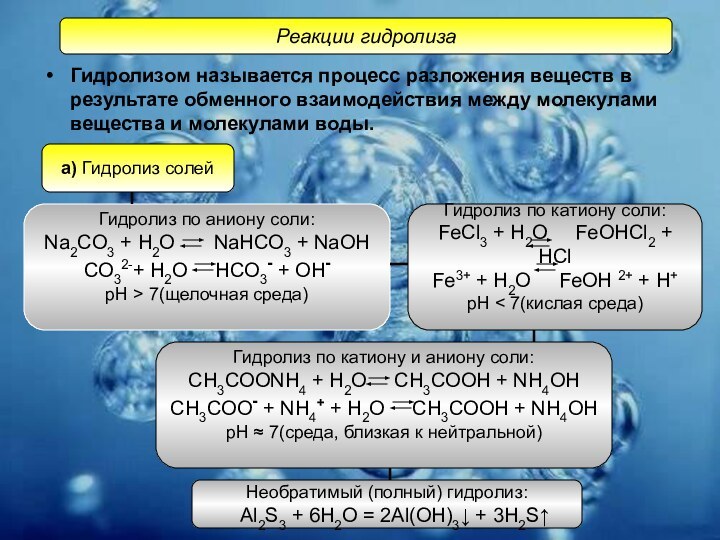
Слайд 12 Гидролизом называется процесс разложения веществ в результате обменного
взаимодействия между молекулами вещества и молекулами воды.
Реакции гидролиза
а) Гидролиз солей
Гидролиз по аниону соли:
Na2CO3 + H2O NaHCO3 + NaOH
CO32-+ H2O HCO3- + OH-
рН > 7(щелочная среда)
Гидролиз по катиону соли:
FeCl3 + H2O FeOHCl2 + HCl
Fe3+ + H2O FeOH 2+ + H+
рН < 7(кислая среда)
Гидролиз по катиону и аниону соли:
CH3COONH4 + H2O CH3COOH + NH4OH
CH3COO- + NH4+ + H2O CH3COOH + NH4OH
рН ≈ 7(среда, близкая к нейтральной)
Необратимый (полный) гидролиз:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
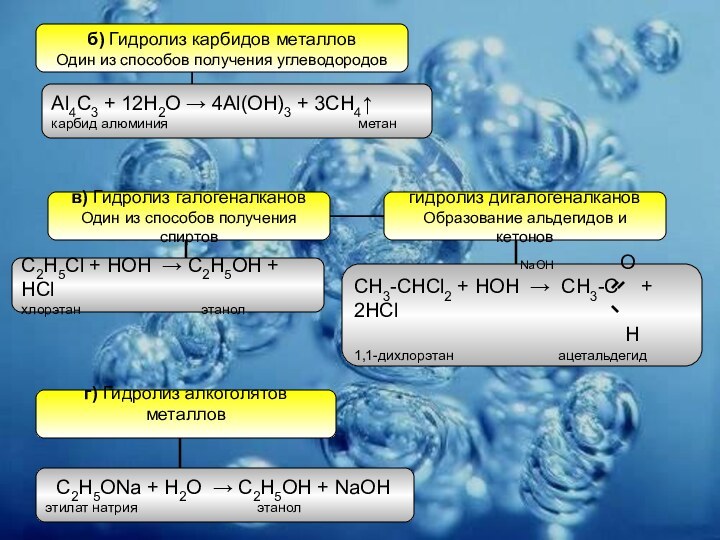
Слайд 13
б) Гидролиз карбидов металлов
Один из способов получения углеводородов
Al4C3
+ 12H2O → 4Al(OH)3 + 3CH4↑
карбид алюминия
метан в) Гидролиз галогеналканов
Один из способов получения спиртов
C2H5Cl + HOH → C2H5OH + HCl
хлорэтан этанол
гидролиз дигалогеналканов
Образование альдегидов и кетонов
NaOH O
СН3-CHCl2 + HOH → CH3-C + 2HCl
H
1,1-дихлорэтан ацетальдегид
г) Гидролиз алкоголятов металлов
C2H5ONa + H2O → C2H5OH + NaOH
этилат натрия этанол
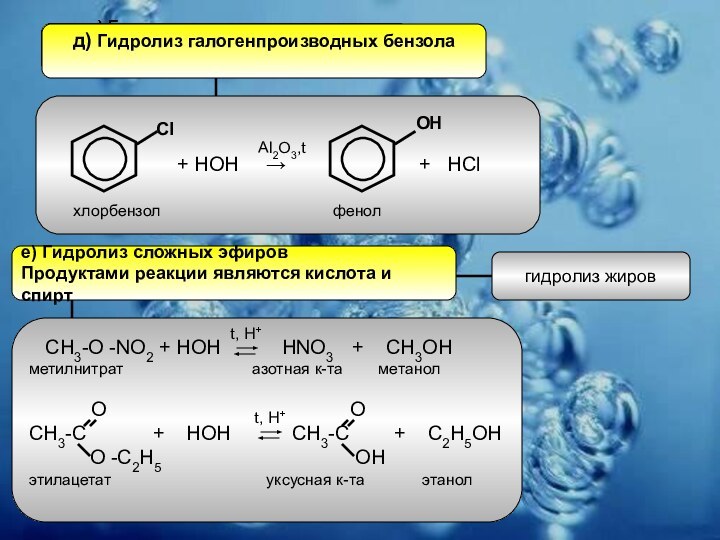
Слайд 14
д) Гидролиз галогенпроизводных бензола
Cl
OH
хлорбензол
фенол
Al2O3,t
е) Гидролиз сложных эфиров
Продуктами реакции являются кислота и спирт
СН3-О -NO2 + HOH HNO3 + CH3OH
метилнитрат азотная к-та метанол
O O
CH3-C + HOH CH3-C + C2H5OH
O -C2H5 OH
этилацетат уксусная к-та этанол
д) Гидролиз галогенпроизводных бензола
д) Гидролиз галогенпроизводных бензола
д) Гидролиз галогенпроизводных бензола
гидролиз жиров
Слайд 15
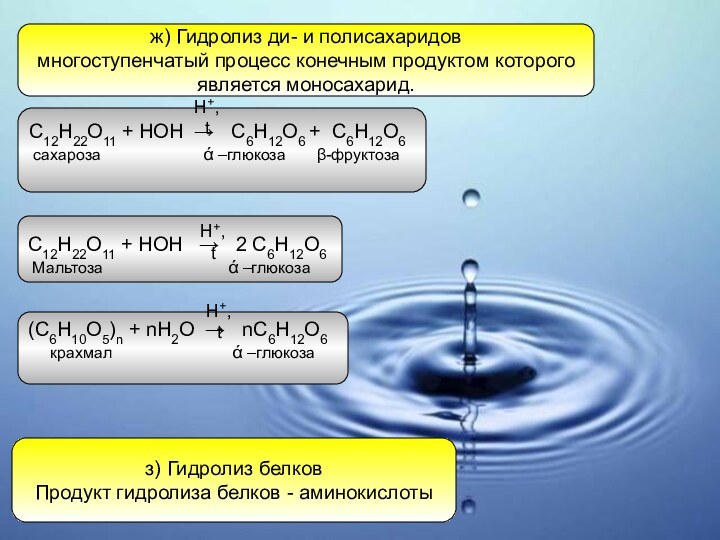
ж) Гидролиз ди- и полисахаридов
многоступенчатый процесс конечным продуктом
которого
является моносахарид.
С12Н22О11 + HOH → 2 C6H12О6
Мальтоза ά –глюкоза
С12Н22О11 + HOH → C6H12О6 + C6H12О6
сахароза ά –глюкоза β-фруктоза
(С6Н10О5)n + nH2O → nC6H12О6
крахмал ά –глюкоза
Н+, t
Н+, t
Н+, t
з) Гидролиз белков
Продукт гидролиза белков - аминокислоты