и неэлектролиты
Вода –
хороший растворитель, т.к. молекулы воды полярны.
слабый амфотерный электролит.
ион
гидроксония
Ионное произведение воды
КН2О = [Н+]•[ОН-] = 10-7•10-7 = 10-14
(КН2О)
Вода –
Механизм ЭД
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть
























ион
гидроксония
Ионное произведение воды
КН2О = [Н+]•[ОН-] = 10-7•10-7 = 10-14
(КН2О)
Вода –
Механизм ЭД
Газы: кислород, водород, азот идр.
С.Аррениус
Электролитическая диссоциация -
Теория электролитической диссоциации. 1887 г.
С.Аррениус
(1859 – 1927)
n
N
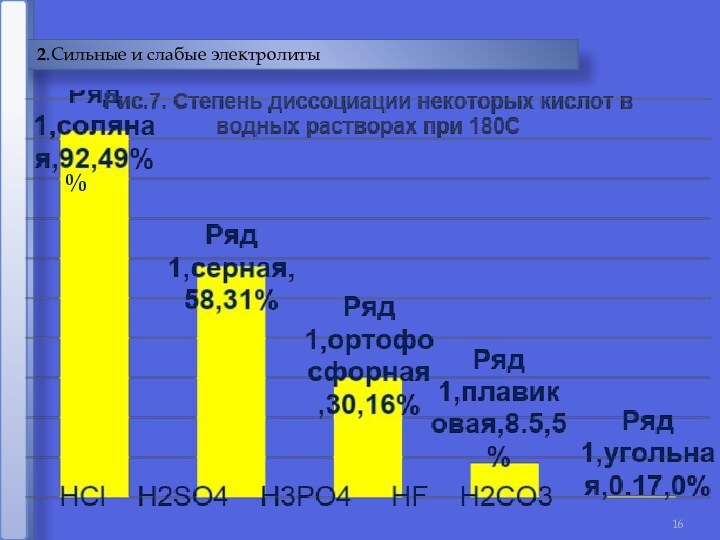
Сильные электролиты α > 30%
Слабые электролиты
α< 30%
Кислоты -
Диссоциация кислот
НCl → + Cl -
Н2SO4 → 2 + SO4 2-
Н2 CO3 2 + CO3 2-
Н+
Н+
Н+
5. Диссоциация кислот, оснований, солей
Основания -
Диссоциация оснований
KOH → K + +
OН-
Ca(OH)2 Ca2+ + 2
Мe(OH)n Men+ + n
OН-
OН-
Соли -
Диссоциация солей
NaCl → +
K2SO4 → 2 +
Al(NO3)3 → + 3
Na+
K+
Al3+
(кислотный остаток)в-
NO3 -
Сl-
SO4 2-
НCO3-
Вопрос 1
Русецкая О.П.
Электролитическая диссоциация электролитов в растворах протекает под действием __________ .
Вопрос 2
Русецкая О.П.
Слабым электролитом является _______ .
Вопрос 3
Русецкая О.П.
Электролитами не являются ________ .
Вопрос 4
Русецкая О.П.
Основные положения электролитической диссоциации сформулировал ученый ______.
Вопрос 5
NaCl → Na+ + Cl -
HCl
Поляризация связи в молекуле НСl под действием молекул воды.
Гидратация
HCl + nН2О →H+ (Н2О)х + Сl-(Н2О)n-х
НCl → Н+ + Cl -
Механизм ЭД
Механизм ЭД