- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Элемент железо
Содержание
- 2. Железо - один из семи металлов древности.
- 3. Многие древние народы познакомились с железом, как
- 4. В древности и в средние века семь
- 5. Железо – второй по распространённости металл на
- 6. В периодической системе железо находится в четвертом
- 7. Физические свойстваЧистое железо - серебристо-белый металл, обладает
- 8. Железо имеет две кристаллические модификации. Ниже 910
- 9. Получение железа. В промышленности железо получают восстановлением
- 10. Химические свойства. В реакциях железо является восстановителем.
- 11. Железо находится в середине электрохимического ряда напряжений
- 12. При обычной температуре железо не взаимодействует с
- 13. Из растворов солей железо вытесняет металлы, которые
- 14. Оксид железа (III) Fe2O3 порошок бурого цвета,
- 15. Гидрооксид железа (II) Fe(OH)2 порошок белого цвета,
- 16. Железо реагирует с разбавленными серной и соляной
- 17. Металлическое железо взаимодействует при нагревании с концентрированными
- 18. Применение и биологическая роль железа и его
- 19. Хлорид железа (III) FeCl3 применяется для очистки
- 20. Железо является одним из важнейших микроэлементов в
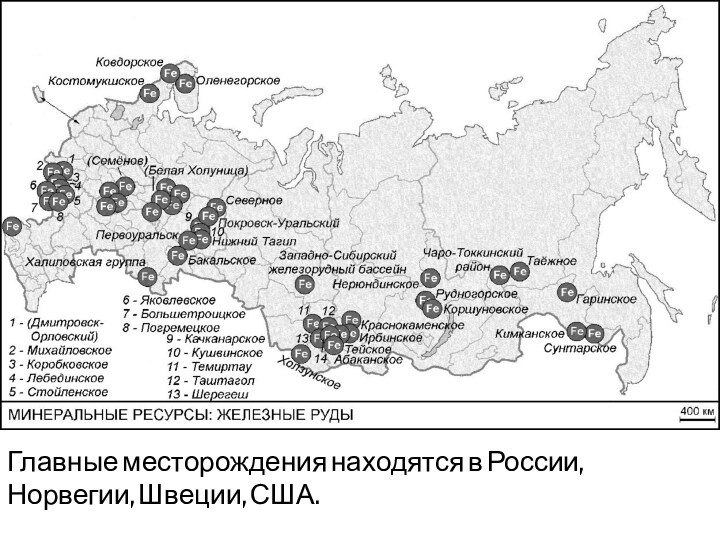
- 21. Главные месторождения находятся в России, Норвегии, Швеции, США.
- 22. Скачать презентацию
- 23. Похожие презентации
Железо - один из семи металлов древности. Весьма вероятно, что человек познакомился с железом метеоритного происхождения раньше, чем с другими металлами.




















Слайд 2 Железо - один из семи металлов древности. Весьма
вероятно, что человек познакомился
чем с другими металлами.Слайд 3 Многие древние народы познакомились с железом, как с
металлом, упавшим с неба, т. е. как с метеоритным
железом.O том, что древние люди пользовались вначале именно железом метеоритного происхождения, свидетельствуют и распространенные у некоторых народов мифы о богах или демонах, сбросивших с неба железные предметы и орудия, - плуги, топоры и пр.
Интересен также факт,
что к моменту открытия
Америки индейцы и эскимосы
Северной Америки не были
знакомы со способами получения
железа из руд, но умели
обрабатывать
метеоритное железо.
(метеорит)
Слайд 4
В древности и в средние века семь известных
тогда металлов сопоставляли с семью планетами,
что символизировало связь
между металлами и небесными телами .Такое сопоставление стало обычным более 2000 лет назад
и постоянно встречается в литературе вплоть до XIX века.
Кусочек железа
Марс
Слайд 5 Железо – второй по распространённости металл на планете(после
алюминия).
Содержание в земной коре составляет 4,65% по массе.
Известно
свыше 300 минералов,из которых слогаются
месторождения железных руд.
Промышленное значение имеют руды с содержанием Fe свыше 16%.
Важнейшие рудные минералы, содержащие железо: магнитный железняк Fe3O4 (содержит 72,4% Fe),
гематит Fe2O3 (65% Fe),
гетит Fe2O3H2O ,(до 60%Fe),
Слайд 6 В периодической системе железо находится в четвертом периоде,
в побочной подгруппе VIII группы.
Химический знак Fe (феррум). Порядковый
номер 26, электронная формула 1s2 2s2 2p6 3d6 4s2.
Валентные электроны у атома железа находятся на последнем электронном слое (4s2)
и предпоследнем (3d6). В химических реакциях железо может отдавать эти электроны
и проявлять степени окисления +2, +3 и, иногда+6.
Слайд 7
Физические свойства
Чистое железо - серебристо-белый металл, обладает большой
ковкостью, пластичностью и сильными магнитными свойствами.
Плотность железа 7,87
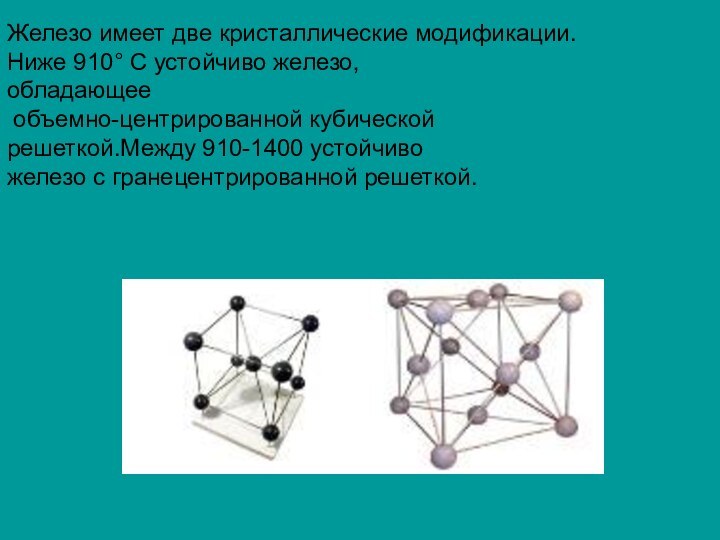
г/см3, температура плавления 1539С.Слайд 8 Железо имеет две кристаллические модификации. Ниже 910 С
устойчиво железо,
обладающее
объемно-центрированной кубической
решеткой.Между 910-1400 устойчиво
железо
с гранецентрированной решеткой.
Слайд 9
Получение железа.
В промышленности железо получают восстановлением его
из железных руд углеродом (коксом)
и оксидом углерода (II)
в доменных печах. Химизм доменного процесса следующий:C + O2 =CO2,
CO2 + C =2CO,
3Fe2O3 + CO= 2Fe3O4 + CO2,
Fe3O4 + CO =3FeO + CO2,
FeO + CO= Fe + CO2.
Слайд 10
Химические свойства.
В реакциях железо является восстановителем. Однако
при обычной температуре оно не взаимодействует даже
с самыми
активными окислителями (галогенами, кислородом, серой), но при нагревании становится активным и реагирует с ними
2Fe + 3Cl2= 2FeCl3 Хлорид железа (III)
3Fe + 2O2 =Fe3O4 Оксид железа (III)
Fe + S= FeS Сульфид железа (II)
При очень высокой температуре железо реагирует с углеродом, кремнием и фосфором
3Fe + C= Fe3C Карбид железа (цементит)
3Fe + Si= Fe3Si Силицид железа
3Fe + 2P= Fe3P2 Фосфид железа (II)
Во влажном воздухе железо быстро окисляется (корродирует)
4Fe + 3O2 + 6H2O= 4Fe(OH)3,
Слайд 11 Железо находится в середине электрохимического ряда напряжений металлов,
поэтому является металлом
средней активности. Восстановительная способность у железа
меньше, чем у щелочных, щелочноземельных металлов и у алюминия. Только при высокой температуре раскаленное железо реагирует с водой:
3Fe + 4H2O= FeO*Fe2O3+ 4H2
Слайд 12 При обычной температуре железо не взаимодействует с концентрированной
серной кислотой,
так как пассивируется ею. При нагревании концентрированная
серная кислота окисляет железо до сульфата железа (III)2Fe + 6H2SO4 =Fe2(SO4)3 + 3SO2 + 6H2O.
Разбавленная азотная кислота окисляет железо до нитрата железа (III)
Fe + 4HNO3= Fe(NO3)3 + NO + 2H2O.
Слайд 13 Из растворов солей железо вытесняет металлы, которые расположены
правее его в электрохимическом ряду напряжений
Fe + CuSO4= FeSO4
+ Cu. Соединения железа (II) .
Оксид железа (II) FeO черное кристаллическое вещество, нерастворимое в воде. Оксид железа (II) получают
восстановлением оксида железа(III) оксидом углерода (II)
Fe3O4 + CO= 3FeO + CO2.
Слайд 14 Оксид железа (III) Fe2O3 порошок бурого цвета, не
растворяется в воде. Оксид железа (III) получают разложением гидрооксида
железа (III)2Fe(OH)3= Fe2O3 + 3H2O
Слайд 15 Гидрооксид железа (II) Fe(OH)2 порошок белого цвета, не
растворяется в воде. Получают его из солей
железа (II)
при взаимодействии их со щелочамиFeSO4 + 2NaOH= Fe(OH)2 + Na2SO4,
Слайд 16 Железо реагирует с разбавленными серной и соляной кислотами,
вытесняя из кислот водород
Fe + 2HCl =FeCl2 + H2
Fe
+ H2SO4= FeSO4 + H2
Слайд 17
Металлическое железо взаимодействует при нагревании с концентрированными
(более
30%) растворами щелочей, образуя гидроксокомплексы.
Под действием сильных окислителей
при нагревании железо можетобразовывать соединения в степени окисления (+VI) – ферраты: Fe + 2KNO3 = K2FeO4 + 2NO
Слайд 18
Применение и биологическая роль железа и его соединений.
Важнейшие
сплавы железа: чугуны и стали являются основными конструкционными материалами
практическиво всех отраслях современного производства.
Слайд 19 Хлорид железа (III) FeCl3 применяется для очистки воды.
В органическом синтезе FeCl3 применяется как катализатор.
Нитрат железа
Fe(NO3)3 используют при окраске тканей.Слайд 20 Железо является одним из важнейших микроэлементов в организме
человека и животных (в организме взрослого человека
содержится в
виде соединений около 4 г Fe). Оно входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железобелковых комплексов, которые находятся в печени и селезенке. Железо стимулирует функцию кроветворных Органов.