- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Фосфор
Содержание
- 2. ФосфорБілий,складається з молекул P4
- 3. Фосфор за звичайних умов.За звичайних
- 4. Білий фосфорБілий фосфор отримують відновленням фосфату кальцію
- 5. Червоний фосфор.При нагріванні білого фосфору у закритій
- 6. Світло-червоний фосфор.Отримується при кип’ятінні звичайного фосфору з
- 7. Фіолетовий фосфор. Утворюється із білого фосфору при
- 8. Чорний фосфор.Отримують із білого фосфора нагріванням при
- 9. Хімічні властивості.Фосфор належить до головної підгрупи п’ятої
- 10. Взаємодіє з:З киснем сполучається досить енергійно, особливо
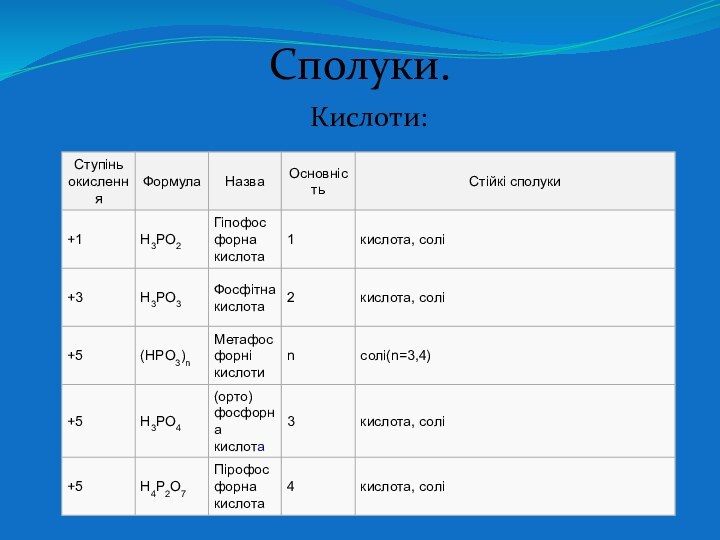
- 11. Сполуки.Кислоти:
- 12. Отримання.У вільному стані фосфор одержують шляхом відновлення
- 13. Застосування.У практиці застосовують переважно червоний фосфор. Використовується
- 14. Біологічна роль.Елементний фосфор майже не зустрічається
- 15. Скачать презентацию
- 16. Похожие презентации
ФосфорБілий,складається з молекул P4 , які мають форму тетраєдра . Фосфор має електронну конфігурацію: [Ne] 3s23p3. В утворенні молекули приймають участь р-орбіталі, вони утворюють тільки б-зв’я зки. При об’анні чотирьох атомів













Слайд 3
Фосфор за звичайних умов.
За звичайних умов-це
білий порошок. Має молекулярну кристалічну гратку. У порошкоподібному стані
фосфор самозаймається прямо на повітрі . Білий фосфор добре розчиненій в CS2, ефірі, але малорозчинний у воді, тому зберігають його під шаром води. Легко з’єднується з галогенами, енергічно реагую із сіркою і багатьма металами. Сильні окисники окиснюють його до фосфорної кислоти. Фосфор виділяє легко відновлювальні метали (золото, срібло, мідь, свинець) з їх солей, та й ще реагує з ними.
Слайд 4
Білий фосфор
Білий фосфор отримують відновленням фосфату кальцію вуглецем:
Ca3(PO4)2+3SiO2+5C=1/2P4+3CaSiO3+5CO. Має унікальні властивості-світиться в темряві. Це відбувається через
те, що пари, які постійно над ним, окиснюються з виділенням світла . Білий фосфор дуже отруйний. Доза 0,1 г смертельна для людини.
Слайд 5
Червоний фосфор.
При нагріванні білого фосфору у закритій посудині
до 260 градусів він перетворюється у червоний фосфор, який
менше реакційноздатний і абсолютно нешкідливий. Це перетворення відбувається повільно і при нормальній температурі під дією світла. Це порошок темно-червоного кольору. Зазвичай червоний фосфор є сумішшю фіолетового з розчином білого у фіолетовому фосфорі. Не світиться в темноті і самозаймається при температурі більше 400 градусів. Реагує з галогенами і сіркою при більш високій температурі і не осаджує метали із розчинів їх солей.
Слайд 6
Світло-червоний фосфор.
Отримується при кип’ятінні звичайного фосфору з трибромистим
фосфором. Більш реакційноздатний, ніж червоний. Він розчиняється в їдкому
лузі і осаджує мідь з розчину сульфату міді. Не отруйний.
Слайд 7
Фіолетовий фосфор.
Утворюється із білого фосфору при нагріванні
та високому тиску (500 атм). Схожий на червоний, але
більш однорідний. Він складається з групувань P8 і P9, які укладені в довгі трубчасті структури з п’ятикутним перетином.
Слайд 8
Чорний фосфор.
Отримують із білого фосфора нагріванням при 200
градусах і високому тиску 12000 атм. Нещодавно було знайдено,
що білий фосфор можна перетворювати на чорний без використання високого тиску при каталізаторній дії ртуті. Структура чорного фосфору нагадує графіт, тільки різниця в тому, що шари не плоскі, “гофровані”. У кристалах кожний атом зв’язаний з трьома іншими атомами. Утворюються нескінченні шари , які складаються з двох площин паралельних атомів. При нагріванні без доступу кисню він, як і червоний, переходить у пару, з якої конденсується білий фосфор.
Слайд 9
Хімічні властивості.
Фосфор належить до головної підгрупи п’ятої групи
періодичної системи Менделєєва. Порядковий номер його 15. Маючи на
зовнішній електронній оболонці 5 електронів, атоми фосфору виявляють властивості окисника і, приєднуючи від атомів інших елементів 3 електрони, яких бракує для заповнення зовнішньої оболонки перетворюються в негативно тривалентні іони. Разом з тим атоми фосфору можуть також втрачати свої валентні електрони, перетворюючись при цьому в позитивно заряджені іони.
Слайд 10
Взаємодіє з:
З киснем сполучається досить енергійно, особливо білий,
виділяючи значну кількість тепла і утворюючи пентоксид фосфору P2O5:
4P+5O2 =2P2O5.Фосфор досить легко реагує з іншими неметалами, особливо з хлором, з яким він навіть при невеликому нагріванні енергійно взаємодіє з утворенням безбарвних кристалів пентахлориду фосфоруPCl5:
2P+5Cl2=2PCl53
При дуже високій температурі фосфор, подібно до азоту, може сполучатися з багатьма металами, утворюючи фосфіди:
2P+3Ca=Ca3P2.
З воднем фосфор безпосередньо не взаємодіє. Але посереднім шляхом можна одержати сполуки фосфору з воднем. Наприклад, при дії на фосфід кальцію розведеної хлоридної кислоти утворюється фосфін PH3, який за своїми властивостями нагадує аміак:
- Ca3P2+6HCl=3CaCl2+2PH3.
Слайд 12
Отримання.
У вільному стані фосфор одержують шляхом відновлення фосфату
кальцію вугілля в присутності діоксиду кремнію :
Ca3(Po4)2+3SiO2=3CaSiO3+P2O5
P2O5+5C=2P+5COПроцес відновлення проводять у спеціальних електричних печах при температурі близько 1500 градусів. Діоксид кремнію додається для зниження температури реакції, витиснення фосфатного ангідриду з фосфату кальцію і видалення з печі твердих продуктів у вигляді розплавленого шлаку CaSiO3. Одержуваний фосфор виділяється в пароподібному стані, який потім охолоджують і збирають у приймачі з водою.